绿色魏斯氏菌实时荧光定量聚合酶链式反应检测方法的建立
张艺鸽,姜晓冰,*,于 涛,孙丽滢
(1.河南师范大学生命科学学院,河南 新乡 453007;2.新乡学院生命科学技术学院,河南 新乡 453003;3.佛山市海天调味食品股份有限公司,广东 佛山 528000)
绿色魏斯氏菌(Weissella viridescens)[1]属于乳杆菌目(Lactobacillales)、明串珠菌科(Leuconostocaceae)、魏斯氏菌属(Weissella)[2-4]。该菌在微观和宏观形态方面与乳酸菌的其他代表菌株相似,特别是容易与明串珠菌(Leuconostoc)和乳杆菌(Lactobacillus)[1]混淆。绿色魏斯氏菌为革兰氏阳性菌,呈不规则的短杆状,两端呈圆形或稍细小,成对或短链排列[5];在MRS琼脂培养基上形成透明的小菌落,呈微隆起圆形轮廓[6]。
绿色魏斯氏菌属于异型发酵乳酸菌,能够导致食品特别是肉制品的腐败变质[1,6-7]。当暴露于氧气中时,一些肉制品,如香肠、真空包装肉、烟熏肉等会出现变绿的现象。绿色魏斯氏菌是造成肉制品表面出现黏液并发绿的主要原因[1,6]。起初,黏液仅在单个菌落周围出现,之后逐渐形成一整片绿色的黏液,并从肉制品的表面向内部渗透。绿色魏斯氏菌已经成为威胁肉制品质量与安全的重要腐败菌,给肉类加工行业造成巨大的经济损失[6]。因此,建立快速、准确的检测方法对预防和控制绿色魏斯氏菌对食品的污染、保障食品质量与安全具有重要意义。
目前,针对绿色魏斯氏菌的检测方法十分有限。传统的绿色魏斯氏菌检测方法包括增菌培养、分离纯化、镜检和生化鉴定等步骤,耗时长、操作繁琐且结果可靠性低[8-10],严重影响检测鉴定的效率[11-13]。实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)检测技术具有操作简便、灵敏、特异、快速、直观、定量准确、闭管反应等优点[14-16]。食源性致病菌的检测多采用传统培养方法,其步骤冗繁,耗时费力[17-19]。因此,实时荧光定量PCR方法在食源性细菌检测中已得到广泛应用[20-22]。Gómez-Rojo等[23]建立了针对绿色魏斯氏菌特异性基因recN的Taq Man探针实时荧光定量PCR方法,但还未见报道绿色魏斯氏菌特异性基因的SYBR Green Ⅰ实时荧光定量PCR方法[24-25]。本研究以绿色魏斯氏菌特异性基因rpoA为靶基因,应用常规PCR技术[26-27]和SYBR Green Ⅰ实时荧光定量PCR技术[28]建立快速、准确检测绿色魏斯氏菌的方法。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
所用菌株如表1所示,其中绿色魏斯氏菌、粪肠链球菌、植物乳杆菌、嗜热链球菌、嗜酸乳杆菌、保加利亚乳杆菌、大肠杆菌及单核细胞增生李斯特菌均为本实验室保藏菌株,融合魏斯氏菌、食物魏斯氏菌以及乳明串珠菌由中国海洋微生物菌种保藏管理中心提供。
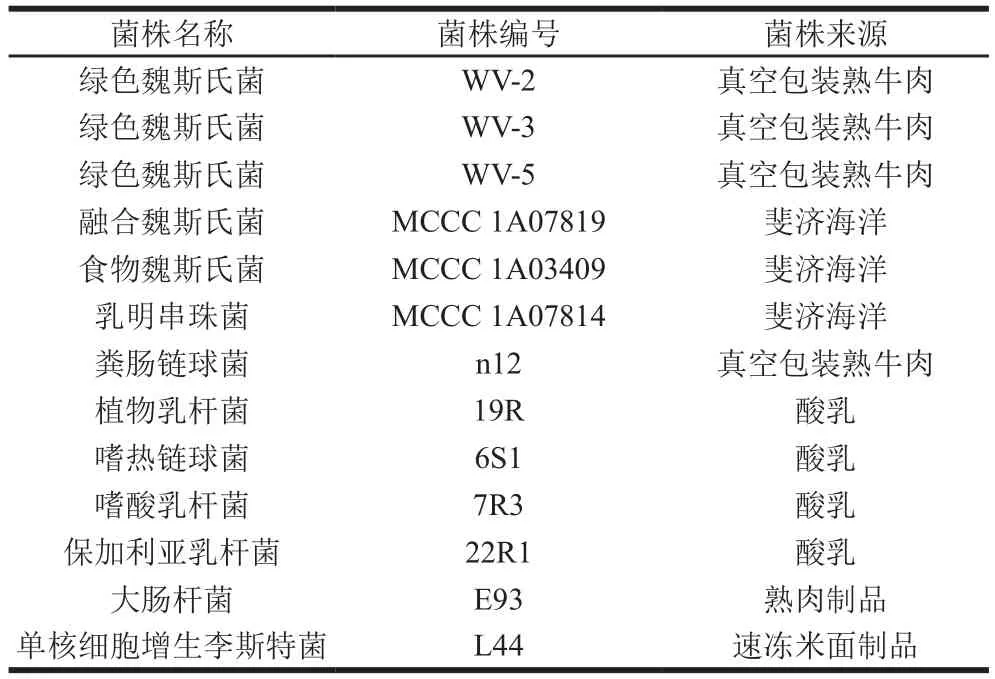
表1 所用菌株及其来源Table 1 Strains used in this study
1.1.2 试剂
细菌基因组DNA提取试剂盒、荧光定量PCR试剂盒北京天根生化科技有限公司;用于PCR扩增的试剂:Taq酶、10×PCR Buffer、dNTP、2 000 bp DNA Marker宝生物工程(大连)有限公司;MRS肉汤培养基 北京陆桥技术有限责任公司。
1.2 仪器与设备
DH360电热恒温培养箱 北京科伟永兴仪器有限公司;THZ-82气浴恒温振荡器 江苏省金坛市天竟实验仪器厂;ETC811基因扩增仪 北京东胜创新生物科技有限公司;DYY-8C电泳仪 北京市六一仪器厂;TGL-16B离心机 上海安亭科学仪器厂;DG-800旋涡混合器 北京鼎国昌盛生物技术有限责任公司;Universal Hood Ⅱ凝胶成像分析系统 美国Bio-Rad公司;LightCycler@96实时荧光定量PCR仪 瑞士Roche公司;NanoDropTM2000微量分光光度计 美国Thermo Scientific公司。
1.3 方法
1.3.1 细菌基因组DNA的提取
利用试剂盒提取细菌基因组DNA,利用分光光度计测定其浓度和纯度。具体操作如下:用移液枪取1 μL DNA样品滴加到检测平台上,分别读取样品在260、280 nm波长处的吸光度(A),A260nm反映DNA样品的浓度,A260nm和A280nm的比值(A260nm/A280nm)反映样品的纯度。
1.3.2 引物的设计与合成
从GenBank中下载绿色魏斯氏菌的rpoA基因靶序列,登录号为AM711320,应用Dnaman软件进行同源性分析,确定在绿色魏斯氏菌菌株内保守、其他菌株间特异的片段。应用Primerpremier 5.0生物软件设计1 对引物,预计扩增长度为196 bp,引物由生工生物工程(上海)股份有限公司合成。引物序列:上游引物:5’-GATTTCGTTGGTGATGCTG-3’;下游引物:5’-CGATTGGGGTAAAGATTGA-3’。
1.3.3 PCR扩增
1.3.3.1 常规PCR反应体系
10×Buffer 2.5 μL、dNTP(2.5 mmol/L)2 μL、上下游引物各1.5 μL、Taq酶0.125 μL、DNA模板1 μL、无菌水补足至25 μL。反应程序:95 ℃预变性5 min,接着反应30 个循环,每个循环包括94 ℃变性40 s、51 ℃退火30 s、72 ℃延伸20 s,循环结束后,72 ℃延伸10 min。反应产物用1%琼脂糖凝胶电泳检测并观察结果。
1.3.3.2 实时荧光定量PCR反应体系
2×SuperReal PreMix Plus 12.5 μL、DNA模板1 μL、上下游引物各1.5 μL、无酶水(RNase-Free ddH2O),补足至25 μL。反应程序:预变性:95 ℃、15 min;变性:95 ℃、10 s;退火:60 ℃、30 s;延伸:72 ℃、30 s;反应进行40 个循环。
1.3.4 特异性评价
以表1所列菌株的基因组DNA为模板,并用无菌水作为无模板空白对照,按照1.3.3节所述条件进行PCR扩增,通过观察电泳条带和扩增曲线分别验证常规PCR和实时荧光定量PCR方法的特异性。
1.3.5 灵敏度评价
1.3.5.1 基因组DNA灵敏度评价
将已知浓度的绿色魏斯氏菌基因组DNA进行10 倍梯度稀释,每个稀释度的DNA样品各取1 μL为模板,按照
1.3.3 节所述条件进行PCR扩增,能得到肉眼可见条带或明显扩增曲线(“S”型扩增曲线)的最低浓度即为PCR检测体系灵敏度。
1.3.5.2 纯培养物检测灵敏度评价
绿色魏斯氏菌经纯培养后,用MRS培养基做10 倍梯度稀释,并选择10-5、10-6和10-73 个稀释度做平板计数,以此计算原始菌落数。同时每个稀释度各取3 mL菌液提取DNA,取1 μL为模板,按照1.3.3节所述条件进行PCR扩增,能得到肉眼可见条带或明显扩增曲线(“S”型扩增曲线)的最低浓度即为PCR检测体系灵敏度。
1.3.6 实时荧光定量PCR检测结果准确性评价
将已知浓度的绿色魏斯氏菌基因组DNA进行10 倍梯度稀释,每个稀释度的DNA样品各取1 μL为模板,按照1.3.3.2节所述条件进行实时荧光定量PCR扩增(每个浓度梯度3 个平行),以循环阈(circulation threshold,Ct)值为纵坐标,DNA模板量的对数为横坐标绘制标准曲线。
再以10 倍梯度稀释的绿色魏斯氏菌基因组DNA为模板进行实时荧光定量PCR,独立重复3 次,评价实验结果的可重复性;根据标准曲线分别计算模板的浓度,并将计算值与理论值进行比较,评价定量结果的可靠性。
1.3.7 人工污染食品样品检测
取绿色魏斯氏菌菌液进行10 倍梯度稀释,选择10-5、10-6和10-73 个稀释度做平板计数,计算纯培养物的初始菌落数。取若干个稀释度(原液、10-1~10-8)的菌液各1 mL添加到25 g无菌牛肉样品中,加入40 mL蛋白胨水,均质2 min;取40 mL均质液,2 000 r/min离心10 min以沉淀食品杂质;吸取上清液转移至干净无菌的离心管中,10 000 r/min离心3 min后,缓慢倒掉上清液,获得菌体沉淀,用于基因组DNA的提取;取1 μL作为模板,按照1.3.3节所述条件进行PCR扩增,能得到肉眼可见条带或明显扩增曲线的最低浓度即为PCR检测体系灵敏度。
2 结果与分析
2.1 常规PCR及实时荧光定量PCR方法的特异性

表2 菌株常规PCR及实时荧光定量PCR检测结果Table 2 Routine PCR and real-time quantitative PCR detection results

图1 绿色魏斯氏菌常规PCR检测结果Fig. 1 Detection of Weissella viridescens by conventional PCR
以建立的常规PCR体系对表1所列的菌株进行检测。由表2及图1可知,只有绿色魏斯氏菌反应结果为阳性,且扩增出196 bp的目的产物。
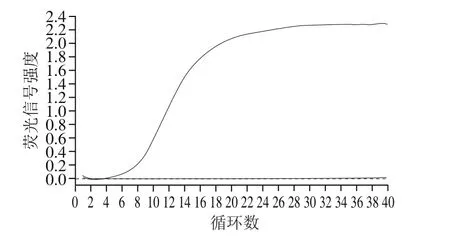
图2 绿色魏斯氏菌实时荧光定量PCR扩增曲线Fig. 2 Amplification curve of quantitative real-time PCR for Weissella viridescens
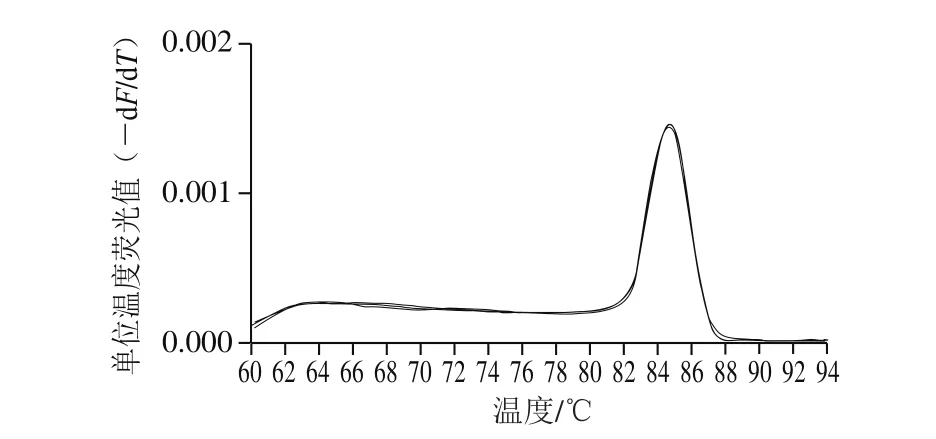
图3 绿色魏斯氏菌实时荧光定量PCR熔解曲线Fig. 3 Melting curve of quantitative real-time PCR for Weissella viridescens
利用本研究建立的绿色魏斯氏菌实时荧光定量PCR检测方法对表1所列菌株进行检测。由图2~3可知,只有绿色魏斯氏菌能够产生典型的“S”型扩增曲线,绿色魏斯氏菌的熔解曲线均在85 ℃出现1 个目标条带特异熔解峰,表明所用引物的特异性强,并且稳定性良好。
2.2 灵敏度
2.2.1 基因组DNA灵敏度

图4 绿色魏斯氏菌基因组DNA常规PCR灵敏度检测结果Fig. 4 Sensitivity evaluation of conventional PCR for genomic DNA from Weissella viridescens
经过测定可知绿色魏斯氏菌基因组DNA的质量浓度为267 ng/μL。由图4可知,对于常规PCR体系,当绿色魏斯氏菌基因组DNA质量浓度低至2.667 pg/μL时仍能观察到1 条扩增条带,表明该方法的检测下限为2.667 pg/μL。

图5 绿色魏斯氏菌基因组DNA实时荧光定量PCR扩增曲线Fig. 5 Amplification curve of quantitative real-time PCR for genomic DNA from Weissella viridescens
由图5可知,对于实时荧光定量PCR体系,当绿色魏斯氏菌基因组DNA模板质量浓度低至2.667×10-3pg/μL时仍能观察到明显的扩增曲线,因此该方法的检测下限为2.667×10-3pg/μL。
2.2.2 纯培养物DNA灵敏度

表3 纯培养物DNA检测灵敏度测定结果Table 3 Results of sensitivity evaluation for DNA of pure bacterial culture
通过平板计数可知,绿色魏斯氏菌纯培养物的初始菌液浓度为3×109CFU/mL。由表3可知:对于常规PCR体系,当纯培养物浓度低至3×104CFU/mL时仍能观察到扩增条带,表明该方法的灵敏度为3×104CFU/mL,即30 CFU/PCR反应;对于实时荧光定量PCR体系,当纯培养物浓度低至30 CFU/mL时仍能观察到扩增曲线,则该方法的灵敏度为30 CFU/mL。
2.3 实时荧光定量PCR检测结果的准确性
2.3.1 标准曲线的绘制
根据1.3.6节单独绘制标准曲线,得到标准曲线方程为y=-3.46x+16.30(R2=0.99)。曲线呈现良好的线性关系,定量准确。
2.3.2 独立重复实验结果分析
由表4可知:梯度稀释DNA 3 次独立重复实验的Ct值标准差均小于1,变异系数为0.02%~1.28%,说明检测结果重复性好;计算结果与理论计数处于同一数量级水平,说明定量准确可靠。

表4 荧光定量PCR检测结果的准确性Table 4 Accuracy analysis of the results of real time PCR detection
2.4 人工污染食品样品检测结果

表5 人工污染食品样品检测结果Table 5 Results of detection of artificial contaminated food samples
根据平板计数结果可知,绿色魏斯氏菌的初始菌液浓度为2×109CFU/mL。由表5可知:对于常规PCR体系,当污染牛肉样品的菌液浓度低至8×102CFU/g时仍能观察到扩增条带,表明该方法的检测下限为8×102CFU/g;对于实时荧光定量PCR体系,当污染牛肉样品的菌液浓度低至0.8 CFU/g时仍能观察到扩增曲线,则该方法的检测下限为0.8 CFU/g。
3 讨 论
性能优良的引物是建立准确可靠的PCR检测体系的前提,而优良的引物则依赖于高度特异的检测靶基因。在前期研究中,利用生物信息学方法,对绿色魏斯氏菌种内及种间的DNA序列进行比对,选择了6 条绿色魏斯氏菌种内保守、种间特异的序列。针对这些序列设计引物并进行PCR扩增验证,最终选择性能最好的1 对引物建立PCR检测体系。该引物对应的靶基因即为绿色魏斯氏菌的rpoA基因,该基因编码DNA指导的RNA聚合酶α亚基,参与DNA的复制过程,种内高度保守。本研究根据绿色魏斯氏菌rpoA基因的保守片段设计引物,结果表明,基于rpoA基因的常规PCR和实时荧光定量PCR检测的特异性均为100%。
本研究所建立的实时荧光定量PCR方法的灵敏度达2.667×10-3pg/μL,对纯培养物和模拟污染牛肉样品直接检测的灵敏度分别为30 CFU/mL和0.8 CFU/g。与常规PCR相比,实时荧光定量PCR检测的灵敏度是其1 000 倍[29]。目前,国内外关于绿色魏斯氏菌的快速检测方法鲜有报道。西班牙学者Gómez-Rojo等[23]建立了针对绿色魏斯氏菌特异性基因recN的Taq Man探针实时荧光定量PCR方法[30],该方法的灵敏度为8.2×10-2pg/PCR,相应的平均Ct值为40.0;在人工污染布尔格斯血肠样品试验中,其检测灵敏度为100 CFU/g,相应的平均Ct值为41.6。Taq Man探针法需要专门合成特异性的探针,价格昂贵。相比之下,本研究建立的基于rpoA基因的绿色魏斯氏菌SYBR Green Ⅰ实时荧光定量PCR方法灵敏度更高、成本低。
实时荧光定量PCR方法独立重复实验结果表明,变异系数为0.02%~1.28%,表明重复性良好,实时荧光定量PCR方法能对样品进行稳定、可靠的检测。与常规PCR相比,该方法不需要电泳检测、不使用染料溴化乙锭,安全性更高。绿色魏斯氏菌在微观和宏观形态方面与明串珠菌和乳杆菌十分相似,传统的检测方法有时也难以将其区分。本研究建立的绿色魏斯氏菌实时荧光定量PCR方法具有很高的特异性,能充分保证检测结果的准确可靠。
综上所述,本研究所建立的绿色魏斯氏菌SYBR Green Ⅰ实时荧光定量PCR方法灵敏度高、特异性强,可以实现准确定量。与探针法相比,成本更低,操作更方便,适合PCR技术的标准化推广。

