低盐腊肉加工期间品质和菌相变化
柴子惠,李洪军,2,李少博,李冉冉,余思洁,李敏涵,贺稚非,2,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
腊肉是我国传统腌腊肉制品中的杰出代表,是原料肉经预处理、腌制、熏烤成熟制成的一类肉制品[1],因其独特的腊香味和悦人的玫瑰红色,广受消费者的喜爱,在我国南方食用较多,尤其是四川、广东一带。腊肉风味异常独特,由咸味、烟熏味、鲜味混合而成[2],同时营养丰富,市场前景广阔[3]。
传统腊肉通过加入大量的盐分来抑制微生物的生长,从而延长腊肉的货架期,部分腊肉的食盐含量甚至可以达到8%[4]。但研究发现,摄入大量食盐会增加人体患高血压和心血管疾病的几率[5],同时传统腊肉通常采取烟熏工艺,该技术不够成熟,全凭经验操作,导致产品品质不均一,并且烟熏过程会形成致癌物质,危害人体健康[6]。因此,降低腊肉的食盐添加量和改进烟熏技术很有必要。
目前,研究人员常用液熏剂熏制腊肉。例如,赵冰等[7]从感官评价、色泽和挥发性风味物质等方面研究苹果木烟熏液和市售烟熏液腊肉,结果表明,苹果木烟熏液赋予腊肉更好的品质;李念念[8]通过正交试验对液熏工艺进行优化,实现了液熏液的复配。同时,研究人员还采用其他非钠盐代替钠盐来降低食盐含量。例如,张东等[9]用22% KCl和11%抗坏血酸钙替代腊肉中33%的盐分,取得了较好的试验结果;杨应笑等[10]分别以20%、30%、40%、50%和60%的氯化钾替代氯化钠,通过理化性质及感官品质分析得出氯化钾的最佳替代量为40%。但是,目前缺乏对不同食盐添加量的腊肉在加工过程中食用品质和菌相变化的研究。
本研究以中式腊肉为研究对象,比较不同食盐添加量(低补组:2.68% NaCl+1.32%替代盐,低盐组:4.00% NaCl,高盐组:6.00% NaCl)对腊肉加工过程中pH值、水分含量、保水性、色泽及剪切力等品质特性的影响,同时探讨不同食盐添加量的腊肉在加工过程中菌落总数、乳酸菌、葡萄球菌和微球菌等菌相变化的规律,以期为低盐腊肉的制备提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
新鲜猪后腿肉(置于4 ℃冰箱中备用)、辅料(食盐、十三香、花椒、白砂糖、料酒) 重庆市北碚区永辉超市;食品添加剂:复合磷酸盐、抗坏血酸钙、亚硝酸钠、氯化钾、Ⅱ-普通山楂核烟熏香味料(均为食品级,符合GB 2760—2016《食品安全国家标准 食品添加剂使用标准》) 济南华鲁食品有限公司;其他试剂均为分析纯。
1.2 仪器与设备
UltraScan PRO测色仪 美国Hunter Lab公司;UB-7 pH计 德国Sartorius AG公司;DGG-9240A电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;HH-4数显恒温水浴锅 江苏省金坛市富华仪器有限公司;722可见分光光度计 上海元析仪器有限公司;BSA323S电子天平 赛多利斯科学仪器(北京)有限公司;XHF-D高速分散器 宁波新芝生物科技股份有限公司;TOMYSS-325高压灭菌锅 日本Tomy Kogyo公司;C-LM3B数显式肌肉嫩度仪 北京天翔飞城仪器设备有限公司;CT-3质构仪 美国Brookfield公司。
1.3 方法
1.3.1 腊肉加工工艺
腊肉加工工艺[9]:新鲜猪后腿肉→修整切割→常压腌制→冲去表面杂物→浸渍液熏→热风干燥→冷却→成品
取新鲜猪后腿肉,切成大小相似的长方体,每块长15 cm、宽2.5 cm、高5 cm,质量约250 g;然后去除淤血、筋膜等放入配制好的腌制液中,在10 ℃条件下腌制5 d,每24 h上下翻面1 次;腌制好的肉用30 ℃左右的温水冲去表面杂物;沥干表面水分后,把肉浸泡在5%的Ⅱ-普通山楂核烟熏香味料溶液中浸泡3 h后,将肉放入烘箱中50 ℃烘烤48 h;烘烤后,待腊肉中心温度降低到室温,即为成品。
腌制液中食盐及替代盐添加量[9,11]如表1所示。

表1 不同组腊肉腌制液的组成Table 1 Low and high salt contents and partial salt subtraction used for Chinese cured meat
1.3.2 取样
在同一批次腊肉加工过程中,分别取原料肉、腌制1 d、腌制3 d、腌制5 d、液熏后、烘烤1 d及成品7 个工艺点样品的肌肉和皮下脂肪,先测定菌相指标,后测定理化指标。
1.3.3 指标测定
1.3.3.1 pH值
参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》[12],同一样品平行测定3 次。
1.3.3.2 水分含量
参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[13]中的直接干燥法。
1.3.3.3 食盐含量
参照GB 5009.42—2016《食品安全国家标准 食盐指标的测定》[14],同一样品平行测定3 次。
1.3.3.4 蒸煮损失率
参照Honikel[15]的方法,并稍作修改。将腊肉表面的水分沥干后,密封装于蒸煮袋中,80 ℃条件下水浴20 min,降温后再次沥干腊肉表面水分,称质量。蒸煮损失率按照公式(1)计算。

式中:m1为蒸煮前质量/g;m2为蒸煮后质量/g。
1.3.3.5 压榨损失率
参照魏心如等[16]的方法,并稍作修改。称取(1.000±0.001) g腊肉,上下分别放置18 张滤纸,在20 kg压力下静置5 min,称质量。压榨损失率按照公式(2)计算。

式中:m3为压榨前腊肉质量/g;m4为压榨后腊肉质量/g。
1.3.3.6 色泽
参照王春青等[17]的方法。随机取不同的腊肉样品切成小块,利用色差仪随机测定不同部位的亮度值(L*)、红度值(a*)和黄度值(b*),每个样品重复测定6 次,取平均值。
1.3.3.7 质构
将腊肉沿肌纤维方向切成2.0 cm×1.0 cm ×1.0 cm的肉块,用TPA模式测定。测定参数:测定前探头速率2.00 mm/s;测定时探头速率1.00 mm/s;测定后探头速率1.00 mm/s;测定距离5.0 mm;探头2 次测定间隔时间3.00 s;触发类型:自动;触发力5.0 g;探头型号:P36R;数据截取速率200.00 点/s。
1.3.3.8 菌落总数
参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[18],结果表示为(lg(CFU/g))。
1.3.3.9 乳酸菌菌落计数
参照GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》[19],结果表示为(lg(CFU/g))。
1.3.3.10 微球菌和葡萄球菌菌落计数
参照刘洋[20]的方法,将平板在(30±1) ℃条件下放置(48±2) h后计数,结果表示为(lg(CFU/g))。
1.4 数据处理
用Microsoft Excel 2016软件计算平均值和标准偏差,SPSS 20.0软件对数据进行差异显著性分析(P=0.05),利用Origin 8.0软件(OriginLab公司)绘制标准曲线和指标变化图。
2 结果与分析
2.1 腊肉加工过程中pH值的变化
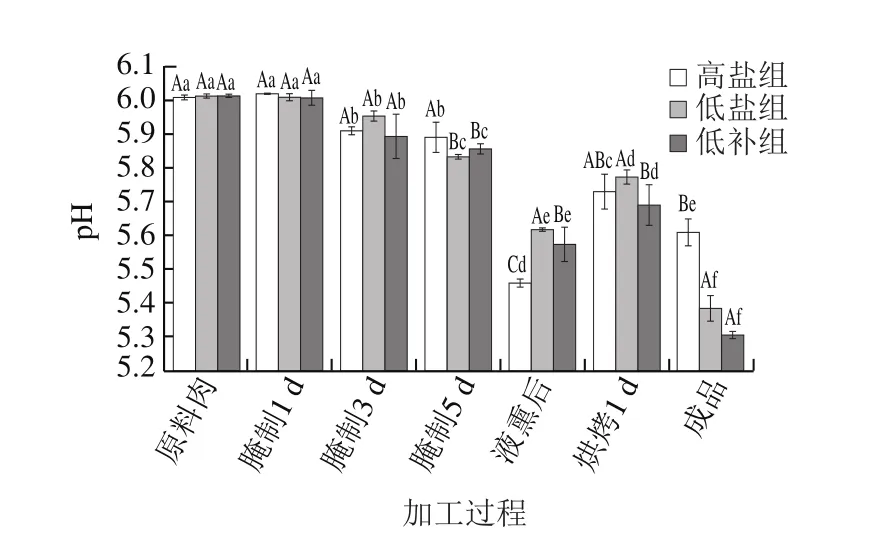
图1 腊肉加工过程中pH值的变化Fig. 1 Changes in pH value during processing of Chinese cured meat
pH值是反映肉类品质的重要指标,对肉品的口感、滋味、色泽等均有影响[17]。由图1可知,在腊肉的加工过程中,3 组腊肉的pH值均在腌制阶段逐渐下降,液熏阶段降到最低,烘烤过程又逐渐上升。3 组腊肉腌制阶段pH值逐渐下降和腌制阶段乳酸菌数量逐渐增长有关,与陈美春[21]、徐雯雅[22]等的研究结果一致。液熏后腊肉pH值降至最低和液熏液pH值低有关,液熏液的pH值仅为2.69。烘烤阶段,腊肉pH值有所回升,这可能和腊肉加工过程中蛋白质降解有关[21]。3 组腊肉成品中,高盐组腊肉pH值最高,为5.61,低盐组和低补组分别为5.38和5.30,后2 组腊肉没有显著差异(P>0.05),说明替代盐对腊肉成品pH值没有显著影响,这和徐雯雅等[22]的结论相似。
2.2 腊肉加工过程中水分含量、食盐含量的变化

图2 腊肉加工过程中水分含量的变化Fig. 2 Changes in moisture content during processing of Chinese cured meat
水分是发生生化反应和微生物活动的重要介质,腊肉中水分含量高,则会加快其腐败,如果水分含量低,则腊肉的口感不佳[23]。由图2可知,整个加工过程中,腊肉的水分含量呈现先缓慢上升,烘烤阶段急速下降的趋势,3 组腊肉的变化趋势一致。腌制第1天,腊肉水分含量下降明显,这是由于盐分在渗透压作用下从肉表面逐渐向内部渗透,同时腊肉中的水分向外排出,水分排出程度较高[24]。高盐组、低盐组和低补组腊肉成品的水分含量分别为50.58%、50.51%和52.40%,相比原料肉分别下降30.76%、30.85%和28.27%。低补组腊肉成品水分含量显著高于高盐组和低盐组(P<0.05),这可能是由于高盐组和低盐组食盐含量更高,渗透压增加,从而使腊肉脱水,导致水分含量更低[25]。低补组腊肉较高的水分含量使其口感更为柔软,但较高的水分含量可能会导致微生物生长活动旺盛。

图3 腊肉加工过程中食盐含量的变化Fig. 3 Changes in salt content during processing of Chinese cured meat
由图3可知,3 组腊肉从原料肉到液熏后的食盐含量波动上升,这是由于腌制初期,腌制液中的食盐含量远高于肌肉,渗透压差明显,随着腌制的进行,食盐逐渐从肉表面进入内部,肌肉食盐含量增加,腌制液和肌肉渗透压差逐渐缩小,食盐扩散速率逐步减缓,直到肌肉内外渗透压达到平衡状态[26-27]。烘烤阶段因高温和强通风环境腊肉水分大量损失,引起腊肉食盐含量显著上升(P<0.05)。腌制期间,高盐组、低盐组和低补组腊肉的食盐含量有显著差异(P<0.05),这是由于腌制液浓度对食盐扩散有显著影响,食盐浓度越高,渗透压差越大,NaCl扩散量也就越大[28]。高盐组、低盐组和低补组腊肉成品的食盐含量分别为6.20%、4.75%和3.05%,低补组腊肉的食盐含量相比高盐组腊肉下降50.81%,相比低盐组腊肉下降35.79%。
2.3 腊肉加工过程中保水性的变化
蒸煮损失率和压榨损失率是反映肉制品保水性的重要指标。通常来说,蒸煮损失率和压榨损失率越小,保水性越好,肉制品更嫩,口感越好[29]。由图4可知:3 组腊肉从原料肉到腌制第1天,蒸煮损失率有所上升,这可能是由于腌制初期,腊肉渗透压加大,质量增加,但此时结合力较小[30];3 组腊肉的蒸煮损失率均在腌制第3天显著减小(P<0.05),这可能是由于食盐和复合磷酸盐增加了腊肉的持水力[31];液熏后,3 组腊肉的蒸煮损失率有所增加,这可能和腊肉的pH值较低有关[32]。最终,高盐组、低盐组和低补组腊肉成品的蒸煮损失率分别为10.32%、11.40%和11.57%,低补组腊肉显著高于高盐组(P<0.05),但和低盐组没有显著差异(P>0.05),表明替代盐并不影响腊肉的蒸煮损失率。
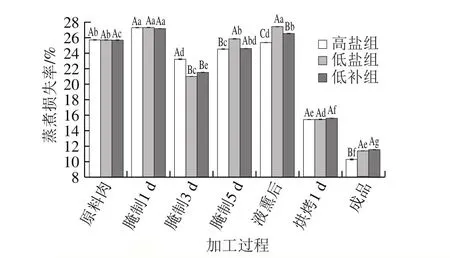
图4 腊肉加工过程中蒸煮损失率的变化Fig. 4 Changes in cooking loss during processing of Chinese cured meat
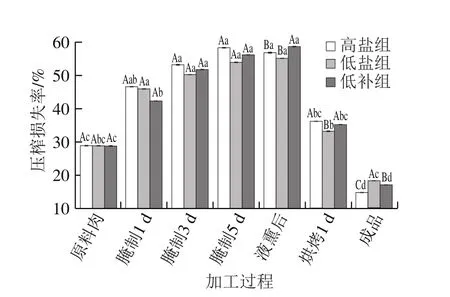
图5 腊肉加工过程中压榨损失率的变化Fig. 5 Changes in expressible moisture loss during processing of Chinese cured-meat
由图5可知,3 组腊肉从原料肉到液熏后的压榨损失率一直在上升,液熏后到成品的压榨损失率一直在下降,这可能是由于烘烤时腊肉在高温环境下损失大量水分导致的[33]。
2.4 腊肉加工过程中色泽的变化
L*表示肉的亮度,数值越大表示肉颜色越亮,L*是消费者评价肉类品质很重要的一项指标。由表2可知,3 组腊肉均在液熏后达到最大L*,这是由于pH值对腊肉色泽影响较大,液熏过程pH值较低使得L*增加[34]。烘烤结束后,腊肉的L*下降,这是由于水分大量损失,肉质变硬引起的。最终低补组腊肉成品和高盐组的L*没有显著差异(P>0.05),但均显著高于低盐组腊肉(P<0.05)。
a*表示肉品的红度,a*越大,肉的红色度越大。3 组腊肉从原料肉到腌制结束,a*越来越小,这是由于随着腌制的进行,血红蛋白流失,同时在食盐作用下肌红蛋白转化为褐色的高铁肌红蛋白[35]。烘烤阶段,腊肉的a*上升,这是由于亚硝酸盐与肌红蛋白生成亚硝基肌红蛋白,呈现血红色[36]。最终,低补组腊肉成品的a*和高盐组没有显著差异(P>0.05),但均显著高于低盐组腊肉(P<0.05)。由此表明,添加替代盐有效改善了因减盐而造成的对腊肉L*和a*的影响。

表2 腊肉加工过程中色泽的变化Table 2 Changes in color parameters during processing of Chinese cured meat
2.5 腊肉加工过程中质构的变化
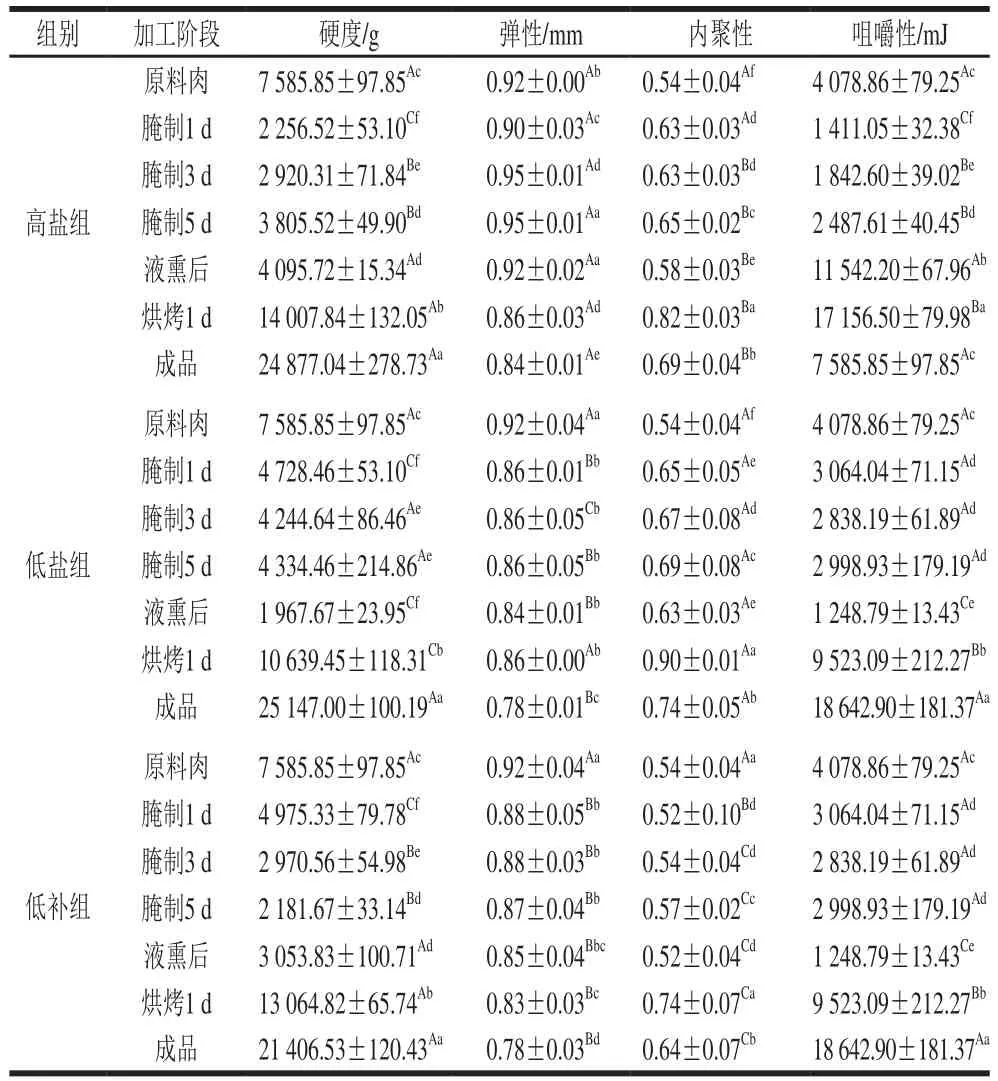
表3 腊肉加工过程中质构的变化Table 3 Changes in texture during processing of Chinese cured meat
质构是腊肉品质的重要指标之一,和腊肉的状态和组织结构有关,影响质构的因素有硬度、弹性、内聚性和咀嚼性等。由表3可知,相比原料肉,3 组腊肉腌制开始后硬度均显著减小(P<0.05),这是由于腊肉中的盐溶性蛋白析出,同时食盐逐渐进入腊肉内部,改善腊肉组织结构和对脂肪的结合力,这可能和二硫键的参与有关[37]。腌制阶段,随着腊肉内外渗透压的动态平衡,硬度出现波动变化。烘烤阶段,因持续高温烘烤引起腊肉胶原蛋白和肌纤维蛋白变形以及大量水分损失,使得肉质紧实,引起质构变化[38]。烘烤阶段,3 组腊肉的硬度显著大于其余加工阶段(P<0.05),内聚性显著大于其余加工阶段(P<0.05),由此说明烘烤过程对腊肉质构影响很大。
虽然3 组腊肉的质构在加工过程中的不同工艺点之间有显著差异(P<0.05),但最终成品的硬度和咀嚼性并无显著差异(P>0.05),这和Kim等[39]研究用氯化钾代替50%氯化钠制作的发酵肉制品时,质构、口感均无明显变化的结论相同,同时也和Choi[40]、Jimenez-Colmenero[41]等的研究结论一致。由此证明,替代盐并不影响腊肉的质构。
2.6 腊肉加工过程中菌相的变化

表4 腊肉加工过程中菌相的变化Table 4 Changes in microbial composition during processing of Chinese cured meatlg(CFU/g)
由表4可知,从原料肉开始到腌制第5天,各组腊肉的菌落总数一直上升,液熏后到成品,腊肉的菌落总数显著下降(P<0.05),这是由于液熏液的pH值降低以及烘烤阶段水分的大量损失不利于微生物生长。高盐组、低盐组和低补组产品最终的菌落总数分别为3.26、3.93、3.80 (lg(CFU/g)),菌落总数由大到小依次为低盐组>低补组>高盐组。3 组腊肉成品的菌落总数各不相同,但替代盐的加入有效改善了腊肉的菌落总数。高盐组腊肉菌落总数最小,是因为其食盐含量最大,渗透压高,水分含量少,这与图2所得结论一致。
3 组腊肉加工过程中的乳酸菌数量变化趋势一致,均为腌制过程中逐步增加,液熏阶段和烘烤阶段数量下降。腌制阶段乳酸菌数量逐步增多是由于乳酸菌产酸,导致腊肉pH值逐渐下降。但液熏阶段,液熏液pH值仅为2.69,pH值过低,抑制乳酸菌的生长,后由于高温烘烤,水分大量损失,乳酸菌可以利用的水分减少,导致乳酸菌数量下降,同时蛋白质降解生成碱性物质,也导致乳酸菌数量减少[42]。乳酸菌是影响腊肉风味形成很重要的微生物。3 组腊肉成品的乳酸菌数量并无显著差异(P>0.05),由此表明,添加替代盐并未影响乳酸菌的生长。
葡萄球菌和微球菌对游离氨基酸的释放和脂类分解有定向作用,是腊肉风味物质形成的主要菌系[43]。腊肉加工过程中,葡萄球菌和微球菌数量波动上升,但液熏阶段有所下降,这是由于该阶段pH值较低,不利于微生物生长。高盐组、低盐组和低补组腊肉成品的葡萄球菌和微球菌数量分别为3.237、3.293、3.457 (lg(CFU/g)),其中低补组和低盐组腊肉显著高于高盐组(P<0.05),这是由于其水分含量高,利于微生物生长。低补组腊肉葡萄球菌和微球菌数量最多,有利于腊肉风味的形成,表明添加替代盐有利于腊肉风味的形成。
2.7 3 组腊肉指标间的相关性分析
2.7.1 高盐组腊肉各指标间的相关性分析
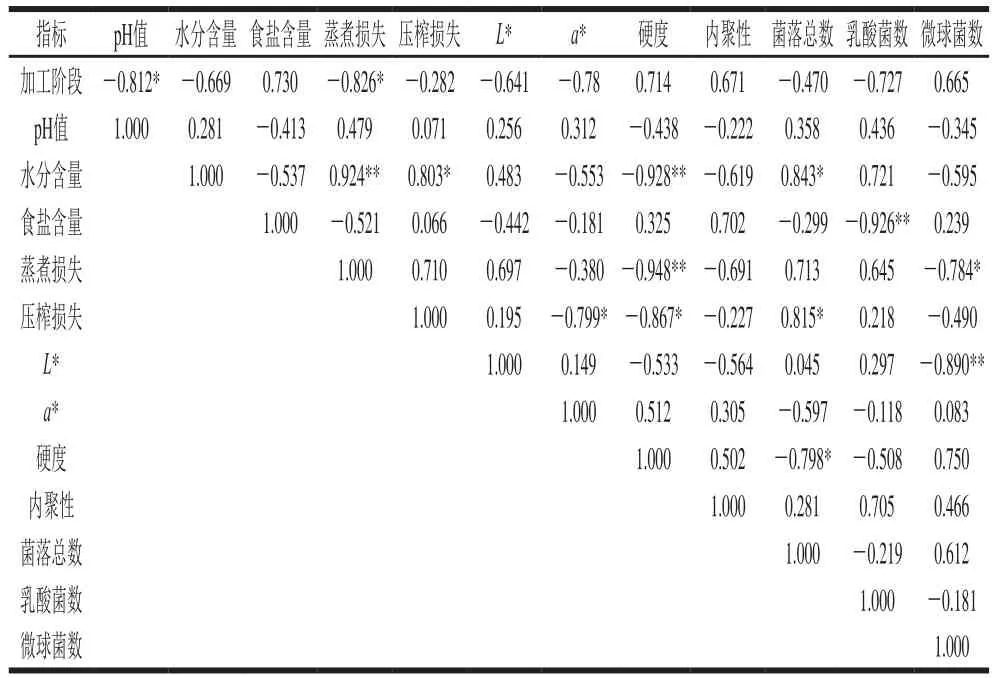
表5 高盐腊肉加工过程中各指标间的相关性Fig. 5 Correlation analysis of various quality parameters of high salt Chinese cured meat
由表5可知,通过Pearson相关性分析发现,高盐组腊肉加工过程中的所有指标均和加工阶段的变化具有相关性,且pH值、蒸煮损失与加工阶段的变化在0.05水平上(双侧)显著相关(P<0.05),且二者均与加工阶段具有显著负相关性,即随着加工的进行,这些指标的数值呈现不同程度降低。
蒸煮损失、硬度均和水分含量的变化在0.01水平(双侧)显著相关(P<0.01),菌落总数和水分含量在0.05水平上(双侧)显著相关(P<0.05)。其中,蒸煮损失和水分含量具有极显著正相关性,硬度和水分含量具有极显著负相关性,菌落总数和水分含量呈现显著正相关性。
乳酸菌数量和食盐含量在0.01水平上(双侧)显著相关(P<0.01),二者呈极显著负相关;硬度和蒸煮损失的变化在0.01水平上(双侧)显著相关(P<0.01),二者呈极显著负相关;微球菌数量和蒸煮损失在0.05水平上(双侧)显著相关(P<0.05),二者呈显著负相关;a*、硬度、菌落总数和压榨损失在0.05水平上(双侧)显著相关(P<0.05),其中a*、硬度和压榨损失呈显著负相关,菌落总数和压榨损失呈显著正相关;微球菌数量和L*在0.01水平上(双侧)显著相关(P<0.01),且二者呈极显著负相关;菌落总数和硬度在0.05水平上(双侧)显著相关(P<0.05),二者呈显著负相关。
综上所述,在高盐组腊肉加工过程中,随着贮藏时间的增加,腊肉的品质和菌相发生了很大变化,加工工艺可以影响各指标的变化,并且各指标间也有一定的相关性。
2.7.2 低盐组腊肉各指标间的相关性分析

表6 低盐腊肉加工过程中各指标间的相关性Fig. 6 Correlation analysis of various quality parameters for low salt Chinese cured meat
由表6可知,低盐组腊肉加工过程中的所有指标均和加工阶段的变化具有相关性,且pH值和加工阶段在0.01水平上(双侧)显著相关(P<0.01),且二者呈极显著负相关。L*、乳酸菌数量和加工阶段在0.05水平上(双侧)显著相关(P<0.05),且均呈显著负相关。蒸煮损失、硬度和水分含量在0.01水平上(双侧)显著相关(P<0.01),压榨损失、乳酸菌数量和水分含量在0.05水平上(双侧)显著相关(P<0.05)。其中,蒸煮损失和水分含量呈极显著正相关,硬度和水分含量呈极显著负相关,压榨损失、乳酸菌数量和水分含量呈显著正相关。乳酸菌数量和食盐含量在0.05水平上(双侧)显著相关(P<0.05),且呈显著负相关;硬度、微球菌数量均和蒸煮损失在0.05水平上(双侧)显著相关(P<0.05),且均呈显著负相关。硬度和压榨损失在0.01水平上(双侧)显著相关(P<0.01),且呈极显著负相关;菌落总数和压榨损失在0.05水平上(双侧)显著相关(P<0.05),且呈显著正相关。微球菌数量和L*在0.05水平上(双侧)显著相关(P<0.05),且呈显著负相关;内聚性和乳酸菌数量在0.05水平上(双侧)显著相关(P<0.05),且呈显著负相关。综上所述,在低盐组腊肉加工过程中,随着贮藏时间的增加,腊肉的品质和菌相发生了很大变化,加工工艺可以影响各指标的变化,并且各指标间也有一定的相关性。
2.7.3 低补组腊肉各指标间的相关性分析

表7 低补腊肉加工过程中各指标间的相关性Fig. 7 Correlation analysis of various quality parameters for salt substitute Chinese cured meat
由表7可知,低补组腊肉加工过程中的指标均和加工阶段的变化具有相关性,且pH值、微球菌数量和加工阶段在0.01水平上(双侧)显著相关(P<0.01),pH值和加工阶段具有显著负相关性,微球菌数量和加工阶段具有极显著正相关性。食盐含量、蒸煮损失、L*、乳酸菌数量均和加工阶段在0.05水平上(双侧)显著相关(P<0.05),其中食盐含量呈显著正相关,蒸煮损失、L*、乳酸菌数量和加工期呈显著负相关。L*、微球菌数量和pH值在0.05水平上(双侧)显著相关(P<0.05),其中L*和pH值呈显著正相关,微球菌数量和pH值呈显著负相关。蒸煮损失、硬度和水分含量在0.01水平上(双侧)显著相关(P<0.01),其中,蒸煮损失和水分含量呈极显著正相关,硬度和水分含量呈极显著负相关。压榨损失、菌落总数和水分含量在0.05水平上(双侧)显著相关(P<0.05),且均呈显著正相关。蒸煮损失、微球菌数量和食盐含量在0.05水平上(双侧)显著相关(P<0.05),且均呈显著正相关。硬度和蒸煮损失在0.01水平上(双侧)显著相关(P<0.01),且呈极显著负相关。内聚性、微球菌数量和蒸煮损失在0.05水平上(双侧)显著相关(P<0.05),且均呈显著负相关。硬度和压榨损失在0.01水平上(双侧)显著相关(P<0.01),且呈极显著负相关;a*、菌落总数和压榨损失在0.05水平上(双侧)显著相关(P<0.05),其中,a*和压榨损失呈显著负相关,菌落总数和压榨损失呈显著正相关。微球菌数量和L*在0.01水平上(双侧)显著相关(P<0.01),且呈极显著负相关。菌落总数和硬度在0.05水平上(双侧)显著相关(P<0.05),且呈显著负相关。
综上所述,在低补组腊肉加工过程中,随着贮藏时间的增加,腊肉的品质和菌相发生了很大变化,加工工艺可以影响各指标的变化,并且各指标间也有一定的相关性。
3 结 论
在腊肉加工过程中,分别添加不同含量的食盐,以此分为低补组、低盐组和高盐组,比较各组腊肉的理化性质和菌相的不同。结果表明,在加工过程中,3 组腊肉的不同指标变化趋势基本一致,但不同组在个别工艺点仍有区别(P<0.05)。低盐组腊肉相比对照组,品质有所下降,压榨损失和蒸煮损失显著增高(P<0.05),菌落总数显著增大(P<0.05),水分含量和乳酸菌数量并无显著差异(P>0.05)。
低补组成品的食盐含量仅为3.06%,相比高盐组下降50.81%;另外,低补组相比对照组,乳酸菌数量无显著性差异(P>0.05),但水分含量更高,口感更好,a*和L*较高,红色度和光泽度更好,同时微球菌数量更多。由此可见,减少腊肉中的食盐含量会对其品质和菌相造成一定的影响,但是添加替代盐可以在一定程度上改善由于减盐造成的对腊肉品质的影响,而改善程度仍需进一步论证。同时,添加替代盐能有效降低食盐含量,有利于腊肉的现代化生产。

