黄芩素作为佐剂对黑色素瘤小鼠体内T细胞免疫应答的增强作用
刘 玮,刘泽媛,齐好雯,王 斌
恶性黑色素瘤是来源于黑色素细胞的一种高度恶性的肿瘤,发病率为全部恶性肿瘤的1%~3%,黑色素瘤比其他恶性肿瘤发病速度快。与一些更常见的皮肤恶性肿瘤 (如鳞状细胞癌和基底细胞癌等)不同,黑色素瘤具有不断增殖的能力,化学疗法和放射治疗等常规肿瘤治疗方法敏感性很差[1-3]。细胞因子,干扰素和白细胞介素-2显示出了免疫治疗在治疗黑色素瘤中的潜力,然而这些治疗具有高毒性、低反应率,患者平均生存期无改善。以前的研究表明,肿瘤淋巴细胞的浸润可能与改善的结果有关,然而淋巴细胞抗癌活性有明显的障碍,包括肿瘤和其他炎症细胞的淋巴细胞调控[4]。重要的突破是在T细胞淋巴细胞上鉴定和激活靶向调控蛋白“开关”。所以,急需找到一种不良反应小、能增强弱免疫原性肿瘤抗原所诱发的保护性抗瘤效应的新型佐剂,来对T细胞进行激活进而发挥作用,从而达到抑制肿瘤的效果。
在免疫反应中,天然的反应开始于血管壁中单核细胞/巨噬细胞的活化,其次是由T和B细胞介导的更具体的适应性反应[5,6]。 在早期病变中,发现巨噬细胞丰富。由巨噬细胞集落刺激因子和各种其他细胞因子刺激,这些细胞上调其模式识别受体并介导脂蛋白内化[7]。巨噬细胞是炎性细胞因子TNF的来源,其通过在病变部位招募更多的T细胞、B细胞和巨噬细胞[8]。在成熟病变中,由T细胞和B细胞介导的免疫应答可能成为消除癌症的主要力量。
黄芩素(5,6,7-三羟基福酮)是黄芩中主要的生物活性物质,属于黄酮类。黄芩素由于抗癌功能低毒,并具有增殖抑制,细胞凋亡诱导,自噬细胞死亡[9-13]及其抗转移活性[14,15],引起了越来越多的 关注。到目前为止,在许多癌症中已经证明了黄芩素的抗癌作用,在膀胱癌中,黄芩素可以通过抑制CDC2激酶活性来延缓细胞生长[9],降低细胞周期蛋白B1和D1蛋白表达水平;在乳腺癌中,黄芩苷有可能通过抑制基质金属蛋白酶2/9(MMP-2/9)的表达和分泌来抑制癌细胞的黏附,迁移和侵袭[16];在胃癌中,癌细胞通过TGF-β和p38信号通路进行迁移和侵袭,黄芩素可达到抑制TGF-β和p38信号通路的作用[17,18];在胰腺癌细胞中,黄芩素可通过下调抗凋亡蛋白MCL-1诱导凋亡细胞死亡[10];在皮肤癌中,黄芩素可通过抑制锚蛋白Ezrin表达来抑制细胞侵袭[19];在结肠直肠癌中,黄芩素可以通过抑制AKT信号通路降低MMP-2和MMP-9的表达来抑制细胞迁移和侵袭[20]。此外,He等发现黄芩素可以通过Wnt信号靶向c-MYC基因来抑制骨肉瘤细胞增殖并促进细胞凋亡[21],但其作为佐剂应用于黑色素瘤的研究还目前还没有报道。该实验将黄芩素用于黑色素瘤模型中,用于检测其在黑色素瘤中对T细胞的作用研究。
1 材料与方法
1.1 材料
1.1.1 实验动物和细胞株 C57BL/6小鼠,雌性,6~8周龄,购自南京君科生物工程有限公司;B16F10细胞系购自中国科学院上海细胞资源中心。
1.1.2 试剂及仪器 黄芩素标准品(大连美仑生物技术有限公司);弗式完全佐剂(sigma公司);用于流式检测的抗体 PE anti-mouse IL-2,PE antimouse TNF-α,PE anti-mouse IFN-γ 都从 Biolegend公司购买;-86℃超低温冰箱(SANYO,日本);细胞培养箱 (北京五洲东方科技发展有限公司);SWCJ-2FD型双人单面净化工作台 (苏州净化设备有限公司);冰箱 (青岛澳柯玛集团);BD Accuri C6 software流式细胞仪。
1.2 方 法
1.2.1 不同浓度黄芩素的配制及C57BL/6小鼠的分组 使用甲醇溶液溶解黄芩素标准品,溶解后的浓度为1 mg/ml。将C57BL/6小鼠分为8组,分别为A、B、C、D、E、F、G 和 H 组,每组 5 只。
1.2.2 黑色素瘤灭活疫苗的制备 将黑色素瘤细胞B16F10放于含5%CO2的37℃细胞培养箱中培养,待细胞生长到对数生长期后,制备细胞悬液,在紫外交联仪中,于254 nm波长下照射30 min,将细胞浓度调整为1×107备用。按下列配方制备3种佐剂瘤苗,瘤苗A:黄芩素(50 mg/kg)+灭活的B16F10细胞;瘤苗 B:黄芩素(100 mg/kg)+灭活的 B16F10细胞;瘤苗C:弗氏完全佐剂+灭活的B16F10细胞;瘤苗D:制备不加佐剂的灭活的B16F10细胞;E组为50 mg/kg的黄芩素,F组为100 mg/kg的黄芩素,G组为单独的弗氏完全佐剂作为对照,H组不做任何处理。其中C组为阳性对照,将配制后的瘤苗于4℃保存备用。
1.2.3 佐剂瘤苗的注射与黑色素瘤模型的建立将A-H 8种佐剂瘤苗分别通过肌肉注射的方式对小鼠进行免疫一次,14 d后,同样的剂量强化免疫一次,再 7 d 后,通过皮下注射 B16F10(1×106/ml)肿瘤细胞构建肿瘤模型,每只小鼠注射量为100μl。待小鼠肿瘤达到20 mm时处死,提取脾脏中的淋巴细胞。
1.2.4 脾脏中淋巴细胞的提取 (1)小鼠经断颈处死,将小鼠置于75%乙醇溶液中15 min。(2)在超净台中分离小鼠脾脏,收集脾脏细胞。(3)2000 rpm离心2 min后弃去上清液,之后加入700μl裂解物裂解RBC 2 min,加入700μl完全培养基使裂解终止。 (4)以 2000 rpm 离心 2 min后,弃废液。 (5)用PBS液体清洗2次后即得到淋巴细胞。
1.2.5 流式细胞仪检测不同浓度的黄芩素对CD4+T细胞的刺激活性 将每组小鼠的淋巴细胞制成悬液,铺于96孔板中,每孔 2×106/ml,于含有5%CO2的37℃细胞培养箱中培养12 h,弃掉培养基,每孔加100μl 4%多聚甲醛溶液,之后用PBS清洗两次,用0.1%的 tritionX-100将抗体PE anti-mouse IL-2和PE anti-mouse TNF-α稀释并染色,于4℃避光1 h,用BD Accuri C6 software流式细胞仪进行检测。
1.2.6 流式细胞仪检测不同浓度黄芩素对CD8+T细胞的刺激活性 将每组小鼠的淋巴细胞制成悬液,铺于 96 孔板,每孔 2×106/ml,于含有 5%CO2的37℃细胞培养箱中12 h后,弃掉培养基,每孔加100μl 4%多聚甲醛溶液,之后用PBS清洗两次,用0.1%的 tritionX-100将抗体PE anti-mouse IFN-γ和 PE anti-mouse TNF-α 稀释并染色,tritionX-100用于破膜,于4℃避光1 h,用BD Accuri C6 software流式细胞仪进行检测。
1.2.7 细胞毒性实验 将每组小鼠淋巴细胞浓度调节至1×107/ml,在细胞悬液中加入CFSE储存液(终浓度 1μM)1μl,立即混合,室温下暗染 15 min,加入1/2体积的胎牛血清终止反应。 此时,细胞是效应细胞。用生长对数期的小鼠黑色素瘤B16F10细胞制备细胞悬液,并用1μmol/LCFSE标记,立即混匀,置于37℃细胞培养箱中避光染色15 min作为靶细胞,在96孔板中,每孔加入50μl 1×105/ml靶细胞用和50μl效应细胞 (效靶比为1.7∶1至45∶1)。 混匀后在37℃5%CO2下培养6 h后用BD Accuri C6 software流式细胞仪进行检测。
1.2.8 细胞增殖测定 通过CCK-8测定评估T细胞增殖能力,将来自荷瘤小鼠脾脏的冷冻细胞复苏并铺于96孔板,每孔100μl,在含有5%CO2的37℃细胞培养箱中培养4~6 h后,每孔加入103个灭活的B16F10细胞作为实验组,每孔加入10μl PMA+Ionomycin(10 μg/ml)作为阳性对照组,没有处理组(H组)作为阴性对照;在抗原刺激24 h、48 h和72 h后,在96孔板中加入10μl的CCK-8溶液,再置于含有5%CO2的37℃细胞培养箱中培养2 h后,用酶标仪在254 nm波长下检测OD值。
1.2.9 肿瘤生长的评估 在可测量(4~5 mm)肿瘤生长后,用游标卡尺每隔1 d测量肿瘤生长,并记录最大纵向直径和最大横向直径。通过以下公式计算肿瘤大小:面积=π/4(长×宽)。当肿瘤大小达到平均直径约20~25 mm时,处死小鼠并评估每组小鼠的生存率。
1.3 统计学分析 所有的数据都是采用 (x±s)表示。采用t检验法比较各组之间的差异,不同组之间的比较采用two-way ANOVA检验。所有的统计分析都是采用GraphPad Prism 5和BD Accuri C6 Software软件进行分析,ns代表差异无统计学意义(P>0.05);*为差异显著(P<0.05);**为差异非常显著(P<0.01)。
2 结果
2.1 不同浓度的黄芩素对CD4+T细胞的刺激活性抗原特异性T细胞的功能可以通过上调细胞因子表达能力来表示。通过检测CD4+T细胞内的细胞因子IL-2和TNF-α的表达水平来检测CD4+T的活性。与只注射抗原组(D组)相比,A组中IL-2的表达明显升高,而B组和C组,无明显差异;与只注射抗原组(D组)相比,A组和B组中的TNF-α的表达差异显著,但表达水平略低于CFA加抗原组(C组)(如图 1)。
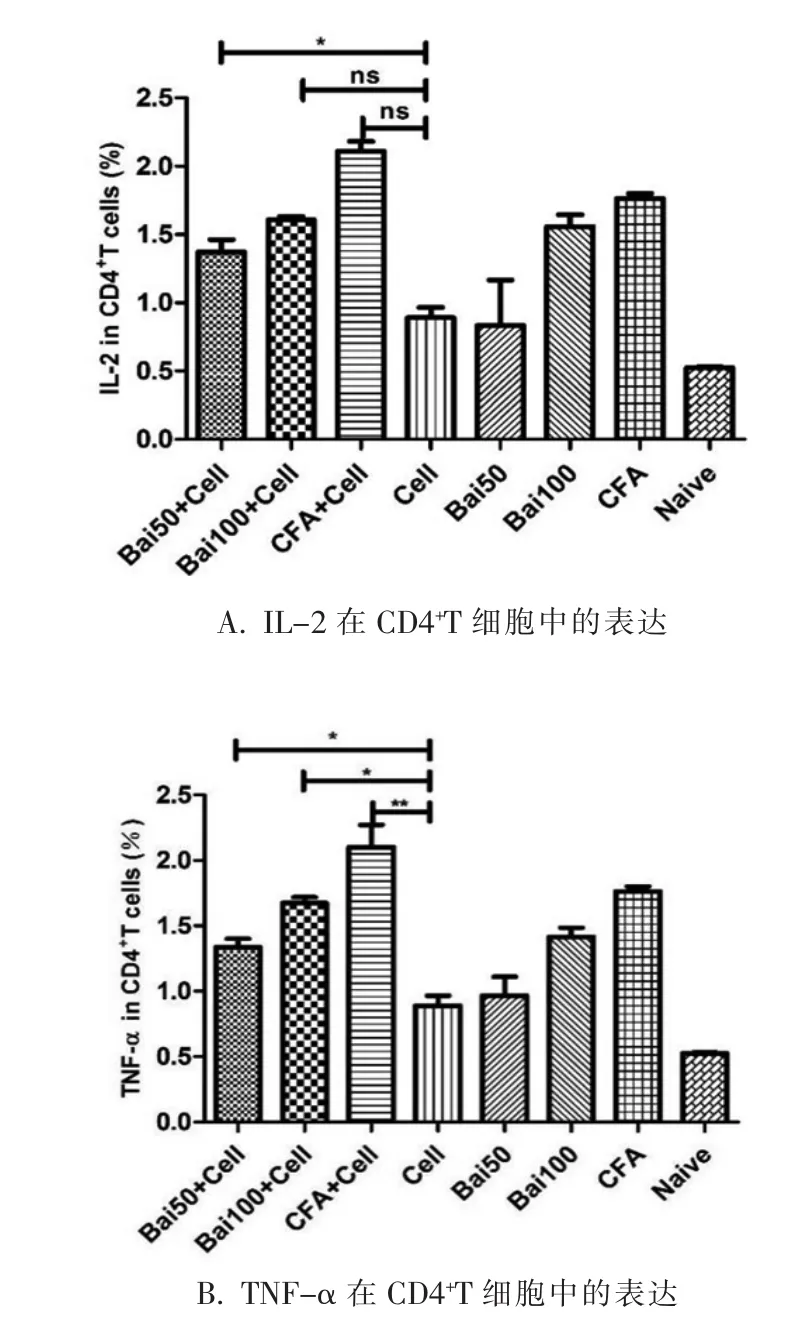
图1 注射瘤苗A、B、C的实验组和D、E、F、G、H对照组的CD4+T细胞的细胞因子的表达情况
2.2 不同浓度的黄芩素对CD8+T细胞的刺激活性通过检测CD8+T细胞的细胞因子IFN-γ和TNF-α的表达情况来检测CD8+T的活性。与只注射抗原组(D组)相比,A组和B组中IFN-γ的表达差异显著,但较C组有所降低;与只注射抗原组(D组)相比,A组中的TNF-α的表达无明显差异,B组和C组中的TNF-α的表达差异显著,综上所述,B组即100 mg/kg的黄芩素+灭活的B16F10细胞组的作用效果较明显(如图2)。

图2 注射瘤苗A、B、C的实验组和D、E、F、G、H的对照组的CD4+T细胞的细胞因子的表达情况
2.3 不同浓度的黄芩素对T细胞的细胞毒性测试和增殖的影响 在细胞毒性试验中,如图3A所示,与只注射抗原组(D组)相比,A组和B组中的CTL显著增加。CCK-8增殖实验结果显示,与只注射抗原组(D组)相比,在72 h后,A组和B组中的细胞毒性T淋巴细胞(CTL)显著增加(图3B)。这些结果表明黄芩素能够提高T细胞的杀伤力并促进T细胞增殖。
2.4 肿瘤生长的评估 在造模成功后,通过公式计算肿瘤的面积,如图4A,与D组相比较,B组的肿瘤较小。同时计算了每组小鼠的死亡率,如图4B,与D组相比较,B组小鼠的生存率较高。

图3 体内细胞毒性测试和细胞增殖测定的结果

图4 造模后,每组小鼠的肿瘤大小和生存率情况
3 讨论
癌症生物学的一个目标是消除癌细胞对免疫系统的逃逸。免疫应答的特异性使得其具有极高的吸引力,几十年的研究已经导致了这一平台的显著改进。首先在体外和体内的一系列研究中证明了T细胞介导抗癌作用的能力[22]。在黑色素瘤的治疗方面,手术切除是目前最直接的方法,但创伤较大,并不能预防其发生。佐剂是用于感染性疾病和癌症疫苗的重要组分,因为它们可以进一步促进免疫应答。目前针对肿瘤的佐剂效果不是很好,大部分都具有不良反应,因此,可以通过开发具有佐剂活性的全新化合物和通过优化佐剂制剂来开发更有效的癌症疫苗佐剂。黄芩素是我国传统中药,在该研究中,将中药与现代技术相结合,检测黄芩素是否具有佐剂的作用。
该研究将不同浓度的黄芩素(50 mg/kg、100 mg/kg)与灭活的黑色素瘤细胞混合作为实验组,以弗式完全佐剂与灭活的肿瘤抗原作为阳性对照对小鼠进行免疫,之后皮下接种黑色素瘤细胞,通过对小鼠肿瘤的大小、小鼠的生存率及小鼠脾脏中T淋巴细胞内的细胞因子检测来确定黄芩素的作用,实验结果显示,100 mg/kg的黄芩素作用效果较好,与阴性对照相比,小鼠的存活率明显升高,并且能够使CD4+T细胞的细胞因子IL-2和TNF-α有不同程度的表达上调,使CD8+T细胞的细胞因子TNF-α和IFN-γ表达量增加。该研究通过黄芩素对T细胞的细胞因子的表达情况来观察其对T细胞的影响功能,为黑色素瘤疫苗佐剂的研究添砖加瓦。

