不同功能菌液人工窖泥的培养研究
张 健,张宿义,2,秦 辉,2,杨 艳,邱川峰,徐 琼,康承霞,罗 杰,李德林,马 蓉,王加彬
(1.泸州老窖股份有限公司,四川泸州646000; 2.国家固态酿造工程技术研究中心,四川泸州646000)
浓香型白酒的生产以泥窖为主要容器和基础,窖泥中栖息着丰富而极其复杂的微生物菌系,其中主要的有益功能菌如己酸菌、丁酸菌、甲烷菌、硫酸盐还原菌和硝酸盐还原菌等[1]。正是这些有益功能菌的大量生长、繁殖、代谢以及相互协调作用,才赋予了浓香型白酒的独特香味,形成了以己酸乙酯为主体香的典型风格[2]。窖泥质量的优劣对浓香型白酒的质量起着至关重要的作用。为了提高窖泥培养质量,各大企业和专家学者对人工培养窖泥工作开展了大量研究,并总结形成了以优质的原始窖泥为基础,通过添加营养物质、老窖泥及各类功能菌,营造良好的环境条件,使有益功能菌迅速生长繁殖成优势菌群,从而培养出能够达到老窖泥特性的人工窖泥[3]。人工窖泥培养过程中,添加的窖泥功能菌液主要有纯种己酸菌培养液或复合功能菌液。本研究采用从100余年老窖泥中富集培养的复合功能菌液、分离纯化的己酸菌液以及将二者按比例混合培养的复合菌液培养人工窖泥,根据窖泥培养过程的升温、理化指标、微生物变化以及窖泥感官评价,对窖泥培养进行综合评价及分析。
1 材料与方法
1.1 材料和仪器
1.1.1 主要材料
黄泥、窖皮泥、老窖泥、麸皮、豆粕、曲粉、磷酸氢二钾、黄水、尾水、窖泥功能菌液、纯种己酸菌液。
1.1.2 主要仪器
LRH.250生化培养箱(上海一恒科技有限公司),VD-850桌上式洁净工作台(苏州净化设备有限公司),DT1002电子天平(常熟市佳衡天平仪器有限公司),BST0001万用电炉(泰州市贝斯特电热电器有限公司),YXQ-LS-100A立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂),UV-1600PC紫外可见分光光度计(上海美谱达仪器有限公司),窖池数显温度计(济南雪纳斯仪表有限公司),Agilent7890B型气相色谱仪(美国安捷伦公司)。
1.2 实验方法
1.2.1 窖泥功能菌液培养
从连续使用100余年窖底四周及中心点分别取样后混合均匀,经富集培养及多次扩培筛选出产己酸能力强、菌体生长旺盛且稳定的窖泥复合功能菌液F1、F3,接种到窖泥时己酸菌数为2.6×108个/mL。分离纯化己酸菌液S2、S4,接种到窖泥时菌数为3×108个/mL。窖泥复合功能菌液与纯种己酸菌液按1∶1的比例混合扩大培养菌液,接种到窖泥时菌数为2.9×108个/mL。
1.2.2 人工窖泥培养方案
(1)窖泥培养原料:黄泥、窖皮泥、老窖泥、麸皮、豆粕、曲粉、磷酸氢二钾、黄水、尾水,按10%比例接入窖泥功能菌液,方案设计见表1。
(2)将地面清洗干净,把黄泥均匀铺在地面上(厚度20~30 cm),泼上一定量的黄水和尾水,然后按比例依次将麸皮、豆粕、曲粉、窖皮泥、老窖泥层层均匀铺在黄泥上面,再根据需要泼上一定量的黄水和尾水,最后均匀洒上磷酸氢二钾。
(3)使用耙梳和铁铲将原料和黄泥拌和均匀,窖泥功能菌液采用泼洒的方式,边泼洒菌液边用搅拌机拌和窖泥,并根据感官判断添加尾水。
(4)待所有原辅料拌和均匀后且窖泥柔熟后,将窖泥收堆成长条状(2 m×2 m×0.75 m),用铁铲拍光,盖上窖皮,四周用黄泥压封,采用丢糟覆盖保温使其在30~40℃的环境下密封发酵90 d以上。
1.2.3 数据采集方法
每天定时定点检测温度,每15 d取样测定理化指标及微生物数量,窖泥培养结束,经专家鉴定其质量后应用于生产。
1.3 检测方法
己酸菌计数方法:血球计数板法。
温度测定:窖池数显温度计。
水分、pH值、氨态氮、有效磷测定:参照《白酒生产技术全书》窖泥分析[4]。
有效钾测定:参照《土壤农化分析》土壤中钾的测定[5]。
腐殖质测定:参照《森林土壤腐殖质组成的测定》[6]。
窖泥微生物计数方法:稀释平板法。
2 结果与分析
2.1 窖泥培养过程升温情况
窖泥培养过程升温情况见图1。
从图1可以看出,各方案中人工窖泥在培养过程中温度变化呈现先上升,中间维持较高温度,后期缓慢下降的规律。培养前期,窖泥中营养物质充足,加之残存的氧气,微生物快速生长繁殖产生大量的热量,导致窖泥温度逐渐升高,在25 d左右达到顶温,升温幅度在10~16℃之间,在顶温附近维持15 d左右,而后由于营养物质的消耗和代谢产物的积累,微生物的生长及代谢活动逐渐变缓,窖泥温度开始缓慢下降。

表1 方案设计
对比各方案可以看出,方案5和方案6中混合培养菌液培养的窖泥升温幅度和顶温均高于其他方案,复合功能菌液与纯种己酸菌液培养的窖泥升温情况相近。
2.2 窖泥培养过程理化指标变化情况
2.2.1 窖泥培养过程水分含量变化
水是细胞的重要组成部分,菌体所需营养物必须呈水溶液状态才能被吸收,各种微生物的生化活动与窖泥含水量也有密切关系,水分过少时,微生物生长、繁殖困难;水分过大时,窖泥过稀,搭窖困难,使用不便,人工窖泥必须湿润柔熟。所以,窖泥含水一般控制在35%~45%。窖泥培养过程水分含量变化见图2。
由图2可知,6个方案中,各方案起始水分含量均不超过37%,培养过程中窖泥水分含量均呈现逐渐增加的趋势。在窖泥培养前45 d,窖泥水分含量明显增加,这是由于培养前期,营养物质丰富,微生物利用添加的有机质等进行生长繁殖代谢,将有机质分解成CO2、H2O、H2S、NH3等小分子物质;后期由于营养物质的消耗及温度过高或过低等原因,微生物生长及代谢活动减缓,水分缓慢增加。对比各方案得出,窖泥培养过程水分随着培养时间的延长而升高,增幅相差不大,培养90 d后水分含量均在40%左右。
2.2.2 窖泥培养过程pH值变化
pH值一方面影响微生物代谢过程中一些酶的活性,超出一定的范围都会使微生物的生长受到限制;另一方面会引起微生物细胞膜内外电荷的变化,从而影响微生物对营养物质的吸收[7]。己酸菌最适生长初始pH值为7.0,在中性或中性偏酸的条件下菌体增殖较好。窖泥培养过程pH值变化见图3。
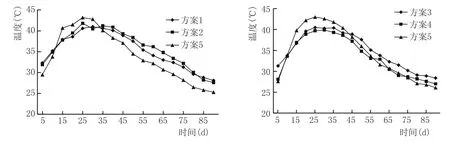
图1 窖泥培养过程温度变化情况
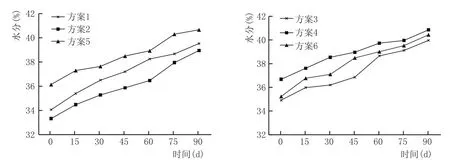
图2 窖泥培养过程水分含量变化情况
由图3可知,各方案在窖泥培养前45 d,pH值呈下降趋势,后期pH值略有上升,后下降。主要由于前期营养丰富,微生物进行各种生化反应产生多种有机酸。从整个培养过程看,pH值降低,但下降幅度不大,培养终点pH值均在5.1左右。各方案之间表现出,两种混合培养菌液培养的窖泥pH值降低较多,纯种己酸菌液培养的窖泥pH值降低最少,可能是混合培养,微生物间协同作用增强,提高了功能菌的产酸能力,从而使pH值下降更多。
2.2.3 窖泥培养过程氨态氮含量变化
氨态氮是窖泥功能菌生长、繁殖所需的主要氮源,除曲药中本身含有一定量的氨态氮外,氨态氮是微生物分解有机质而形成的。在使用的窖泥配方中,微生物主要可以分解豆粕、麸皮、曲药中的有机质而形成氨态氮。窖泥培养过程氨态氮含量变化见图4。
如图4所示,各方案窖泥中氨态氮含量总体表现为逐渐增加的趋势,培养结束后氨态氮含量在140 mg/100 g干土左右,较刘淼等[8]的研究,氨态氮含量偏低。主要是由于本文窖泥配方中所添加的氮源,均是有机氮源,除菌种培养基中添加少量硫酸铵以外,未单独添加无机氮源。适宜的菌种添加量能保证有机质的分解进而作为氮源,减少无机氮源的添加,能有效防止窖泥板结等现象,同时避免氨态氮积累过多,导致窖泥出现泥臭。
上周(8月13日-8月17日),市场供货略偏紧,氯化钾报价高位坚挺。8月20日中国氯化钾批发价格指数(CKPI)为 2155.14点,环比上涨15.33点,涨幅为0.72%;同比上涨283.97点,涨幅为15.18%;比基期下跌1135.45点,跌幅为34.51%。

图3 窖泥培养过程pH值变化情况
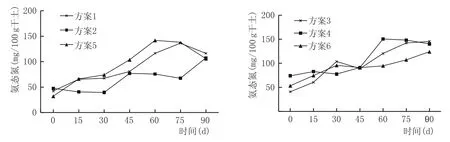
图4 窖泥培养过程氨态氮含量变化情况
2.2.4 窖泥培养过程有效磷含量变化
有效磷是细胞核组成成分,也是微生物生长、繁殖的必需物质,因此,磷是窖泥功能菌增殖的必需物质。同时,磷又是参与乙醇、乙酸化合成己酸这一发酵过程的重要物质[9]。窖泥培养过程有效磷含量变化见图5。
如图5所示,各方案中有效磷均呈现出逐渐减少的趋势,且在前15 d下降较多,后期有效磷含量上下波动、变化较小。在人工培泥过程中,不宜加过磷酸钙和重过磷酸钙,由于它们含有游离的酸性强的H3PO4、H2SO4,且Ca2+易与乳酸形成沉淀,造成窖泥板结退化,本实验方案添加磷酸氢二钾作为磷和钾的补充。磷、钾一般在窖内发酵中,从酒醅中得到补充,使含量越积越多,因此培养窖泥时满足微生物生长即可,不必过量添加,否则会因无机盐浓度过高而造成窖泥的板结,从而严重影响窖泥微生物的活动,致使窖泥退化。
2.2.5 窖泥培养过程有效钾含量变化
窖泥培养过程有效钾含量变化见图6。
土壤中有效钾主要为水溶性钾和代换性钾,它是酵母、霉菌、细菌等微生物所需的无机盐类。虽然微生物对无机盐需求量较少,但缺少钾是不行的。如图6所示,各方案中有效钾含量在发酵过程中上下波动,总量基本维持不变。
2.2.6 窖泥培养过程腐殖质含量变化
窖泥中的腐殖质部分是在微生物酶的作用下形成的小分子化合物和微生物代谢产物的合成物,部分是由其他有机物腐殖化的过程形成[9]。它是窖泥水分和养料的贮存器,可以为窖泥微生物提供充足的水分和养分,具有保持窖泥营养,调节窖泥酸度,缓解乳酸钙、乳酸铁的生成,避免窖泥的板结退化等重要作用。使用时要防止因腐殖质过量而带来的恶臭。窖泥培养过程腐殖质含量变化见图7。如图7所示,各方案中腐殖质均呈现出逐渐下降的趋势,表明被窖泥微生物利用,但总体下降幅度不大;两种混合培养菌液培养的窖泥腐殖质含量下降最少。
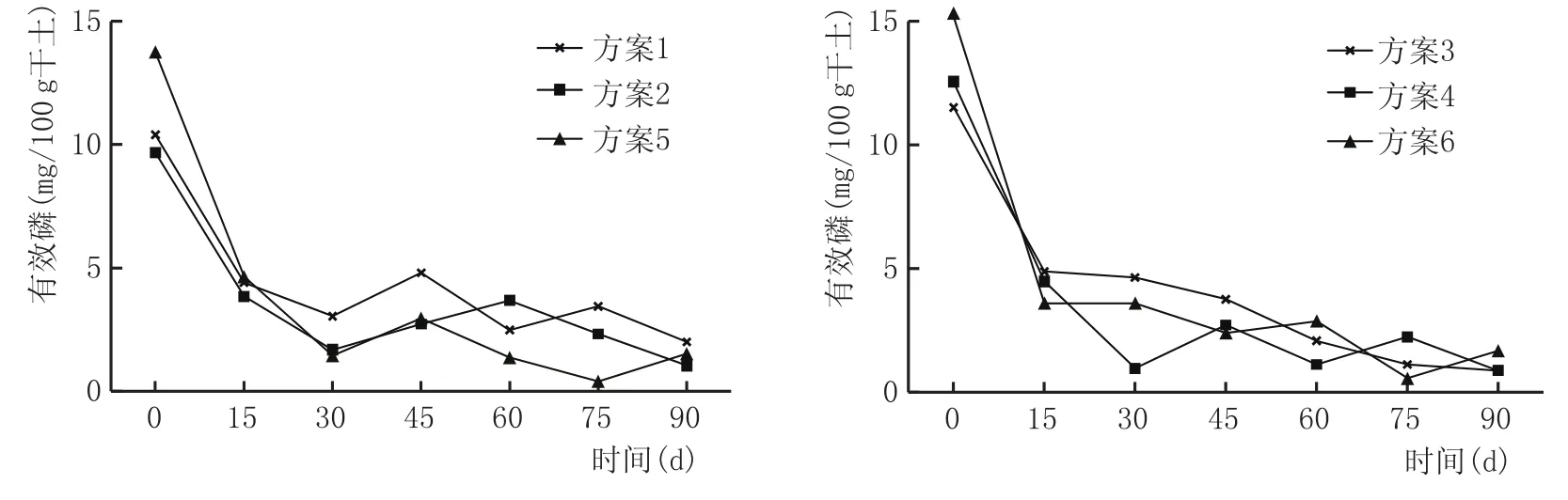
图5 窖泥培养过程有效磷含量变化情况
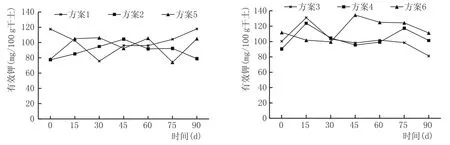
图6 窖泥培养过程有效钾含量变化情况
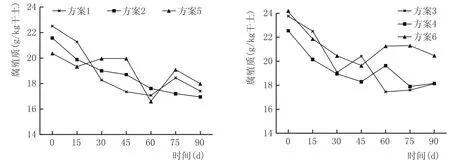
图7 窖泥培养过程腐殖质含量变化情况
2.3 窖泥培养过程微生物数量变化情况
2.3.1 窖泥中细菌总数变化
窖泥中细菌总数变化见图8。
由图8可知,窖泥培养前15 d,由于窖泥中添加的营养物质丰富,存在部分氧气,且环境条件优越,方案1、方案3、方案5、方案6窖泥中细菌数量均有明显增加;15~50 d,氧气逐渐被消耗,窖泥温度较高,细菌数量缓慢增加。后期由于营养物质大量被消耗,所以部分细菌开始死亡,有些细菌形成芽孢杆菌以适应环境变化,最终细菌数量达到平衡状态。而方案2、方案4窖泥中细菌数量整体变化幅度不大,主要原因是两种方案窖泥培养添加的菌液为经过分离纯化的纯种己酸菌液,虽然配方中添加老窖泥及窖皮泥中有其余窖泥功能菌存在,但数量较少。而其余方案中,所添加的复合窖泥功能菌液及混合培养菌液均较大程度地保留了窖泥中窖泥功能菌的多样性,且部分菌种之间存在互利共生的关系,使其对环境有更强的适应能力。
2.3.2 窖泥中芽孢杆菌变化
在窖泥中,芽孢杆菌是浓香型白酒生产的主要酿酒功能微生物。芽孢杆菌对己酸的产生起到非常重要的作用,正是它们使浓香型白酒具有其独特的风格和香味。窖泥中芽孢杆菌变化见图9。
由图9可以看出,6个方案中,窖泥培养发酵过程芽孢杆菌数量总体变化均呈先增加后减少的趋势;在发酵进行到30 d时,方案1、方案3窖泥中芽孢杆菌数量超过其他几种方案,达到最大值,随后呈现逐渐减少的趋势;而方案2、方案4、方案5、方案6窖泥均在发酵45 d时,芽孢杆菌数量达到最大值。此后,方案5、方案6窖泥中芽孢杆菌数量高于其他几种方案。方案1、方案3芽孢杆菌数量峰值高于其他方案且达到峰值的时间更短。分析原因可能是,通过富集培养的复合功能菌液菌群更丰富,在菌群的协同作用下环境适应能力更强。
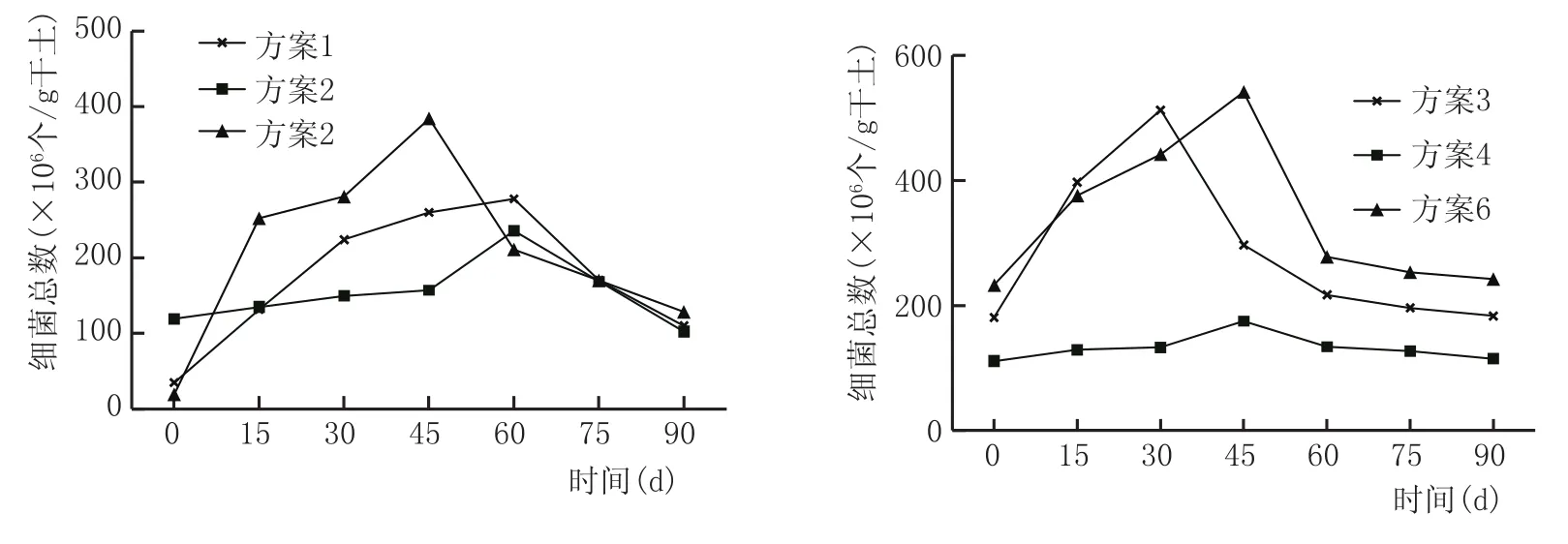
图8 窖泥培养过程细菌总数变化情况
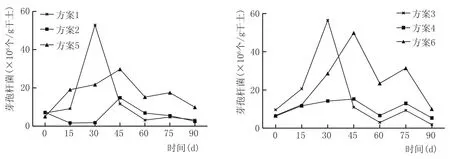
图9 窖泥培养过程芽孢杆菌变化情况
2.3.3 窖泥中酵母菌数变化
窖泥中酵母菌数变化见图10。
由图10可看出,各方案在发酵前15 d,酵母菌数量均有所下降,在后期培养过程基本呈现出增加、减少交替出现的趋势。总体来看,方案2、方案4窖泥中酵母菌数总体变化不大,其他方案窖泥中酵母菌数变化明显,培养结束后,酵母菌数量明显增加。
2.3.4 窖泥中霉菌总数变化
窖泥中霉菌总数变化见图11。
由图11可看出,方案2、方案4窖泥中霉菌数总体变化不大,其余4种方案窖泥在发酵前15 d,霉菌数量大幅下降,这同任道群等[10]研究的霉菌前期变化规律一致,培养75 d后有所增加。
在窖泥培养过程中,微生物总体呈现态势为细菌总数>芽孢杆菌>霉菌>酵母。通过对比可以大致得出,以富集培养的复合功能菌液和混合培养的菌液接种培养的窖泥中,细菌、芽孢杆菌、霉菌和酵母数量都高于纯种己酸菌液,且混合培养的各种微生物数量又高于富集培养的复合菌液,主要是因为:富集培养液和混合培养菌液生物多样性高,菌群更丰富,各种微生物间相互促进、互利共生;同时,纯菌种繁殖代谢能力强,菌株强壮,畸形率低,能较稳定的保持生长优势。
2.4 窖泥感官评价
由于各厂家窖泥培养过程中添加的窖泥功能菌液比例、各种配料的种类及比例不同,导致各理化及微生物指标差异较大,亦没有相关标准对窖泥质量等级进行划分,因此窖泥质量以感官鉴定为主。在窖泥90 d发酵结束后,对不同窖泥进行感官评价,结果见表2。
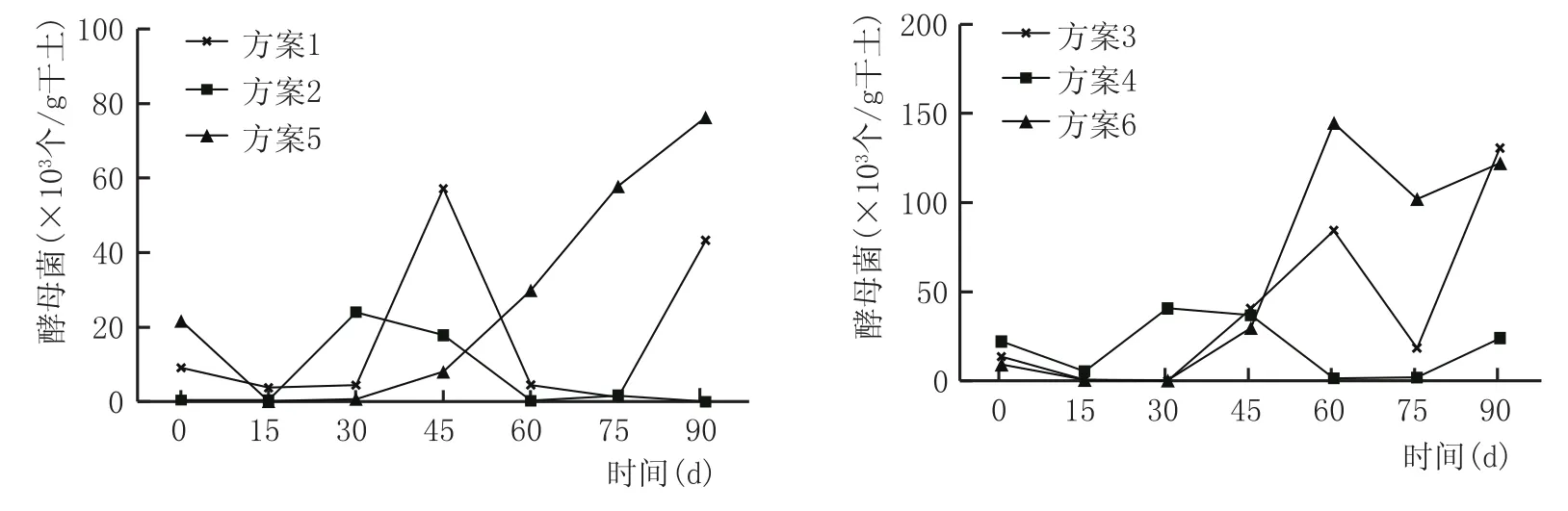
图10 窖泥培养过程酵母菌变化情况
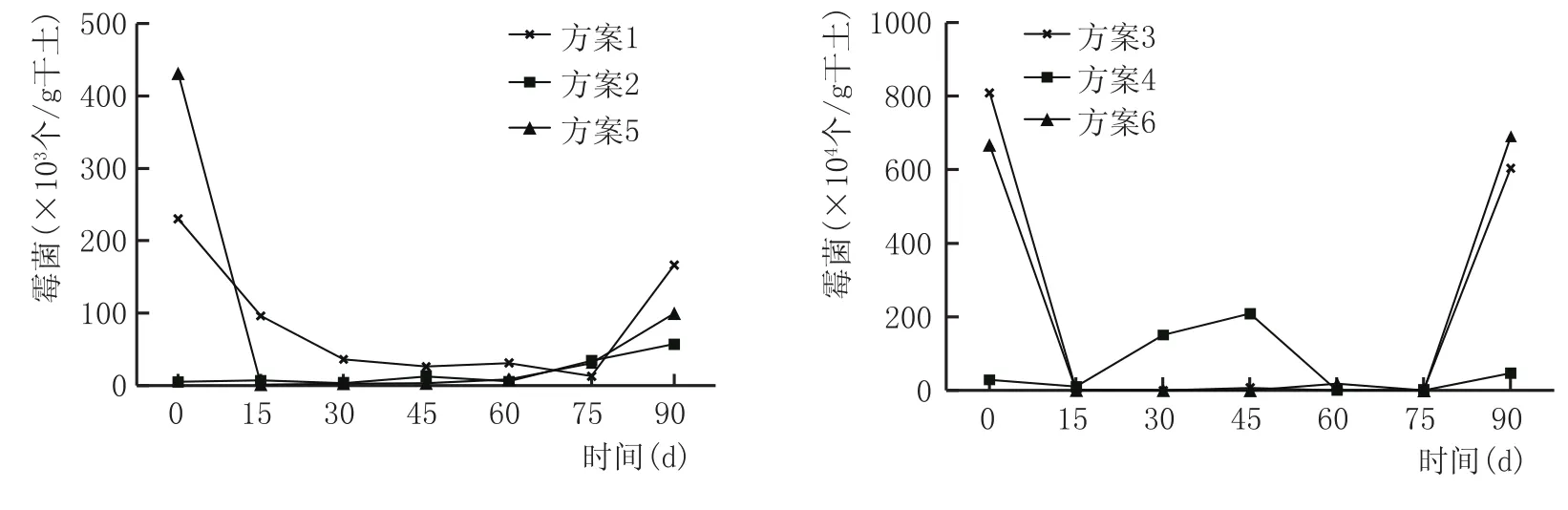
图11 窖泥培养过程霉菌总数变化情况

表2 不同方案人工窖泥的感官鉴定
从各方案窖泥感官鉴定看来,方案2、方案4窖泥气味比较单一、缺少窖香味,而各方案窖泥老熟程度差异不大。
3 总结
添加不同窖泥功能菌液培养人工窖泥,其发酵正常,升温幅度及维持顶温的时间相差不大;各方案理化指标变化规律趋于一致,数量上有一定差异:均表现出窖泥水分、氨态氮含量随着发酵的进行逐渐增加,窖泥pH值、有效磷、腐殖质随着发酵的进行逐渐减少,窖泥中有效钾含量变化不大。各方案微生物数量呈现出细菌总数、芽孢杆菌先增加后减少;酵母菌及霉菌由于其数量较少,规律性不强。对比各方案微生物可以得出,添加复合功能菌液和混合培养菌液的4种窖泥培养方案,在各微生物数量上优于添加纯种己酸菌液;且此4种方案的感官评价结果亦较优。后期,将6种方案培养的窖泥应用于同一班组不同窖池,在相同工艺参数的情况下,跟踪几排产酒情况,综合评价窖泥质量。

