利用RIBA实验确定VITROS抗-HCV检测试剂CUT-OFF值的分析*
吉远珍,韩俊岭
(江苏省泰州市人民医院医学检验中心 225300)
在丙型肝炎病毒的检测中,通常对VITROS全自动免疫分析仪对发光样品吸光度比临界值(S/CO)≥8.0的标本做核酸试验(NAT)以确诊[1-2]。有研究表明VITROS发光S/CO≥8.0时,NAT的阳性率为96.1%[3]。有研究显示,50%的患者丙型肝炎病毒抗体(抗-HCV)S/CO值<4.5时证明为阴性,足以排除HCV感染[4-5]。为了促进补充测试发展,故有学者提出当VITROS抗-HCV试剂测得S/CO值<8时,需要进一步测试样品以排除假阳性,推荐用第3代重组蛋白免疫印迹分析(RIBA)实验作为确证实验[6]。因此,本研究运用该方法重新确定本实验室VITROS抗-HCV检测试剂有效的截断值(CUT-OFF值),用于区分真阳性和假阳性结果。在日常检测发现,S/CO<8.0,尤其是极低水平抗-HCV(S/CO<3.0)所占的比例高达80.3%,因此本研究拟用RIBA实验来确认S/CO<8.0的样本作确证实验,找出抗-HCV的S/CO与RIBA结果的相关关系,确定合适的CUT-OFF值,从而减少假阳性报告,降低由此产生的各种不良后果,避免医患纠纷及给患者带来的不良心理压力及不必要的检查。
1 资料与方法
1.1一般资料 选择2016年7月至2017年11月本实验室检出217例抗-HCV阳性标本,并收集S/CO<8.0标本101例,-70 ℃保存待用。
1.2方法
1.2.1化学发光免疫测定(CLIA) 使用全自动免疫分析仪(Ortho VITROS 5600 Immunodiagnostic System)对抗-HCV进行检测,产品标准标号:YZB/ENG 1979-2010,操作严格按照仪器说明书进行。
1.2.2RIBA RIBA补充确认实验使用MP生物医学亚太私人有限公司试剂盒;产品标准编号:YZB/SIN 5848-2011;产品型号:11139-036。严格按照试剂说明书的要求进行操作。
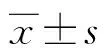
2 结 果
2.1丙型肝炎病毒阳性标本S/CO分布情况 217例血清阳性样本中,S/CO<8.0共101例,占46.5%;S/CO<3.0的极低阳性标本共69例,占31.8%。S/CO值为1~<2共42例,为2~<3共27例,为3~<4的共14例,为4~<5共6例,为5~<6共9例,为6~<7共2例,为7~<8共1例,>8共116例。
2.2样本研究特征 选择S/CO<8.0的101例标本,对其中的61例进行了第3代RIBA确认实验,其中31例(51.7%)为阴性,9例(14.8%)不确定,21例(34.5%)为阳性。RIBA确认阳性、不确定及阴性样本的S/CO的水平分别为阳性组4.41±2.72,阴性组1.67±0.41,不确定组2.64±0.38。RIBA阳性和不确定组样本的S/CO值与阴性组比较,差异有统计学意义(P<0.05)。S/CO值分布与RIBA确证结果的关系见表1。

表1 S/CO值与RIBA确证结果的关系(n)
2.3条带分布情况 确认结果为阳性及不确定标本的条带分布具体见表2,阳性组检出条带最多的是核心抗原,其次为NS3-1和NS3-2,不确定组样本检出条带多集中分布于NS3-1和NS3-2。
2.4ROC曲线分析 以RIBA阴性组的S/CO值与阳性及不确定组进行ROC曲线分析,计算CUT-OFF值。当截断值为2.1时,ROC曲线下面积(AUC)=0.94,特异度为92.4%,灵敏度为85.2%。

表2 RIBA确证结果为阳性及不确定标本的条带分布(n)
3 讨 论
VITROS抗-HCV化学发光法是第3代增强化学发光分析方法,比酶联免疫吸附试验(ELISA)法更灵敏更特异,它可以检测到非常低的抗体水平,但对丙型肝炎感染低发人群如献血员、普通人群等,仍存在较高频率的假阳性结果(15%~62%)[7-9]。
HCV RNA检测是诊断活动性HCV感染的金标准,但它除了成本高,需要专业技术人员和仪器等缺点外,若仅以NAT结果作为抗体筛查的确认实验,会存在较多的漏诊及错误的诊断[10]。由于HCV RNA在急性感染期载量较高,而随着抗-HCV效价上升,HCV RNA载量会有所下降,导致HCV RNA难以检测[4]。慢性HCV感染时,HCV RNA的复制是断断续续的,单次HCV RNA阴性不能排除活动性HCV感染。因此,对HCV RNA阴性的初筛抗体阳性的样本,还需更特异的RIBA实验做进一步的确认。但由于RIBA试剂盒价格昂贵,操作繁琐等因素,绝大多数临床实验室无法开展该实验[1,11]。虽然已有文献报道,在献血员中VITROS化学发光法S/CO<4.5即为阴性,不需要进行确认实验确认,仅需对S/CO 4.5~8.0的样本进行确认实验,但献血员这一人群与临床医院的检测人群存在较大差异[4,11-12]。因此,还需对检测人群中抗-HCV S/CO值与RIBA结果的相关性进行分析,找出可以排除抗-HCV假阳性的最适S/CO临界点,建立实验室自身的CUT-OFF值。
本研究用RIBA实验对61例S/CO<8.0的标本进行了确认实验。共检出阴性31例,阳性21例,不确定9例。RIBA阳性组和不确定组的S/CO与RIBA阴性组间比较,差异有统计学意义(P<0.05)。结果显示,抗-HCV S/CO值越高,RIBA确认阳性率越高,与文献报道一致[13-15]。经ROC曲线分析,计算出合适的CUT-OFF值为2.10。当以S/CO=2.10为临界值时,S/CO<2.1的28例样本假阳性26例,假阳性率达到92.85%。2例真阳性患者,均无输血史,未检出病毒血症。因此,本研究认为S/CO值为2.10是一个合适的临界值,它可以将阳性预测值从49.18%提高到84.84%,排除了83.87%(26/31)的假阳性。
目前,对抗体假阳性的原因尚不清楚,可能与其他病毒抗体存在交叉反应,或与自身抗体、疫苗接种等有关。此外,本研究显示S/CO>3.3的12例标本,RIBA检测结果均为阳性,因例数较少,还需要更大样本量来证实。RIBA不确定的样本S/CO集中在2.1~3.3。从阳性条带分布来看,RIBA阳性组阳性条带主要为核抗原,其次为NS3-1和NS3-2。不确定组阳性条带主要为NS3-1和NS3-2,与文献[16-18]报道一致。虽然在所有217例抗-HCV S/CO≥1.0结果中都建议进行HCV RNA检测,但仅有49例检测了HCV RNA,其中HCV RNA阳性多数出现在S/CO>20的样本中,仅1例HCV RNA阳性样本,S/CO为2.58,RIBA结果为确认阳性。
总之,抗-HCV筛查实验存在一定的假阳性结果,可能导致医患纠纷,给患者带来不良的心理压力和许多不必要的检查。本研究结果显示筛查测试的S/CO值与真阳性率显著相关,不同检测单位由于检测人群不同,所用检测系统不同,其CUT-OFF值亦不同。尽管试剂厂商推荐有CUT-OFF值,但还需各实验室结合自身情况建立自己的最适CUT-OFF值。本研究用RIBA实验初步确定了本实验室的抗-HCV最适CUT-OFF值为S/CO=2.10,但还需更大的样本来对这一结果进行证实。
综上所述,VITROS抗-HCV的S/CO值与RIBA结果间呈正相关,S/CO值越高,RIBA确认阳性的比例越高;当CUT-OFF值为2.10时,可以排除大多数的假阳性结果,是一个合适的临界值。由于RIBA实验结果为人工肉眼判读,可能存在一些误差,而且检测的样本量较少,因此,上述的结果还需更大样本进一步证实。

