南京六合地区女性HPV感染状况分析
陈小伟,胡利萍,阮福明
(江苏省南京市六合区人民医院检验科 211500)
人乳头瘤病毒(HPV)是一种主要存在人体皮肤、黏膜及女性宫颈上皮细胞异性区的微小共价双链环状DNA病毒,至今发现的HPV约有200多种,与生殖道黏膜感染相关的至少有30种[1]。研究表明,HPV尤其是高危型HPV感染是宫颈癌的主要危险因素,90%以上宫颈癌伴有高危型HPV感染[2]。为了解本地区女性HPV感染及其亚型分布情况,笔者收集近两年在本院进行宫颈分泌物HPV检测的结果并进行统计,现将结果报道如下。
1 资料与方法
1.1一般资料 选择2016年2月至2018年2月在本院妇科就诊的女性共5 737例(已剔除复查标本数据)为研究对象。年龄17~84岁,排除3 d内有阴道操作或性生活史者。根据其年龄不同分为4组:≤30岁组791例,>30~40岁组1 488例,>40~50岁组2 181例,>50岁组1 277例。
1.2仪器与试剂 QuantStudio Dx实时荧光定量PCR仪(美国ABI公司);HPV核酸分型检测试剂(硕世生物科技有限公司),可以定性检测女性宫颈脱落细胞样本中21种HPV亚型,包括18种高危亚型(HPV-16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、26、73、82)和3种低危亚型(HPV-6、11、81)。
1.3方法
1.3.1标本采集 采集前用棉拭子轻轻擦拭宫颈口多余的分泌物,将宫颈采样刷伸入宫颈口鳞状上皮交界处,顺时针或逆时针旋转3~5圈,采集宫颈脱落细胞,将其放入标有患者编号的取样管中,密闭送检。标本采集后及时送检,2~8 ℃保存,3 d内完成检测。
1.3.2标本检测 检测的操作步骤严格按照说明书进行,包括试剂准备、样本处理、PCR扩增检测和结果分析。
1.4统计学处理 采用SSPS18.0统计软件进行分析。计数资料采用百分数表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1HPV感染情况 5 737例标本中,共检出HPV阳性标本1 105例,HPV感染率为19.26%。其中,>40~50岁年龄组女性HPV感染率为17.70%,>50岁年龄组感染率为21.53%,两组比较,差异有统计学意义(χ2=7.668,P<0.05)。其他年龄组感染率比较,差异无统计学意义(P>0.05)。见表1。
2.2HPV单一感染和多重感染构成分布 1 105例HPV感染病例中,HPV单一感染的有802例(72.58%),排在前5位的单一感染亚型分别为HPV-52、16、53、58和81型,其比例分别为14.34%(115/802)、11.97%(96/802)、9.73%(78/802)、9.48%(76/802)和6.48%(52/802)。HPV多重感染的病例有303例(27.42%),其中以两种亚型HPV感染为主,占219例,多重感染中最多有6种亚型同时感染,共检出2例。见表2。
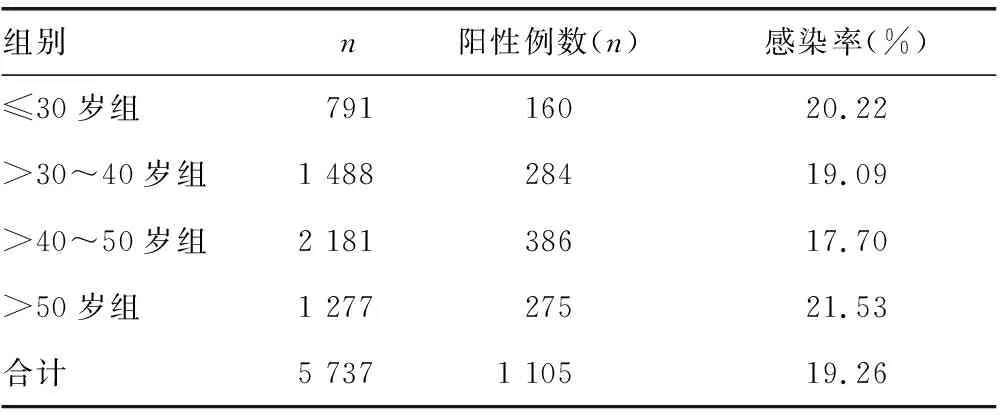
表1 不同年龄组女性HPV感染情况
2.3HPV亚型感染分布 1 105例HPV感染女性中共检测出HPV亚型阳性数1 537例(多重感染重复计数),高危亚型数为1 372例(89.26%),低危亚型数为165例(10.74%)。HPV感染较多的亚型分别为HPV-52(3.68%)、HPV-16(2.96%)、HPV-53(2.75%)、HPV-58(2.63%)和HPV-81型(1.83%)。见表3。

表2 HPV单一感染和多重感染构成分布

表3 HPV亚型感染在不同年龄组的分布情况[n(%)]

续表3 HPV亚型感染在不同年龄组的分布情况[n(%)]
3 讨 论
宫颈癌是女性中较为恶性肿瘤,其发病率仅次于乳腺癌,也是目前唯一一个病因明确的恶性肿瘤[3]。全球每年约有53万宫颈癌新发病例,死亡27万[4];2015年我国新增宫颈癌病例约9.9万,死亡3.1万[5]。大量流行病学资料证实,HPV是引起宫颈癌及癌前病变的主要原因。HPV检测能有效判断子宫颈癌发病的风险[6]。本研究通过实时荧光定量PCR技术对本地区5 737例女性宫颈分泌物标本进行HPV基因型检测,1 105例标本HPV检测阳性,感染率为19.26%(1 105/5 737),比刘永林等[6]报道浙江地区的感染率(16.54%)高,但要比崔燕红等[7]报道江苏常熟地区的44.9%低。各个地区报道HPV感染率各有不同,这可能是由于检测方法不同、研究对象和地区差异造成的。
本研究中,≤30岁组HPV感染率为20.22%(160/791),>30~40岁组和>40~50岁组感染率分别下降至19.09%(284/1 488)和17.70%(386/2 181),而>50岁组HPV感染率上升为21.53%(275/1 277),HPV感染率随年龄增长而近似呈“U”型变化,这与国内外相关报道类似[8-9]。众多研究表明,HPV感染的第1个高峰多发生在性生活初期,而第2个高峰年龄段多在围绝经期。这可能和女性性行为活跃程度、免疫系统反应、绝经后激素水平的改变对生殖道上皮的影响有关;以及随着免疫功能的衰退,导致潜伏病毒的再活化,同时,绝经后激素水平的变化可能增加了对HPV的易感性[10]。统计发现,HPV单一亚型感染是主要方式,占总感染类型的72.58%(802/1 105),其感染较多的前5种亚型分别是HPV-52、HPV-16、HPV-53、HPV-58(高危型)和HPV-81(低危型),其所占比例分别为:14.34%(115/802)、11.97%(96/802)、9.73%(78/802)、9.48%(76/802)和6.48%(52/802)。多重感染占27.42%(303/1 105),其中以双重感染为主要模式,在多重感染中以合并HPV-52基因型的混合感染最为多见。持续性的高危HPV感染可能会引发宫颈癌前病变和浸润性宫颈癌,多重感染对宫颈病变的影响目前学术界尚无统一认识,需要进一步的研究[11]。
通常根据HPV感染的致病性大小或致癌危险性,将HPV分为高危型和低危型。高危型主要导致CINⅡ~Ⅲ级病变和宫颈癌的发生,持续高危HPV感染的CINⅠ级容易进展成CINⅡ~Ⅲ级。低危型主要引起生殖道、肛周尖锐湿疣和子宫颈上皮内瘤样变(CINⅠ级)等疾病,通常其表现为一过性。国际癌症研究协会对25个国家3 607例宫颈癌患者的HPV感染情况分析,发现HPV-16感染率高达57.4%,其次为HPV-18,感染率为12.6%~25.7%[12]。乌恩奇等[13]研究表明,我国整体上以HPV-16和HPV-18感染最多,中国南方地区以HPV-52、58感染最多。报道显示,HPV基因亚型的分布存在明显的地区差异[14],广东东莞地区最常见的高危HPV亚型为HPV-52、16、58、39和51型[15],浙江丽水地区高危型HPV感染最常见的基因型是HPV-58、16和52型[16],而由表3可知,南京六合地区HPV感染的高危亚型主要为HPV-52、16、53和58型。尽管各地区HPV基因分型各有差异,但其高危致病性强的亚型一直得到大家的重视。
美国四价HPV疫苗项目启动4年后的对比研究表明,2007-2010年,14~19岁女性中HPV-6、11、16、18型的感染率下降了56%[17],这表明HPV疫苗对预防HPV感染有较强的作用。但对已经感染了相应HPV的人群不再有保护作用,所以必须在高危HPV感染之前进行接种,9岁及以上人群可以接种,越早越好[18]。目前国外二价(HPV-16、18)和四价(HPV-16、18、6、11)的HPV疫苗已被批准在国内上市了,而九价(HPV-6、11、16、18、31、33、45、52、58)疫苗近期也将有条件批准上市。但本地区HPV感染最多基因型是HPV-52、16、53、58、81型,而现有的疫苗主要针对欧美国家人群,九价HPV疫苗也没有完全涵盖本地区感染最多的基因型,这可能需要国家研制针对国内人群的HPV疫苗,才能真正起到有效的保护作用。
综上所述,HPV感染对人们的健康带来严重的威胁,所以要重视对HPV的筛查及预防,减少相关疾病的发生,必要时再结合液基薄层细胞学和阴道镜检查,对宫颈癌或癌前病变能尽量做到早发现、早治疗,提高生活质量。

