伪狂犬病毒5基因缺失株体外重组获得缺失基因的研究
陈晓春,韩 爽,吴华伟,邓 永,曹明慧,李俊平∗
(1.中国兽医药品监察所,北京100081;2.青岛信得药业有限公司,山东青岛266100)
伪狂犬病毒(Psedorabies virus,PRV)属于疱疹病毒科(Herpesviridae)α疱疹病毒亚科(Alphaherpesvirinae)水痘病毒属(Varicellovirus)的猪疱疹病毒I(Suid herpesvirus I),为线状双股DNA病毒,基因组全长约150 kb,含有至少77个开放阅读框编码。病毒基因组有大量的复制非必需基因,如TK、gG、gE、gI等[1-3]。 这些基因编码的蛋白大多与毒力有关,由单个或多个毒力基因缺失的伪狂犬病毒毒株制备的疫苗在应用上相对成熟[4]。如商品化伪狂犬病毒活疫苗(SA215株)为gE、gI、TK三基因缺失疫苗,猪伪狂犬病活疫苗(HB-98株)为TK和gG双基因缺失疫苗,猪伪狂犬病活疫苗(Bartha-K61株)为gE、gI自然缺失疫苗。长期实践证实,伪狂犬病毒基因缺失疫苗安全性良好,且在伪狂犬病的防控中起到重要的作用。但随着我国养殖环境的改变和免疫压力的增加,猪病流行呈现老病新发,新病不断,混合感染突出等趋势,导致一些病原变异加剧,毒力不断增加。2011年以来,许多使用基因缺失活疫苗免疫的规模化猪场出现了疑似PR流行,给养猪业造成严重的经济损失,可见现有疫苗已不能对变异的PRV株产生100%的保护力[5-7]。
以一株伪狂犬流行毒株为亲本株,人工构建了一株 5 基因缺失毒株(PRV-gE-/gI-/US9-/△UL49.5/TK-),经试验证实,该毒株在小鼠、家兔、山羊、仔猪和怀孕母猪上的安全性优于Bartha-K61株。本研究将其与亲本毒株在敏感细胞上共同培养,分析培养物中毒株的类型、所占比例及对家兔的安全性,以了解该毒株在体外从亲本毒株中获得缺失基因的能力及安全性,为伪狂犬缺失疫苗的研制和转基因生物安全评价提供研究数据。
1 材料与方法
1.1 试验材料
1.1.1 病毒 伪狂犬病毒5基因缺失株PRV-gE-/gI-/US9-/△UL49.5/TK-株、PRV 野毒株 SX 株,均由中国兽医药品监察所构建/分离、鉴定和保存。病毒含量分别为 107.5TCID50/mL、107.25TCID50/mL。
1.1.2 细胞 PK15细胞由中国兽医药品监察所保存。
1.1.3 主要试剂 DMEM 营养液,Gibco公司产品;胎牛血清,PΛA公司产品;低熔点琼脂糖,Sigma公司产品;DNA/RNA抽提试剂盒,TIANGEN公司产品;KOD FX Neo DNA聚合酶购自TOYOBO公司;胶回收试剂盒购自Promega公司。
1.1.4 鉴定引物 自行设计了 TK、UL49.5、gE、gI、US9基因鉴定引物,引物序列及扩增信息见表1。
1.1.5 主要仪器设备 二氧化碳培养箱(三洋 )、恒温培养箱(三洋)、PCR仪(Biometra)、电泳仪、紫外成像仪等。
1.2 方法
1.2.1 病毒传代 将 PRV-gE-/gI-/US9-/△UL49.5/TK-株病毒液和PRV野毒株SX株病毒液用DMEM营养液分别稀释成病毒含量为 106.0TCID50/mL,分别取1 mL混合,接种已长成良好PK15细胞单层的25 cm2细胞瓶,培养至80%细胞出现细胞病变时,冻融3次,离心去除细胞碎片,取上清,记为F1,分装成1 mL/管,冻存或进行下一代接种,每代取1 mL接种1瓶25 cm2的PK15细胞单层进行传代。如此连续传代10代,收获病毒液,记为F10,分装成1 mL/管,冻存。

表1 引物序列及扩增信息Tab 1 The information of primers and amplification
1.2.2 病毒含量测定 将收获的F10病毒液用DMEM细胞培养液作10倍系列稀释,取 10-2、10-3、10-4、10-5、10-65 个稀释度,分别接种已长成良好PK15细胞单层、弃去细胞培养液的96孔培养板,每个稀释度接种8孔,每孔0.1 mL,同时设正常细胞对照8孔。置37℃、含5%CO2的培养箱培养3 d。记录细胞病变情况,按Reed-Muench法计算TCID50。
1.2.3 病毒蚀斑挑选及培养 将收获的F10代病毒液按10~20 TCID50剂量接种已长成良好PK15细胞单层的6孔细胞培养板,吸附1 h后,弃去吸附液,铺上1%的低熔点琼脂糖,继续培养48~72 h,共挑取50个病毒蚀斑,各浸于1 mL DMEM营养液中,冻融1次后,分别接种已长成良好单层的PK15细胞6孔板,每个蚀斑接种1孔,培养至病变达50%以上,收获病毒液,冻融 1次后,进行 TK、UL49.5、gE、gI、US9 基因鉴定。
1.2.4 重组情况分析
1.2.4.1 重组病毒PCR鉴定 将挑选的50个病毒蚀斑采用表1中的引物分别进行PCR鉴定,初步确定基因缺失类型,并计算病毒重组的百分率,即除流行株和5基因缺失株外能扩增出TK、UL49.5、gE/gI/US9中任一基因或多个基因的克隆斑数/50。
1.2.4.2 重组病毒基因序列测定 将扩增条带大小一致的蚀斑各选取3个样品进行序列测定,分析基因序列变异情况。
1.2.5 重组病毒安全性试验 取12只 2.5 kg左右的健康易感家兔,随机分成6组,每组2只。第1、2、3、4、5组分别皮下接种新出现的重组毒株,每只接种1 mL(含103.0TCID50);第6 组不接种作为对照。隔离饲养观察14 d,观察有无伪狂犬病临床症状。
2 结 果
2.1 病毒蚀斑挑选 PRV-gE-/gI-/US9-/△UL49.5/TK-株病毒液和PRV野毒株SX株病毒液混合后传代,收获F10代病毒液进行蚀斑挑选,随机挑选出50个蚀斑(部分蚀斑图片见图1)。
2.2 蚀斑PCR鉴定结果 将随机挑选的50个蚀斑采用 6d-F/9b-R、TK-F/TK-R、PUL50-F2/PUL50-R2三对引物进行PCR鉴定。结果(图2-图 4,表 2)发现,同时扩增出 gI/gE/US9、TK、gN 三段基因的有13个蚀斑(即野毒株),同时扩增出其中两段基因的有26个蚀斑,扩增出其中一段基因的有10个蚀斑,仅1个蚀斑未扩增出全部的三段基因(即5基因缺失株),共存在7种不同类型的毒株。即除 PRV 野毒株和 PRV-gE-/gI-/US9-/△UL49.5/TK-株外,出现了5种新的基因组合类型,分别为PRV( gE-/gI-/US9-/TK-)、 PRV ( gE-/gI-/US9-/gN-)、PRV(gE-/gI-/US9-)、PRV(TK-)、PRV(gN-),蚀斑个数分别为13个、1个、5个、5个、15个、6个、5个。病毒重组百分率=(扩增出1段基因的蚀斑数+扩增出两段基因的蚀斑数)×100%÷50=(10+26)×100%÷50=72%。 重组毒株中以gI/gE/US9三基因缺失型为主,占重组蚀斑数的41.7%,占挑选蚀斑数的30%,高于流行株的比例,成为主要的优势重组毒株。
图1 部分蚀斑图片(×200)Fig 1 The pictures of part plaques(×200)

图2 gE/gI/US9三基因鉴定结果Fig 2 Identification of gE/gI/US9 gene
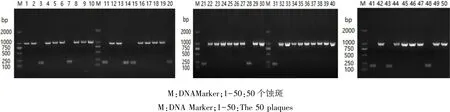
图3 TK基因鉴定结果Fig 3 Identification of TK gene

图4 gN基因鉴定结果Fig 4 Identification of gN gene

表2 50个蚀斑毒株类型、个数及所占比例Tab 2 Type,number and proportion of the 50 plaques
除流行株和5基因缺失株外,其他5种新类型按照单个基因扩增情况分析,扩增出gI/gE/US9段基因的蚀斑数为11个;扩增出TK基因的蚀斑数为25个,其中仅扩增出TK一段基因的有5个蚀斑,扩增出TK+gN或gI/gE/US9+TK两段基因的有20个蚀斑;扩增出gN基因的蚀斑为26个,其中仅扩增出gN一段基因的有5个蚀斑,扩增出TK+gN或gI/gE/US9+gN两段基因的有21个蚀斑。
2.3 扩增片段测序结果 对条带大小一致的样品随机选取3个进行序列测定,结果显示均未出现基因突变,说明出现任意两个或单个基因的重组时,是整段插入或缺失,不存在基因的突变现象。
2.4 重组病毒安全性试验 将新出现的5种毒株,即 PRV(gE-/gI-/US9-/TK-)、PRV(gE-/gI-/US9-/gN-)、 PRV (gE-/gI-/US9-)、 PRV (TK-)、PRV(gN-),经 PK15细胞增殖,测定病毒含量,分别稀释成103.0TCID50/mL皮下接种健康易感家兔,观察14 d,未见异常临床反应。
3 讨 论
对于伪狂犬病毒活疫苗的研制,人工致弱是筛选候选毒株的最有效的方法。目前我国市场上使用的多种人工致弱(毒力基因缺失)的伪狂犬病毒活疫苗都具有良好的安全性。但人工致弱株的毒力返强或基因重组一直备受关注。本研究通过同源重组的方式构建了伪狂犬病毒5基因缺失的人工致弱毒株,在此基础上,通过体外细胞培养,了解5基因缺失株与野毒株的基因重组情况,为下一步疫苗开发提供数据。
研究结果显示,5基因缺失株与野毒株混合培养,在体外连续传代10代,共获得包括野毒株和5基因缺失株在内的7种不同基因组合的毒株,符合伪狂犬病毒同源重组的规律。从缺失株PRV-gE-/gI-/US9-/△UL49.5/TK-株病毒与野毒株混合培养,获得缺失基因的能力角度分析,除13个流行株蚀斑和 1 个五基因缺失 PRV(gE-/gI-/US9-/TK-/gN-)的蚀斑外,出现其余5种新类型的36个蚀斑的可能性有两种:一是流行株在传代培养过程中缺失了 gI/gE/US9、TK、gN 中一段或两段基因;二是五基因缺失株在传代培养的过程中分别获得了gI/gE/US9、TK、gN 中一段或两段基因。 但从分子生物学角度分析,单个基因缺失或同源重组的几率应高于多个基因。在36个新类型的蚀斑中,有26个扩增出 gI/gE/US9、TK、gN 中的两段基因,提示我们这26个蚀斑可能来自流行毒株的缺失,其中gI/gE/US9 段基因的缺失比例最高(15/36)。 有 10个扩增出TK、gN单个基因,提示我们这10个蚀斑可能来自5基因缺失株的同源重组。而且,未发现有仅扩增出gI/gE/US9段基因的蚀斑,可能因其长度较长(3550bp),同源重组的几率较小,这也符合同源重组的分子生物学规律。
整体来看,流行毒株和 PRV(gE-/gI-/US9-)在10代培养物中所占比例较大,分别占26%(13/50)和30%(15/50),这说明流行株相对于5基因缺失株(仅1个蚀斑),仍属于体外培养的优势毒株,虽然不能排除基因缺失株重新获得5个基因的可能,但理论上有很大难度。而且其所占比列较培养前有所下降,也在一定程度上说明,缺失株同时获得所有缺失基因的几率很小。而 PRV(gE-/gI-/US9-)毒株所占比例较高,可能有两个方面的原因:一是在10代的培养中不断同源重组形成的,二是在最初几代的同源重组中获得细胞培养优势毒株,经多代不断培养增殖形成。值得注意的是,PRV(gE-/gI-/US9-)与商品化疫苗 Bartha 株基因缺失情况基本一致,Bartha株属于自然缺失株,进一步说明 PRV(gE-/gI-/US9-)类型毒株可能具有一定的遗传优势。 此外 PRV(gE-/gI-/US9-/TK-)型与商品化 SA215 株(PRV-gE-/gI-/TK-/LacZ+)基因缺失疫苗的基因缺失情况相似。实践证明,Bartha株、SA215株等活疫苗长期使用过程中未出现过安全问题。可以推断,本研究出现的PRV(gE-/gI-/US9-)、PRV(gE-/gI-/US9-/TK-)两个类型的毒株是安全的,不存在引起烈性感染的危险。其他三种基因类型 PRV(gE-/gI-/US9-/gN-)、PRV(TK-)和PRV(gN-)蚀斑个数分别为5个、6个、5个,所占比例不高。家兔安全性试验证实,新出现的5种基因类型的毒株以103.0TCID50剂量进行接种时,未见异常临床反应,是安全的。
实践证明,伪狂犬病毒弱毒疫苗无论是自然缺失株还是人工缺失致弱株,均具有良好的安全性[4]。本研究通过体外培养研究5基因缺失株与野毒株混合感染时重组情况,结果显示病毒重组后基因构成整体上趋向于目前常见的自然缺失株,符合病毒重组特性,新重组的伪狂犬病毒株安全性良好,为该毒株今后作为疫苗候选毒株提供一些数据参考。

