猪传染性胸膜肺炎放线杆菌的鉴定和耐药性研究
杨 方,崔明全,张纯萍,赵 琪,宋 立,徐士新
(中国兽医药品监察所,北京100081)
猪传染性胸膜肺炎(Porcine contagious pleuropneumonia,PCP)在1957年,被Pattison等人首次报道[1],并被国际公认为危害猪养殖业的三大呼吸道传染病之一[2]。猪传染性胸膜肺炎放线杆菌(Actinobacillus pleuralpneumoniae,APP)是一种重要的经济性病原体,属巴氏杆菌科放线杆菌属[3-4],革兰氏阴性菌,显微镜下观察多呈球杆状[5]。根据APP生长是否需要烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)将其分为生物Ⅰ型和生物Ⅱ型[6]。APP血清型众多,不同国家、不同地区的优势血清型不同,我国主要流行血清型有 1、2、3、4、5、7 和 10 型,以 1、3、7 型为主[7]。
APP与副猪嗜血杆菌相似,在实验室鉴定诊断时极易混淆,准确快速鉴定出病原菌尤为重要。APP血清型具有多样性且不同血清型菌株毒力不同,血清型和毒力的鉴定给猪传染性胸膜肺炎诊断与免疫防控带来很大难度。临床中防治该病常使用阿莫西林和头孢类药物,但效果并不理想,且长期使用该类药物会产生耐药性,并影响猪肉的质量[8],给养猪业造成较大的经济损失[9],因此在治疗时应结合药敏试验结果选择抗菌药物。鉴于此,研究比较了传统与新型鉴定方法,鉴定国内流行致病性血清型和毒力表型,并测定大量菌株对常用抗革兰氏阴性菌和广谱抗生素的耐药性,比较了不同血清型的耐药性差异,以期为临床提供迅速准确的鉴定方法,指导临床合理用药。
1 材料与方法
1.1 材料
1.1.1 菌株 实验室现有45株菌,其中30株APP为2009年中国兽医药品监察所保存的临床分离菌株。15株APP为2016年从河南地区猪场病死猪分离所得。质控菌株ATCC 25922由中国兽医药品监察所保存。
1.1.2 主要仪器和试剂 胰酪胨大豆琼脂培养基、胰蛋白胨大豆肉汤培养基购自北京陆桥技术股份有限公司。氧化型辅酶Ⅰ(NAD)购自罗氏公司。胎牛血清(FAD)购自德国PAN Biotech公司。基质CHCA购自美国SIGMA公司。微量生化反应试剂购自杭州滨河微生物试剂有限公司。2×Taq PCR Master Mix购自北京博迈德公司。DL 2000 DNA Marker购自TaKaRa公司。MALDI TOF微生物鉴定仪器购自岛津公司。
1.1.3 动物 6 周龄 Balb/c 小鼠,雌雄各半,购自北京维通利华实验动物技术有限公司。
1.2 方法
1.2.1 细菌分离培养 无菌采取河南地区猪场病死猪肺脏和脾脏病料接种于添加NAD和FAD的胰蛋白大豆琼脂(TSA)培养基上,置37℃培养箱中培养18~24 h,观察细菌的生长情况,并选取单菌落进行纯化培养,以供后续实验。
1.2.2 革兰氏染色镜检 选取疑似单个菌落涂片,进行革兰氏染色,并在显微镜下进行观察。
1.2.3 生化鉴定 无菌操作挑取纯化后的单个菌落分别接种于乳糖、尿素、蔗糖等微量生化发酵管中(含添加NAD及FAD的TSB培养基),置于37℃恒温培养箱内培养24 h,观察发酵结果。
1.2.4 PCR 分子鉴定 根据文献[10]合成一段 APPⅣ毒素基因的特异性引物。上游:5'-TTATCCGAACTTTGGTTTAGCC-3',下游:5'-CATATTTGATAAAACCATCCGTC-3'。目标产物片段大小约为417 bp。DNA的提取参考文献水煮方法[11],PCR反应条件:94 ℃ 4 min;94℃ 40 s,65℃ 40 s,72℃ 1 min,30个循环;72℃ 10 min。PCR产物进行1%琼脂糖凝胶电泳后观察分析。
1.2.5 MALDI TOF 微生物学鉴定 选取 1~2 个纯化培养的单个菌落,加入600 μL 70%乙醇,混匀;12000 r/min离心2 min,弃去上清;在沉淀中加入50 μL 70%甲酸,混匀,再加入 50 μL 乙腈,混匀,12000 r/min离心2 min,吸出上清;在上样板上先点1 μL上清,待干后再点2 μL CHCA 基质,放干后上样检测。
1.2.6 血清型鉴定 根据文献[12-13]合成一段APPapxⅣ基因特异性引物序列。本研究中使用的引物在表1中详细说明。1型和7型反应条件:95 ℃ 5 min;94 ℃ 1 min,63 ℃ 1 min,72 ℃ 1 min,33个循环;72℃ 10 min;3型反应条件:95℃5 min;95 ℃ 30 s,61 ℃ 90 s,72 ℃ 2 min,25 个循环;68 ℃ 15 min。
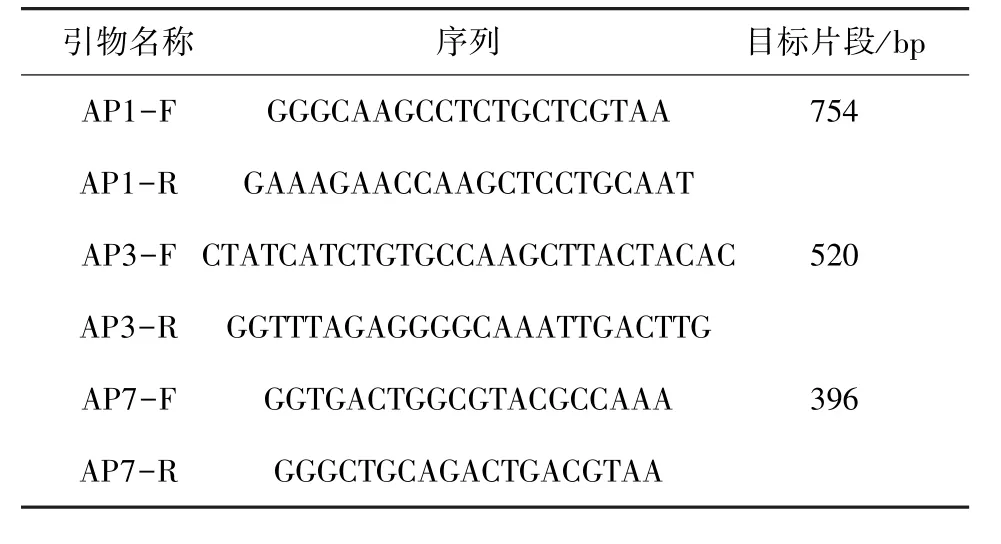
表1 研究中使用的引物Tab 1 Primers used in this study
1.2.7 血清毒力鉴定 选取血清型为 1、3、7 型的菌株各一株,纯化培养后选取单菌落接种于TSB培养基中培养10 h。首先做预实验,稀释菌液浓度为1×107~8×109CFU/mL,每个稀释度 200 μL 腹腔注射5只小鼠,持续观察1周,并统计致90%和致10%小鼠死亡的菌液浓度,以此为正式试验的菌浓度界限。在此范围内2倍倍比稀释菌液浓度,每个浓度梯度注射10只小鼠,设置6只注射同等浓度生理盐水的小鼠为空白对照,观察1周,统计各组小鼠死亡情况。
1.2.8 药敏试验 参考CLSI的标准,用微量肉汤稀释法[14]测定45株APP对34种常用抗革兰氏阴性菌及广谱抗生素的MIC值。质控菌株为大肠杆菌ATCC 25922。
2 结 果
2.1 革兰氏染色镜检 取待测菌株单菌落进行涂板染色,于显微镜油镜下观察细菌形态,可见细菌为革兰氏阴性,多呈短杆状,两极着色明显(图1)。
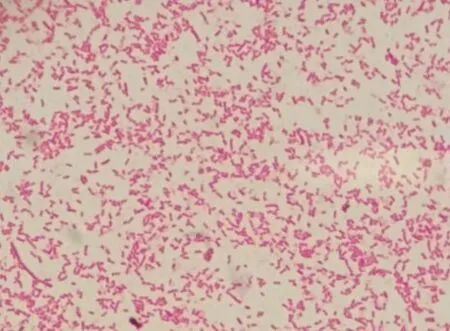
图1 革兰氏染色结果Fig 1 Results of gram staining
2.2 生化鉴定 取待测的细菌纯化培养物于各生化鉴定管中,37℃条件下培养24 h,由表2可知,待测菌株均能够发酵乳糖、尿素、麦芽糖等。不发酵阿拉伯糖、棉子糖、核糖等。符合APP的生化特性。

表2 生化鉴定结果Tab 2 Results of biochemical identification
2.3 PCR鉴定结果 PCR产物经1%核酸凝胶电泳,在凝胶成像仪中可见扩增产物在417 bp处有明显的扩增条带,且与阳性对照菌株条带位置一致(图2)。
2.4 MALDI TOF微生物学鉴定 将待测菌株经过MALDI TOF微生物鉴定制样方法提取DNA后上样检测,以ATCC 25922为标准菌株进行校准,鉴定结果可得到峰比对率高达91.5%,鉴定为巴氏杆菌科放线杆菌属(图3)。
2.5 鉴定方法比较 对45株菌分别用革兰氏染色镜检、生化试剂鉴定、PCR分子鉴定、MALDI TOF微生物学鉴定四种方法进行鉴定,以PCR分子鉴定结果为标准,从菌株培养操作时间和准确率方面进行对比,发现四种方法中以MALDI TOF微生物学鉴定方法最佳,操作方便快捷、准确率高(表3)。
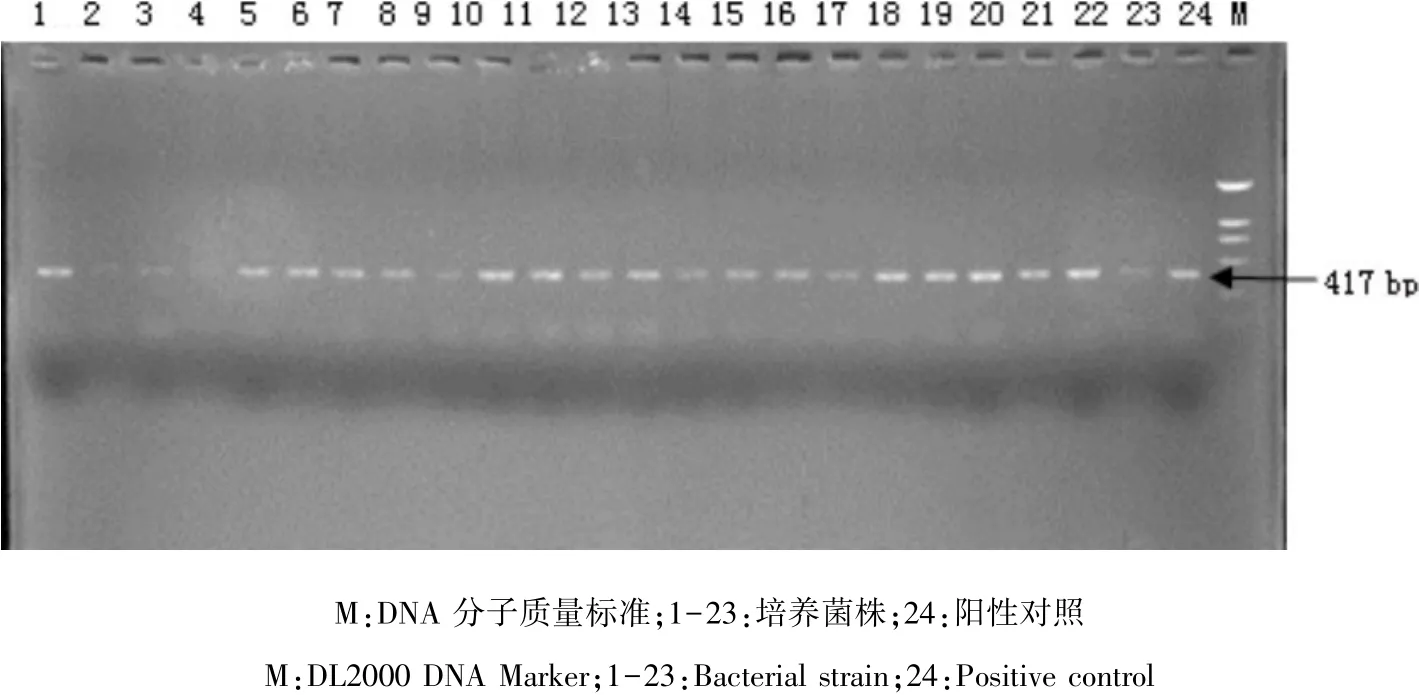
图2 培养菌株的PCR检测结果Fig 2 PCR test results of cultured strains
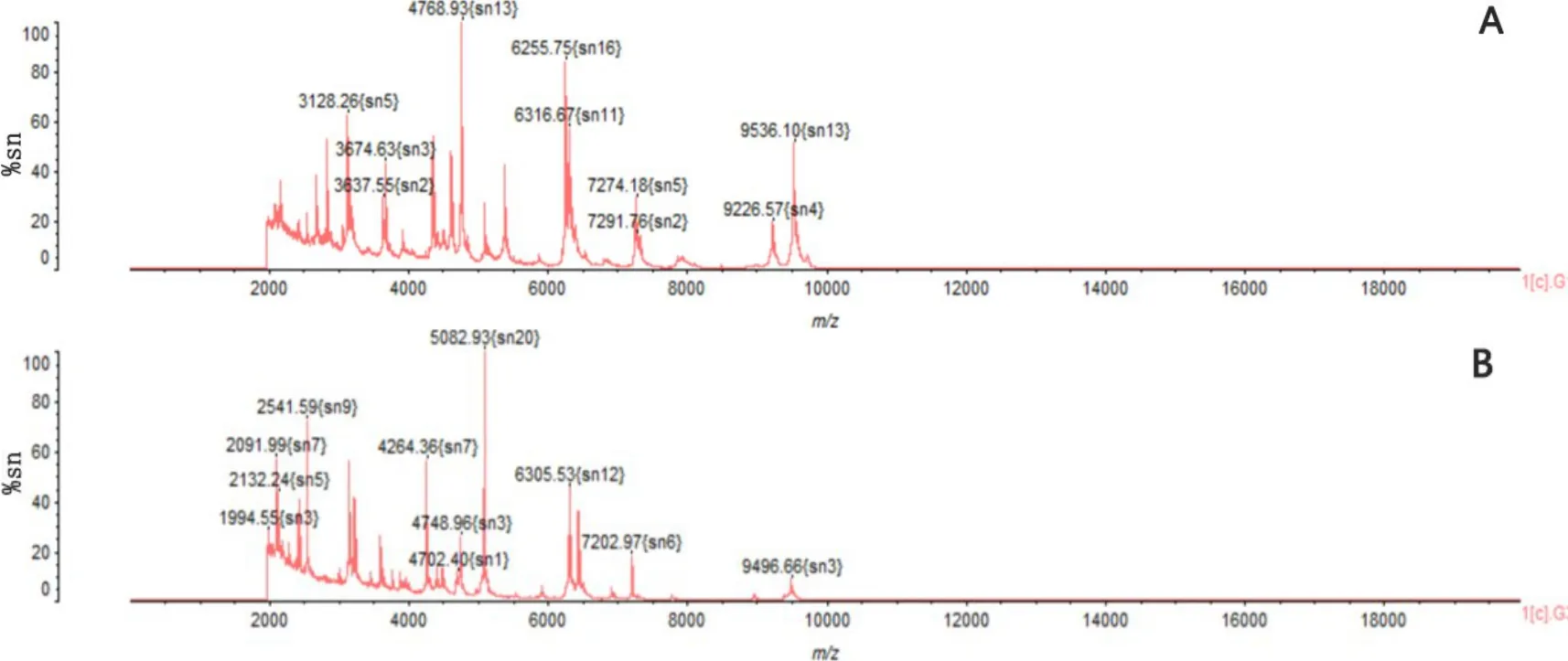
图3 标准菌株ATCC 25922鉴定结果(A)和培养菌株鉴定结果(B)Fig 3 Identification results of standard strain ATCC 25922(A) and culture strain (B)

表3 鉴定方法的比较Tab 3 Comparison of identification methods

表4 血清型1、3、7型分离率Tab 4 Results of serotype 1,3 and 7 separation rate
2.6 血清型鉴定 用PCR方法鉴定45株待测菌株,结果见表4。血清型1型菌株13株分离率为28.9%,血清型3型菌株20株分离率为44.4%,血清型7型菌株7株分离率为15.6%,其余5株菌株非1型、3型和7型。
2.7 血清型毒力鉴定 经过预实验确定菌液浓度范围分别为血清型1 型:1×109~0.625×108CFU/mL;血清型 3 型:2×109~1.25×108CFU/mL;血清型7型:4×109~2.5×108CFU/mL。 小鼠死亡情况如表4,根据寇氏法[15]计算出三种血清型的半数致死量分别为 2.04×108CFU/mL、4.08×108CFU/mL、1.07×109CFU/mL。 由表 5 可见,血清 1 型致病力强于3型,血清3型致病力强于7型。
2.8 药敏试验 根据CLSI标准,替卡西林对质控菌株 ATCC 25922 的 MIC 为 4~16 μg/mL,本实验测得的MIC为8 μg/mL,实验条件和实验操作符合标准。以CLSI已有的APP药敏结果为判定标准,通过对MIC结果分析,得出APP对氟苯尼考、头孢类等高度敏感,对四环素类耐药性较高(表6)。分别测定血清型 1型(13株)、3型(20株)、7型(7株)的耐药性,结果显示强毒力血清型1型对四环素类(包括四环素、多西环素、金霉素、土霉素)耐药率均高于3型,3型高于7型,且血清1型对泰乐菌素、卡那霉素、庆大霉素等的MIC值明显高于3型及7型(表6)。同时比较了2009年分离的30株和2016年分离的15株APP的耐药性变化,发现2016年分离的菌株对四环素、土霉素、金霉素、多西环素的耐药率明显高于2009年分离的菌株(表7)。

表5 血清型1、3、7型菌株对小鼠的致病性实验结果Tab 5 Pathogenicity test results of serotype 1,3 and 7 strains on mice

表6 APP对抗生素的MIC分布和耐药率Tab 6 MIC distribution and resistance rate of APP to antibiotics
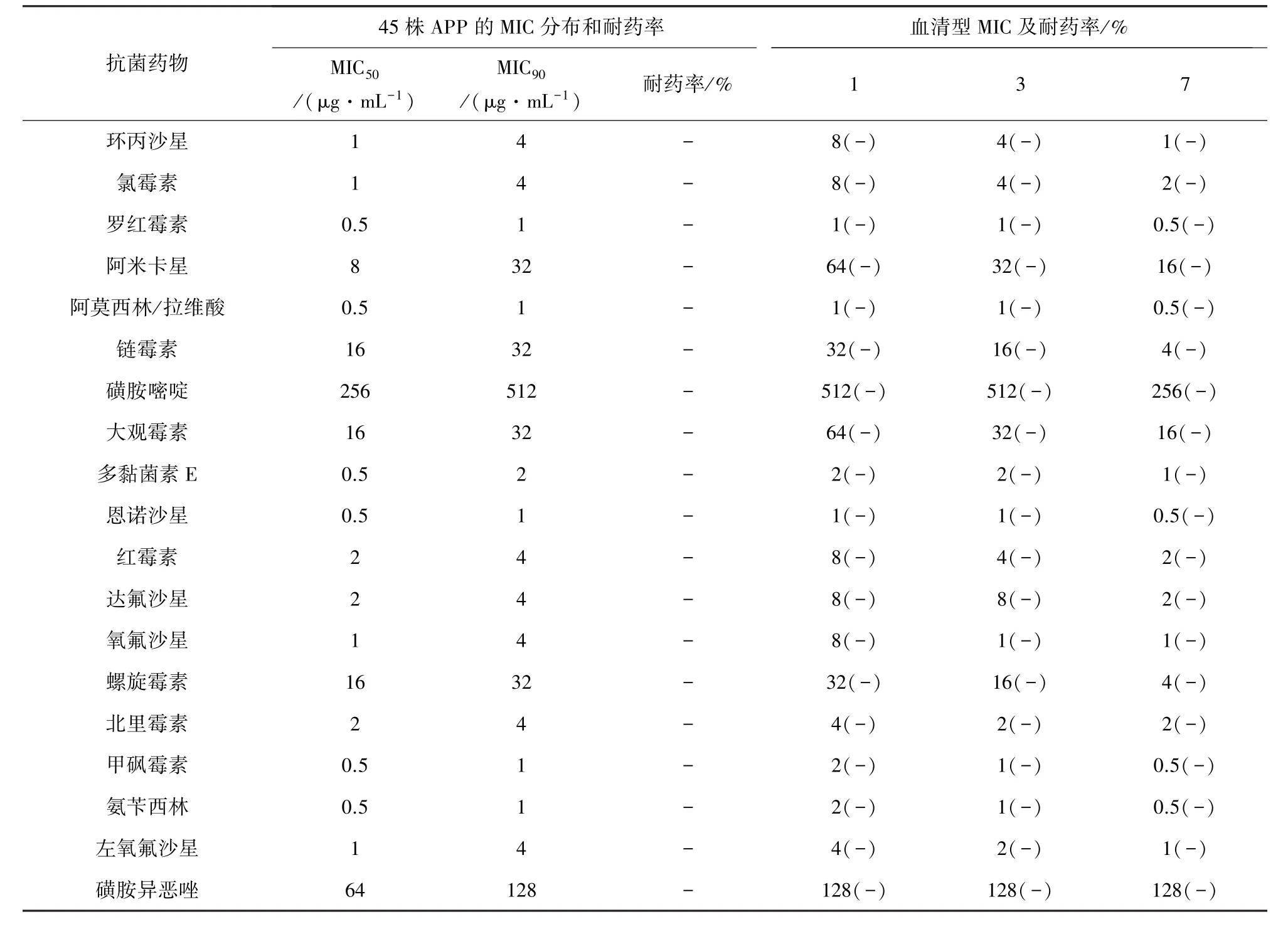
续表
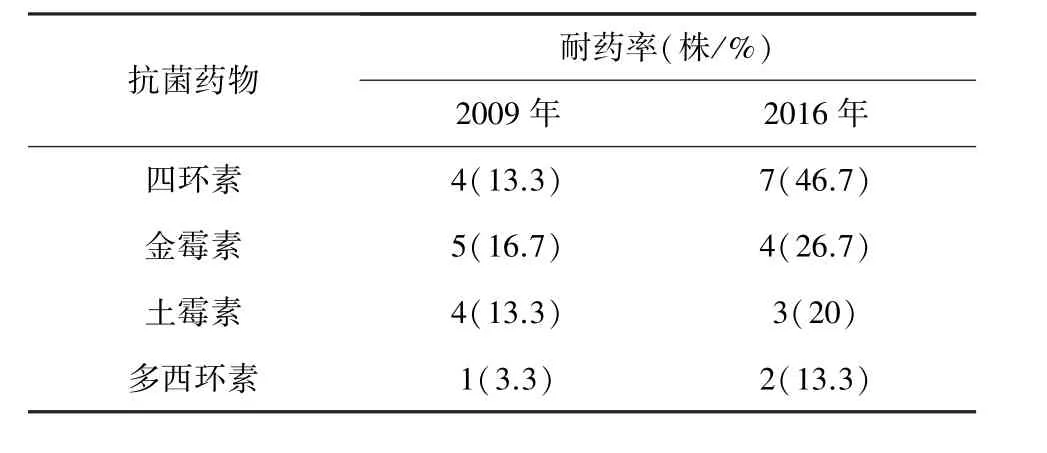
表7 2009年和2016年APP耐药性变化Tab 7 Change of drug resistance of APP between in 2009 and in 2016
3 讨 论
分离鉴定APP是实验室诊断猪传染性胸膜肺炎的重要途径,多用传统方法和PCR分子鉴定方法[16]。本实验分别通过革兰氏染色镜检、生化试剂鉴定、PCR分子鉴定对45株APP进行鉴定,发现传统鉴定方法操作复杂、准确率相对较低、重复性稍差,PCR鉴定方法准确率高,但操作费时。MALDI TOF微生物学鉴定方法目前主要应用于临床样本中微生物的鉴定[17]。本研究首次运用MALDI TOF方法对45株APP进行鉴定,发现该方法操作简单快捷,准确率高,可重复性好,适用于样本数量多的鉴定方法。综上研究可知MALDI TOF微生物学鉴定方法最佳,适用于临床快速鉴定细菌并进而开展药敏筛查。
了解我国APP的主要流行致病血清型对于流行病学追踪、细菌的研究及治疗猪传染性胸膜肺炎都有重要作用。准确鉴定致病血清型对临床诊断至关重要,传统的血清型鉴定方法基于抗体反应,但是交叉反应严重[18]。经查阅文献发现目前血清型鉴定方法主要是运用PCR分子生物学,该方法操作简单准确率高。本研究通过PCR分子实验鉴定了我国主要流行血清型1型、3型、7型,发现待测株菌中血清3型所占比例最大。流行致病血清型及毒力鉴定对临床治疗该病会有很大帮助。本研究测定的血清毒力结果与田永祥等[19]报道的一致,并在此基础上比较了血清7型的毒力。对比三种血清型的半数致死量,发现血清1型毒力强于3型,3型强于7型。
临床中治疗猪传染性胸膜肺炎主要使用抗生素,而APP容易产生耐药性,所以在预防及治疗方面有一定的困难,测定其MIC值,对解决这一难题有重要的作用。本实验对2009年分离保存的30株和2016年分离保存的15株APP进行药敏试验。目前CLSI仅制定了APP对四环素类、头孢类、氟苯尼考的折点,对其他药物暂无相关判定标准,本研究测定的药敏数据对制定APP对其他药物的折点具有重要意义。研究结果表明,45株APP对氟苯尼考和头孢类抗生素高度敏感,对四环素、金霉素、土霉素等耐药性较强,耐药率分别为24.4%、20%、15.6%。APP对罗红霉素、恩诺沙星、氨苄西林等抗生素的 MIC50值仅为 0.5 μg/mL,而对磺胺嘧啶、磺胺异恶唑的 MIC50值分别高达 265 μg/mL、64 μg/mL。对比2009年和2016年APP的耐药差异,发现2016年分离的APP对四环素、金霉素、土霉素、多西环素的耐药性明显高于2009年分离的菌株,且对比2009年和2016年APP的药敏结果发现,MIC值明显增大。其原因可能与近几年抗菌药物使用量增加有关。据中国兽药协会的年度抗菌药物原料药生产统计[20],我国兽用抗菌药物原料药销售量由2009年的28400吨,增加到2016年50400吨。
我国APP主要流行的致病血清型为1、3、7型[21],因此研究比较了国内流行的三种血清型的耐药性特点。不同血清型对四环素类抗生素的耐药性存在明显差异,血清型1型对四环素类抗生素多表现为耐药性,耐药率高于30.8%。血清型1型对四环素类耐药率高于3型,3型高于7型,且血清1型的MIC值明显高于血清3型,3型高于7型,说明不同毒力血清型耐药性有差异,强毒力血清型耐药率相对更高。但是我们关注强毒力型细菌耐药性高是否也导致致病性更强,由于未开展有关研究,尚无法得出结论,仍需进一步研究。
在临床中使用抗生素治疗猪传染性胸膜肺炎时应注意合理用药,关注耐药性变化趋势,防范于未然,减少耐药菌株的出现。本研究通过比较鉴定方法及分析药敏数值,为临床折点制定提供数据支撑,对临床中猪传染性胸膜肺炎的诊断治疗提供科学依据,同时为该病的防控及兽医临床抗生素的使用风险评估提供参考。

