鸭坦布苏病毒RT-PCR检测方法的建立及应用
邹 敏,张 青,王 红,刘 东,刘新文,范根成∗,吴发兴
(1.青岛易邦生物工程有限公司动物基因工程疫苗国家重点实验室,山东青岛266114;2.中国动物卫生与流行病学中心,山东青岛266032)
2010年4月以来,我国浙江、江苏、山东、福建、河北、北京等省份的蛋鸭发生一种以产蛋率急速下降甚至停产及不同程度死亡为特征的疫病,俗称鸭卵巢出血症,亦称为“鸭黄病毒感染”,现命名为鸭坦布苏病毒病(Duck Tembusu Virus Disease)[1-2]。各品种蛋鸭、种鸭、鹅等家禽均有发生,但主要见于开产蛋鸭。产蛋鸭发病后出现长时间(40~60 d)的产蛋率低下,恢复后所产种蛋的受精率和孵化率出现下降。发病鸭群采食量显著下降,拉绿色稀便,精神沉郁,扎堆,羽毛逆立,眼球深陷,目光呆滞,体重减轻;少量病鸭出现站立不稳、震颤、行走困难和姿势异常;主要病变为出血性卵巢炎、间质性肝炎和非化脓性脑炎。该病近期成为危害中国养鸭业的重要疫病之一。产蛋率高的鸭群患病后4~5 d从产蛋高峰或高产蛋率迅速下降至20%~30%,严重的于发病后7 d左右停产;刚开产蛋鸭产蛋率上升缓慢或减蛋,长时间低产蛋率或无产蛋高峰出现。不同地区、不同品种鸭群发病率高低不一,群发病率几乎100%,病死率0%~12%[3-5]。
由于是新发传染病,人们对该病原及由其感染导致的发病认识很不充分。对病原的生物学性状、实验室检测、诊断、治疗和疫苗等的研究尚处于起步阶段,缺乏能够快速诊断或检测方法。2011年3月,从临床表现产蛋骤降的病死蛋鸭的7份发病组织样品(卵巢、肝脏等)中,成功分离到4株坦布苏病毒地方流行毒株(另文发表),借鉴现代分子生物学技术,在查阅已公开发表的黄病毒快速检测方法以及分子流行病学研究文献基础上,开展了本病的实验室快速RT-PCR检测研究。
1 材料与方法
1.1 毒株 鸭坦布苏病毒(Duck Tembusu virus,DTMUV)JN 株、禽流感病毒(Avian influenza virus,AIV)、新城疫病毒(Newcastle disease virus, NDV)、减蛋综合症病毒(Chicken egg down syndrome virus,
EDSV)、鸭肝炎病毒(Duck hepatitis virus, DHV)、传染性法氏囊病毒(Infectious bursal disease virus,IBDV)、传染性支气管炎病毒(Infectious bronchitis virus,IBV)、番鸭呼肠孤病毒(Muscovy duck reovirusis,MDRV)以及禽网状内皮增生症病毒(Avian reticuloendotheliosis virus,REV),由青岛易邦生物工程有限公司动物基因工程疫苗国家重点实验室保存并提供。
1.2 临床发病样品及预处理 共14份,由青岛易邦生物工程有限公司技术服务部提供。每份样品主要包括发病鸭的肝脏、卵巢组织等。样品的预处理方法是:取每份样品约5.0 g并剪碎,再加入4倍体积的PBS(pH7.2),混匀后研磨至糊状,在-20 ℃、室温条件下反复冻融3次,再经4℃、12000 r/min离心10 min,收集上清液分装后-80℃冻存备用。
1.3 试剂 DNAzol、Trizol Reagent购自 Invitrogen公司;PrimeScript One Step RT-PCR Kit Ver.2 试剂盒、DL 2000 DNA Marker均购自宝生物(大连)工程有限公司;DNA胶回收试剂盒购自上海生工生物工程有限公司。
1.4 引物设计 登录GenBank,分别下载了51个具有代表性的黄病毒全基因组序列及5个禽源黄病毒株的全部或部分E基因序列,经DNAstar7.0软件比对分析后,利用Primer5.0软件自主设计了1对检测引物,DTMUV-TF:5'-TTACCATGGACAGGGTCATCA-3',DTMUV-TR:5'-TCCAATTGTGCTCCCACTTCT-3',扩增片段大小为 549 bp,交由生工生物工程上海(股份)有限公司合成,稀释成工作浓度(20 pmol/L)-20 ℃保存备用。
1.5 病毒核酸的提取 按照Invitrogen公司生产的Trizol或DNAzol说明书分别提取上述9种病毒及14份样品中可能含有的TMUV总RNA或其他DNA病毒总DNA,-20℃ 保存备用。
1.6 RT-PCR 方法的建立
1.6.1 RT-PCR 反应体系及程序 总体系 25 μL,包括 Primescript 1 step enzyme mix 2 μL、2×1step buffer 12.5 μL、DTMUV-TF 和 DTMUV-TR 各 0.5 μL、DTMUV-JN 株总 RNA 2.5 μL,最后用 DEPC H2O补至25 μL,反应程序:50 ℃ 30 min、94 ℃ 5 min、35×(94 ℃ 40 s、4/54.5/55/55.5 ℃ 40 s、72 ℃50 s)、72℃ 10 min,最后4℃冷却10 min,PCR 结束后取5 μL扩增产物进行1%琼脂糖凝胶 100 V 45 min电泳检查并成像。
1.6.2 特异性试验 用确定的最佳条件分别对阳性对照及其他相关的8种病毒进行RT-PCR检测,对其特异性进行评价。取PCR产物5 μL,在1%琼脂糖凝胶上电泳。回收549 bp的目的条带,用上海生工生物工程技术服务有限公司生产的DNA胶回收试剂盒回收目的片段进行测序,并与黄病毒代表成员的E基因相应核酸片断进行在线Blast分析,以进一步验证本方法的特异性。
1.6.3 敏感性试验 将所提取的 DTMUV-JN株总RNA进行定量,10倍梯度连续稀释,按上述PCR反应进行扩增,测定模板最低检出量,判定该RT-PCR方法的敏感度。
1.6.4 重复性平行检测 将所提取的DTMUV-JN株总RNA平分为5份,分别交给5位实验室技术人员,按照1.6.1项下的条件进行 RT-PCR,验证该方法的可重复性。
1.6.5 临床样品的检测 对14份疑似鸭坦布苏病毒感染的样品按照建立并优化的RT-PCR方法进行检测。
2 结 果
2.1 反应条件的确定 按1.6.1项配制好反应体系进行梯度PCR,电泳检测结果见图1。筛选出DTMUV的最佳一步法RT-PCR检测退火温度是55 ℃,时长 40 s。
2.2 特异性试验 用确定的RT-PCR条件对阳性对照JN分离株、8个参考毒株进行了RT-PCR扩增,结果仅有阳性对照有预期目的条带出现,其他8个参考毒株没有目的条带(图2),说明本方法的特异性极佳。回收目的条带测序获得549 bp的特异性核酸序列(图3)。
2.3 敏感性试验 用设计的特异性引物对不同浓度的DTMUV-JN株RNA直接进行RT-PCR扩增,结果可检测出即使是将提取的核酸稀释至10-6,仍能检出目的条带(图4)。
2.4 临床样品的检测 应用建立的方法对14份临床疑似发病样品按照优化的RT-PCR条件进行检测,有6份阳性(图5),经克隆测序表明均是阳性目的判断扩增,检出率为42.86%。

图1 DTMUV RT-PCR检测条件的确定Fig 1 Determination of RT-PCR assay for DTMUV
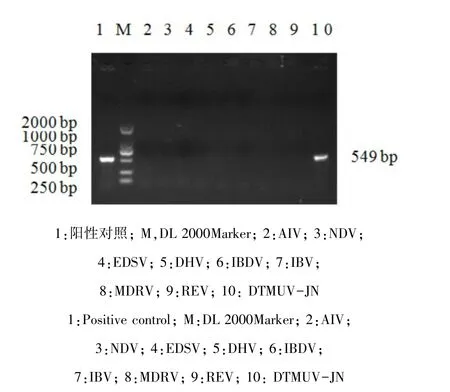
图2 特异性实验Fig 2 Specificity of RT-PCR assay

图3 DTMUV-JN株E基因扩增区域基因序列Fig 3 Gene sequence of E gene amplification region of DTMUV-JN strain
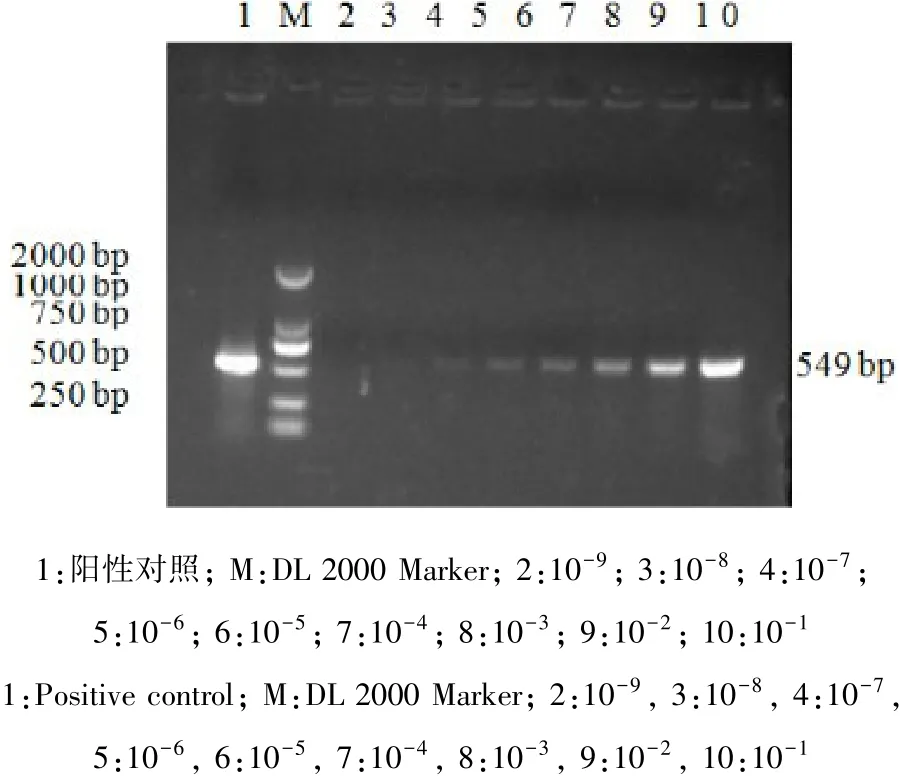
图4 敏感性分析Fig 4 Sensitivity of RT-PCR assay

图5 应用性检测Fig 5 Application detection
3 讨 论
在前期调查研究以及曹贞贞等人研究基础上,已基本明确该病毒可能属于黄病毒科成员[6]。根据国际病毒分类委员会第五次病毒分类报告,黄病毒科黄病毒属分为蜱传病毒、蚊媒病毒和节肢动物媒介未知的病毒,其中,蚊媒病毒类又分为Aroa病毒群、登革热病毒群、日本脑炎病毒群、科科贝拉病毒群、恩塔亚病毒群、斯庞德温尼病毒群和黄热病病毒群[7]。依据现有研究结果,黄病毒的基因组为单股正链RNA,全基因组长约10990 bp,分别编码3种结构蛋白(Capsid、PrM和Envelop)、8种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、2K、NS4B 和NS5),另外在其基因组5'端和3'端均有一段非翻译区[8]。为此,我们在设计检测引物时为便于今后开展分子流行病学研究,以E基因为检测靶基因,从NCBI上下载了51个黄病毒的全基因序列以及率先发表的白洋淀病毒(BYD virus)及相关水禽黄病毒的E基因进行了多序列比较,设计了一对黄病毒通用检测引物,以期获得较好的检测结果。结果证实,该方法是成功的,具有极佳的扩增效果。
准确、快速地诊断疫病是畜禽疫病防控工作的首要环节。传统的实验室诊断方法如病毒分离、免疫荧光法等不仅操作繁琐,而且耗时费力,而PCR或RT-PCR技术主要针对病原体的基因组,具有良好的敏感性和特异性,对样品的要求不高,已广泛应用于多种病原体的检测和流行病学调查[9-11]。本研究设计了具有通用性的针对黄病毒E基因核酸序列的特异性引物对,建立的DTMUV RT-PCR方法具有较好的特异性,即使将阳性对照模板稀释至10-6仍能够检测到目的片段,具有极好的重复性;对临床病料中的14份疑似病例进行检测,检出阳性样品6份,该种黄病毒感染阳性率达42.86%,表明试验建立的RT-PCR方法可用于该病的实验室检测/诊断。

