QuECHRS结合UPLC-MS/MS法测定水产品中酰胺醇类抗生素残留及基质效应
李丽春,刘书贵,尹怡,郑光明,马丽莎,戴晓欣,单奇,赵城,王景鑫
(中国水产科学研究院珠江水产研究所,农业部水产品质量安全风险评估实验室(广州),农业部休闲渔业重点实验室,广州 510380)
酰胺醇类药物是水产养殖中广泛使用的一类广谱性抗菌治疗药物,主要包括氯霉素(chloramphenicol, CAP),甲砜霉素(thiamphenicol,TAP)和氟苯尼考(florfenicol,FF)。其中CAP因具有较强的毒副作用,可引起致命的灰婴综合征和再生障碍性贫血症[1-2]。因此中国及欧盟等国家和地区已将CAP列为禁用药[3],欧盟规定CAP在水产品中的最高残留限量(MRL)为0.3 μg/kg,随着CAP在水产养殖中的禁用,TAP和FF因抗菌谱广、吸收迅速且无交叉耐药性等特点[4],已成为了CAP的主要替代药物,在水产养殖中广泛用于淡水鱼类细菌性病害的治疗用药。欧盟(EEC)96/23 公告和中国农业部235号公告规定TAP和FF在动物性食品中最高残留限量分别为50和1 000 μg/kg[5-6]。
近年来关于抗生素残留的公众事件给水产品质量安全带来了严峻的挑战。随着检测技术的不断更新,高灵敏度、高准确性、快速便捷和环境友好的检测方法是目前检测分析的趋势。因此有必要建立更准确、快速和稳定检测的水产品中酰胺醇类抗生素残留的方法。
目前水产品等动物性组织中酰胺醇类的检测方法报道的较多,常用且可定量的主要有高效液相色谱法(HPLC)[7-11]、气相色谱法(GC)[12-19]、气质联用法(GC-MS)[20-22]、液质联用法(LC-MS/MS)[23-26]和超高效液相色谱质谱联用法(UPLC-MS/MS)[27-29]等。但上述方法的前处理过程比较复杂,所需时间较长和材料较复杂,大多需要经过提取、净化和浓缩。而前处理过程越复杂其过程损耗越大,因此适当地减少处理步骤可提高其检测灵敏度。此外,前期研究大多未考虑基质效应对定量结果的影响。针对上述情况,本研究基于QuECHERS前处理技术建立水产品中酰胺醇类抗生素残留的快速准确的检测方法,同时采用提取后加标法评价目标物浓度和基质浓度对基质效应的影响,以期建立更加准确、稳定且灵敏度较高的酰胺醇类抗生素的快速检测方法,为水产品中酰胺醇类抗生素残留分析的准确测定提供技术支持。
1 材料和方法
1.1 材料与试剂
主要包括:甲醇为色谱纯,购买于Burdick & Jackson 公司(USA);甲酸和乙酸为色谱纯,购于美国Fisher公司;N-丙基乙二胺(PSA)和C18为分析纯,购于CNW 公司(USA);氯霉素(CAP)、甲砜霉素(TAP)、氟苯尼考(FF)和氘代氯霉素(CAP-D5)标准品(纯度>98%)购于德国Dr.Ehrenstorfer公司;氯化钠和无水硫酸镁为分析纯,购于广州化学试剂厂;实验用水为超纯水。实验所用草鱼购于广州市荔湾区西塱水产品市场。
1.2 仪器和设备
主要包括:Waters UPLC-Xevo TQD MS/MS超高效液相色谱串联质谱仪,旋涡混匀器(德国IKA公司),超纯水机(美国Millipore公司),离心机(上海安亭公司),氮吹仪(美国Organomation公司)和高速离心机(美国Sigma公司)以及其他实验室常用器皿。
1.3 标准溶液的配制
分别准确称取CAP、TAP和FF标准品各10.0 mg,用甲醇定容于10 mL容量瓶中,配制成质量浓度为1.0 mg/mL的标准储备液。分别移取上述单标储备液0.1 mL, 用甲醇定容于同一10 mL的容量瓶中,配制成10.0 μg/mL的混合标准中间溶液。移取100 μg/mL
CAP-D5内标标准溶液1.0 mL用甲醇定容于10 mL容量瓶内,配制成质量浓度为10.0 μg/mL标准内标中间溶液,采用系列稀释法配制成100.00 ng/mL标准工作溶液。所有标准溶液均于-18 ℃下避光保存。
1.4 仪器条件
1.4.1 液相色谱条件
色谱柱为Waters (Wexford, Ireland) Acquity UPLC BEH C18(2.1×100 mm i.d., 1.7 μm particle size),色谱柱温度为40 ℃;流动相A为甲醇,流动相B为水;流速为0.20 mL/min;进样体积为10 μL,梯度洗脱程序列于表1。
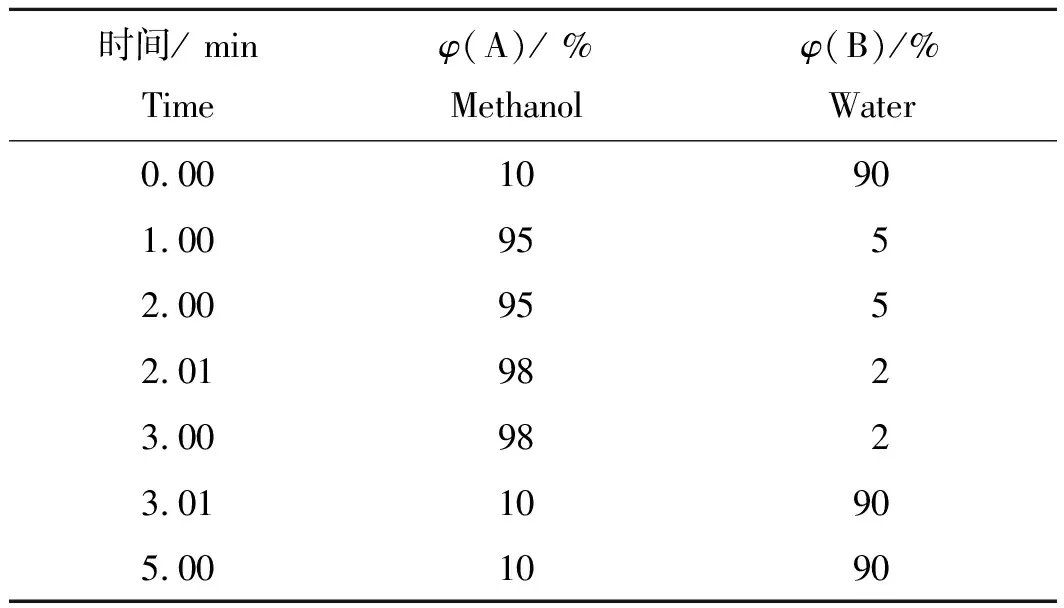
表1 梯度洗脱程序Tab.1 Workflow of gradient elution
注:A为甲醇,B为水。
1.4.2 质谱条件
离子源为大气压电喷雾离子源负离子模式(ESI-);离子传输毛细管温度为350 ℃;离子源温度为150 ℃;去溶剂气流速为650 L/h,锥孔流速为50 L/h,扫描模式为多反应监测(MRM),质谱参数见表2。
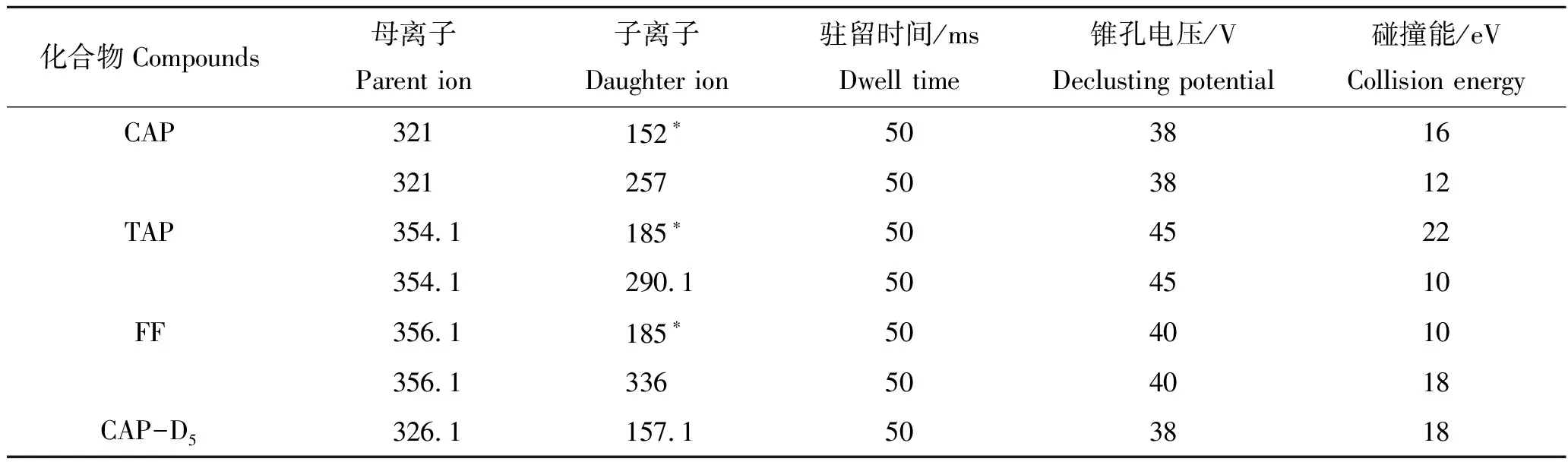
表2 酰胺醇类化合物的MRM参数Tab.2 MRM parameters of amphenicols
注:带“*”为定量离子。
1.5 样品前处理
准确称取草鱼肌肉样品5.00 g(精确到0.01 g)于50 mL离心管中,加入100.00 ng/mL CAP-D5内标标准工作溶液50 μL,然后加入10 mL 0.1%甲酸酸化的乙腈、3 g无水硫酸镁和2 g氯化钠,同时加入150 mg PSA和300 mg 中性氧化铝。涡旋提取1 min,5 000 r/m离心5 min,将上清液转移至50 mL玻璃离心管中,剩余残渣用10 mL 0.1%甲酸酸化乙腈重复提取一次,合并上清液于40 ℃下氮气吹干,1 mL甲醇水(1∶1,V/V)定容,过0.22 μm滤膜,待UPLC-MS/MS测定。
1.6 基质效应评价
基质效应主要指试样中的非待测组分影响待测物浓度或质量测定的准确度,引起待测物响应值增加或减少的现象[30-33]。
任何一种物质的检测都不可避免基质效应的影响[34],在液相色谱质谱中,由于基质中的非挥发性组分与待测物质在雾滴表面离子化的过程中发生竞争,影响电喷雾接口处的离子化效率,非挥发性的基质组分将雾滴吸引在一起,阻止其裂解成更小的微滴。LC-MS的检测限、线性、准确度和精密度均受到基质效应的影响,因此在LC-MS分析时必须考虑基质效应[35]。
水产品中蛋白质和脂肪等杂质较复杂,容易引起基质效应。研究表明,样品提取方法[36]、固相萃取净化[37]、同位素标记[38-39]和基质中磷脂含量等对基质效应均有一定影响。为了确保水产品中酰胺醇类抗生素检测的准确性,本研究对QuECHERS结合UPLC-MS/MS法测定水产品中酰胺醇类抗生素残留量的基质效应进行研究,为减弱或补偿其残留测定中的基质效应提供理论依据,同时也为酰胺醇类抗生素在水产品中的准确定量分析等提供技术支持。
在建立的前处理方法和色谱测定条件下,测定空白基质提取液与纯溶剂中同浓度目标物的响应强度,通过二者目标物与内标物峰面积之比的相对比值评价基质效应(matrix effect,ME)[40],计算公式见式(1)。
式(1)
式(1)中:ME为基质效应值,Am为基质中待测物质峰面积,Ami为基质中内标物峰面积,As为溶剂中待测物质峰面积,Asi为溶剂中内标物峰面积。
如果ME>1.0,说明基质对目标化合物具有增强响应强度的作用;如果ME<1.0,说明基质对目标化合物具有抑制其响应强度的作用;如果ME=1.0,则说明基质对目标化合物无影响;ME偏离1.0程度越大说明基质效应越强,ME越接近1.0,则表明基质效应越小[41-45]。
1.7 实际样品的测定及风险分析
从广东佛山环球水产品批发市场和广州市黄沙水产品批发市场共采集生鱼样品20份,每份样品采集鲜鱼4尾,每尾不低于1.0 kg,采用本研究建立的前处理方法和色谱条件对市场采集的鲜鱼样品中3种酰胺醇类抗生素残留量进行测定,并根据现行限量标准对采集的样品进行风险分析。
2 结果与分析
2.1 方法线性、检测限和定量限
采用系列稀释法配制质量浓度分别为0.1、0.5、1.0、2.0、5.0、10.0、20.0、50.0和100.0 ng/mL的混合标准溶液,其中含有CAP-D5内标5.0 ng/mL。按照本方法建立的色谱条件进行测定,以目标物与内标物的峰面积之比为纵坐标y,质量浓度为横坐标x,建立标准曲线(图1),获得其线性回归方程及相关系数(表3)。TAP在0.5~100.0 ng/mL范围内线性良好,相关系数r大于0.999 9;CAP和FF在0.1~100.0 ng/mL范围内线性较好,相关系数r大于0.999 8。
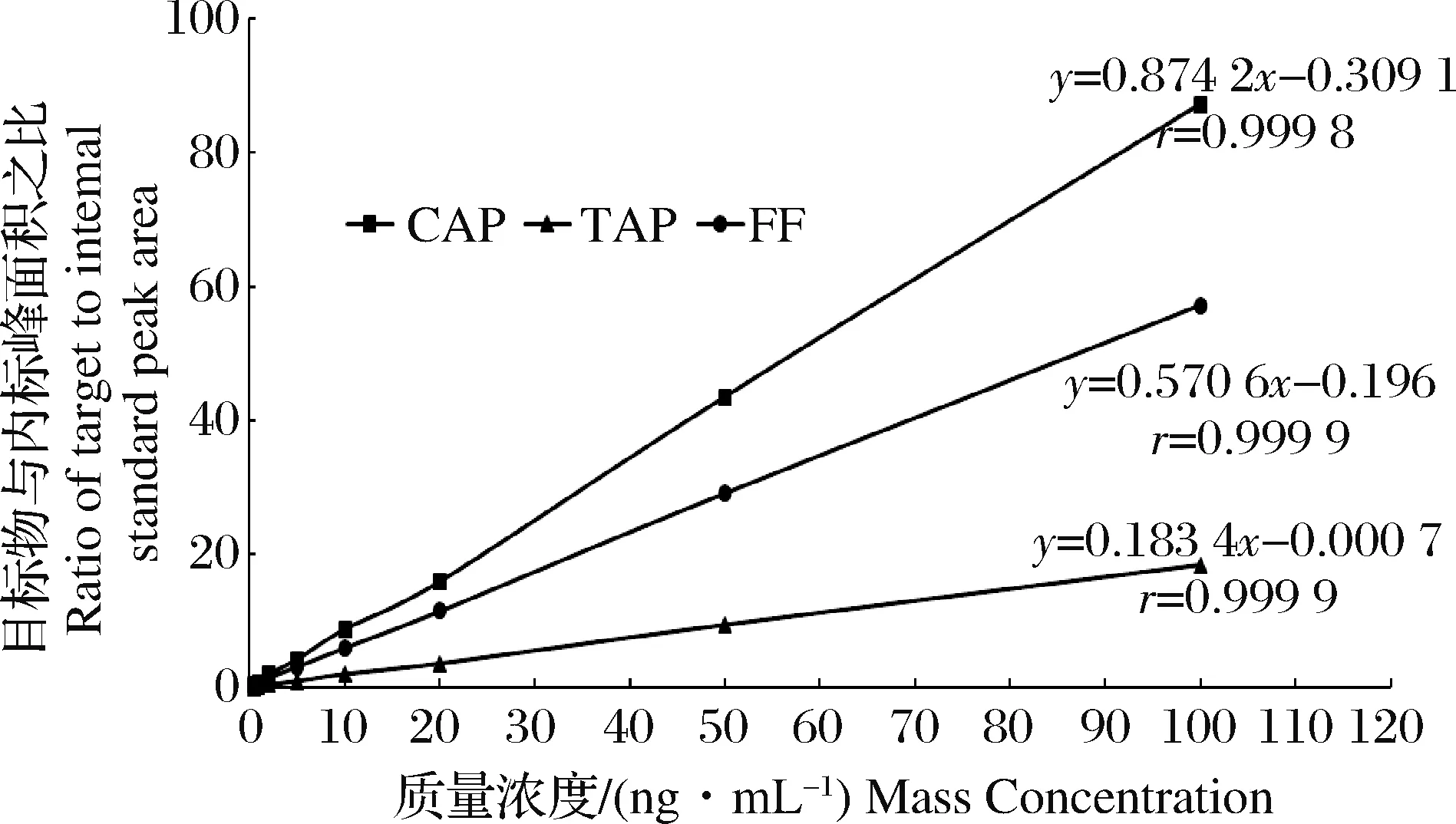
图1 氯霉素、甲砜霉素和氟苯尼考标准溶液校准曲线图Fig.1Calibration curves of CAP, TAP and FF
在空白基质样品中添加3种抗生素后,以性噪比(S/N)等于3和10分别计算方法中化合物的检测限(LOD)和定量限(LOQ)[46]。3种酰胺醇类抗生素的LOD为0.10~0.50 μg/kg,LOQ为0.50~1.00 μg/kg,结果见表3。
2.2 加标回收率和精密度
按照本方法的前处理方法和色谱条件,以不含CAP、TAP和FF的草鱼为基质,采用基质加标的方法评价了1.0、5.0和10.0 μg/kg 3个含量水平的加标回收率和精密度,每个含量水平设置6个重复,结果见表4。
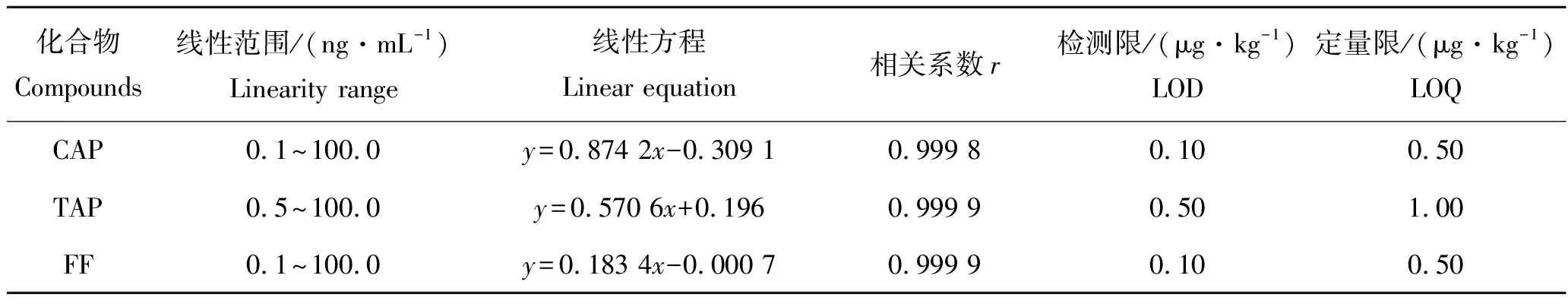
表3 3种抗生素线性方程、相关系数、检测限和定量限Tab.3 Linear equation, correlation, LOD and LOQ for 3 antibiotics
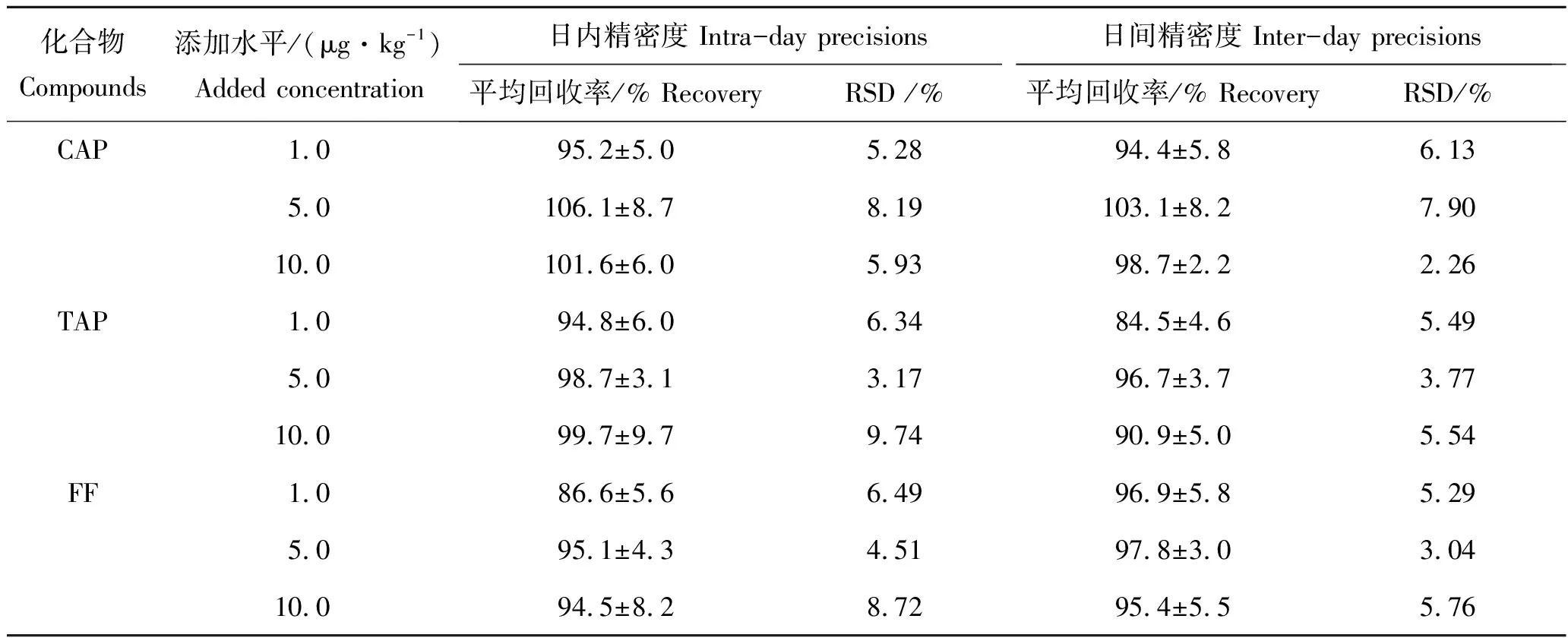
表4 3种抗生素在草鱼肌肉样品中的加标回收率和精密度Tab.4 Average recoveries and precisions for 3 antibiotics in carp muscle n=6
结果表明,3种酰胺醇类抗生素的加标回收率在(84.5±4.64)%~(106.1±8.69)%之间,日内精密度在3.17%~9.74%之间,日间精密度在2.26%~7.90%之间。酰胺醇类抗生素的残留检测方法大多都采用提取后再净化的方法[47-48],还有采用固相萃取柱净化的方法[49-50],而本研究的前处理方法简单快捷,提取和净化同时进行,且回收率和精密度较好,满足国内外对水产品中酰胺醇类抗生素残留检测的要求。
2.3 基质效应
2.3.1 目标分析物浓度对基质效应的影响
采用提取后加标法,分析了目标分析物浓度(0.1、0.2、0.5、1.0、2.0、5.0、10.0、20.0、50.0和100.0 ng/mL)对基质效应的影响,每个质量浓度设置6个重复。
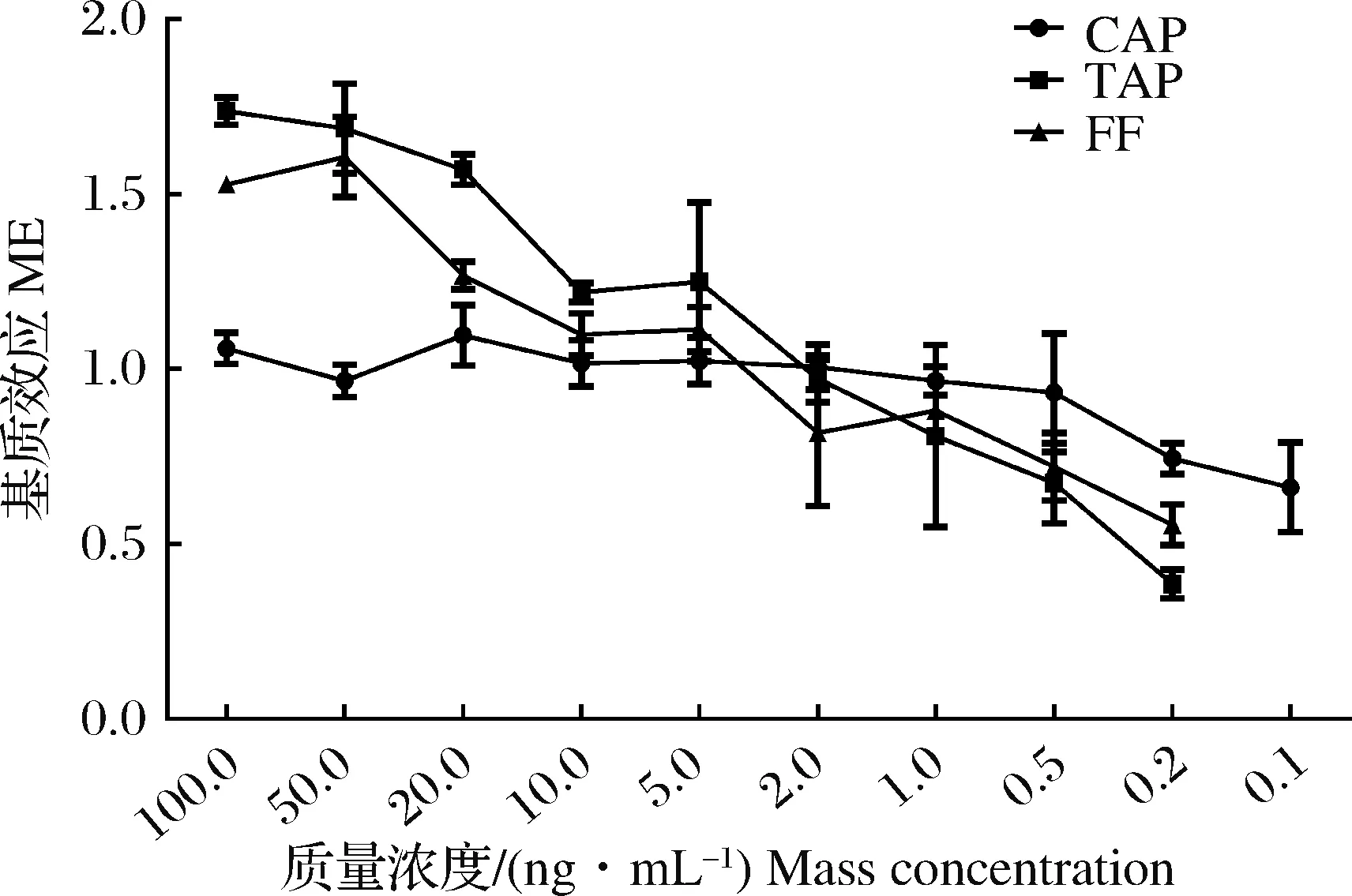
图2 目标分析物浓度对基质效应的影响Fig.2 The effect of target analytes concentrationson matrix effect
基质效应大小与基质中目标分析物浓度有一定相关性。据文献报道,高浓度水平基质效应低于低浓度水平[51-52]。CAP、TAP和FF的浓度对基质效应有一定影响,随目标物浓度的减小,基质效应值也随之减小,呈现出高浓度基质增强,低浓度基质抑制的趋势(图2)。其中CAP的基质效应在(0.661±0.127)~(1.096±0.087)之间,其受目标物浓度变化的影响较TAP和FF平缓;在1.0~100.0 ng/mL质量浓度范围内的CAP的ME在(0.965±0.040)~(1.096±0.087)之间,在样品测定时在此范围内可忽略基质效应的影响。但是在1.0 ng/mL以下则存在较强的基质抑制效应,建议检测定量低浓度的CAP时要考虑基质效应的影响。
TAP在5.0~100.0 ng/mL浓度范围内存在较强的基质增强效应,其基质效应在(1.219±0.028)~(1.737±0.039)之间,在5.0 ng/mL以下则存在基质抑制效应,且浓度越低基质抑制效应越强。FF在20.0 ng/mL质量浓度以上时存在基质增强效应,在5.0 ng/mL以下时存在基质抑制效应,且随浓度降低增强。因此,在检测酰胺醇类抗生素残留时,除CAP检测质量浓度在1.0~100.0 ng/mL范围内不需要考虑基质效应外,其他化合物均要考虑基质效应的影响。综上,在实际检测中,采用基质标准曲线进行定量,可提高检测结果的准确性。
2.3.2 基质浓度对基质效应的影响
本研究采用提取后加标法分析了基质浓度对基质效应的影响,按照上述前处理方法,分别取2.0、5.0和10.0 g样品,经提取净化后用20.0 ng/mL混合标准溶液(其中CAP-D5质量浓度为10 ng/mL)定容至1 mL,获得基质浓度分别为2.0、5.0和10.0 g/mL,待测物浓度为20.0 ng/mL的基质标准溶液,采用上述仪器条件进行测定。
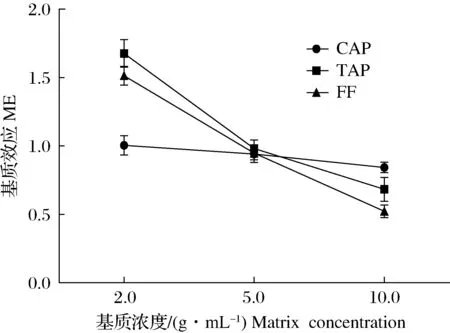
图3 基质浓度对基质效应的影响Fig.3 The effects of matrix concentrations on matrix effects
结果表明,基质浓度对检测结果有较大影响,随着基质浓度的增加,基质效应从基质增强变为基质抑制,且CAP的基质效应较TAP和FF低,其基质效应为(0.843±0.038)~(1.004±0.071)(图3)。基质浓度在5.0 g/mL时3种抗生素的基质效应较小,分别是CAP为(0.941±0.061),TAP为(0.981±0.063),FF为(0.948±0.050)。基质浓度为10.0 g/mL时3种抗生素均存在基质抑制效应,而在2.0 g/mL时TAP和FF存在较强的基质增强效应,其基质效应分别为(1.676±0.100)和(1.513±0.069)。李丽春等[53]的研究也表明基质浓度对基质效应有一定影响,因此在测定水产品中酰胺醇类抗生素残留时应考虑检测样品的取样量,并采用基质标准曲线进行定量校准,以确保检测结果的准确性。
2.4 实际样品测定及风险分析
采用本方法对市售的20份鲜鱼样品进行了测定,结果发现4份检出TAP,其质量浓度为2.26~9.57 μg/kg;FF检出17份,检出浓度为1.34~33.27 μg/kg。根据中国农业部235号公告中规定FF残留限量为1 000 μg/kg,实验所涉及的所有样品均未超过限量标准。而TAP在日本肯定列表中规定鲈形目残留限量为20 μg/kg,所有检出样品均未超过限量要求。
3 结论
本研究采用超高效液相色谱串联质谱法(UPLC-MS/MS)对水产品中3种酰胺醇类抗生素的残留量进行定量测定,样品基质经0.1%甲酸酸化的乙腈提取,同时加入PSA和中性氧化铝用于净化除杂,用甲醇水(1∶1,V/V)定容后UPLC-MS/MS测定,通过基质匹配标准曲线内标法减弱其基质效应。CAP和FF在0.1~100.0 ng/mL质量浓度范围内线性良好,相关系数0.999 8~0.999 9;TAP在0.5~100.0 ng/mL范围内线性良好,相关系数为0.999 9。CAP和FF的LOD和LOQ分别为0.10 μg/kg和0.50 μg/kg;TAP的LOD为0.50 μg/kg,LOQ为1.00 μg/kg。3种酰胺醇类抗生素在1.0、5.0和10.0 μg/kg 3个添加水平下的日内平均回收率为(86.60±5.62)%~(106.10±8.69)%,日内精密度为3.17%~9.74%;日间加标回收率为(84.50±4.64)%~(103.00±8.17)%,日间精密度为2.26%~7.90%。该方法LOD和LOQ满足国内外水产品中酰胺醇类抗生素残留测定的要求,日内和日间加标回收率和精密度好。该方法前处理简便快捷、灵敏度、重复性且准确性较好,可用于水产品中3种酰胺醇类抗生素残留的定量测定。
采用QuECHERS结合UPLC-MS/MS法测定水产品中酰胺醇类抗生素时,基质效应对目标分析物浓度的测定有影响,且基质浓度对基质效应也有影响。其中CAP的基质效应较TAP和FF小,其基质效应为(0.661±0.127)~(1.096±0.087);且在1.0~100.0 ng/mL浓度范围内的基质效应为(0.965±0.040)~(1.096±0.087),而在1.0 ng/mL以下则存在较强的基质抑制效应,建议检测定低浓度(<1.0 ng/ml)的CAP时考虑基质效应的影响。TAP在5.0~100.0 ng/mL质量浓度范围内存在较强的基质增强效应。FF在20.0 ng/mL质量浓度以上时存在基质增强效应,而在5.0 ng/mL以下时存在基质抑制效应,且随浓度降低基质抑制效应增强。同样基质浓度对检测结果也有较大影响,随着基质浓度的增加,基质效应从基质增强变为基质抑制。因此,在测定水产品中酰胺醇类抗生素残留时应对其基质效应进行考察,并采用基质标准曲线进行定量校准,以确保检测结果的准确性。

