维替泊芬抑制肾癌细胞769-P增殖及其机制
刘国钦,胡国强,冼玉荣,曾贵林,李姝君
1江门市新会区人民医院肾内内分泌科,广东 江门 529100;2江门市中心医院肾内科,广东 江门 529100;3广东医科大学附属医院肿瘤一区,广东 湛江 524000
肾细胞癌(肾癌),男性患者多于女性患者,属于泌尿生殖系统中的高发恶性肿瘤[1-2]。近年来,伴随着环境因素的变化以及国民生活方式的改变,肾癌的发病率逐年上升[3-4]。目前针对肾癌的治疗方案主要为手术切除疗法,但是切除术后出现肾癌复发或者转移仍然为治疗的一大难题。化疗、放疗为恶性肿瘤的重要治疗方案,结合外科手术切除治疗取得良好的疗效。由于肾癌细胞中常常表达多药耐药基因(MRD),编码多药耐药蛋白并锚定于细胞膜表面,具有药物泵的作用,可加速将进入肾癌细胞中的药物泵出细胞外而使化疗药物失去疗效[5-7]。相对于其它恶性肿瘤而言,肾细胞癌对化疗和放疗敏感性弱,预后不良[8-9]。维替泊芬于2000年获得批准应用于临床治疗的一种光学增强剂,主要治疗以脉络膜血管形成为主的老年黄斑相关疾病。近年来,多篇文献报道维替泊芬具有抑制多种肿瘤细胞生存的能力,包括肝癌、甲状腺癌及血液系统恶性疾病等[10-17]。维替泊芬通过调控相关细胞通路及基因的表达,作用于癌细胞的基因复制、转录及翻译水平,促进肿瘤细胞凋亡并抑制其生长。截至目前为止,未见研究报道关于维替泊芬对肾细胞癌的作用。本文通过探究维替泊芬对肾细胞癌的杀伤作用,进一步研究该药物杀伤肾细胞癌的潜在机制,为开发肾癌治疗新药物及新治疗靶点奠定一定的基础。
1 材料与方法
1.1 材料
769-P细胞来源于ATCC。维替泊芬(Verteporfin,纯度≥98%)购自Selleckchem。RPMI-1640培养基、PBS缓冲液、0.25%胰酶、胎牛血清均购自BI。细胞增殖检测试剂盒(CCK8)购自Dojindo。免疫印迹实验的所有抗体均购自CST。荧光定量PCR及逆转录试剂盒均购自Takara。实时荧光定量PCR引物由广州艾基生物技术有限公司提供合成。
1.2 实验方法
1.2.1 细胞培养 769-P细胞以普通完全培养基(含10% FBS的1640)于孵箱中培养。细胞增殖至培养皿的75%~85%时,消化并传代培养。
1.2.2 维替泊芬药物溶液配制 维替泊芬用二甲基亚砜充分溶解,配成浓度为100 μmol/L的母液,保存于超低温冰箱中。实验前用PBS缓冲液将维替泊芬母液配成不同浓度的工作液备用。
1.2.3 维替泊芬半数抑制浓度测定 取状态良好的769-P细胞以5000/孔接种于96孔板中,24 h后按照实验需求将培养基更换为含维替泊芬的培养液,浓度分别为0、0.1、0.5、1、5、10、20 μmol/L,每个浓度4复孔。完全培养基组为空白组,0 μmol/L组为对照组。加药处理48 h后按照CCK8说明书指示进行操作,利用全波长酶标仪检测A450nm。抑制率=100%-(实验组-空白组)/(对照组-空白组)×100%。
1.2.4 细胞增殖实验 769-P细胞以2000/孔接种于96孔板中,24 h后按照实验设计将培养基更换为含维替泊芬的培养液。利用CCK8分别检测加药后第0、24、48、72 h的细胞活性,计算并绘制生长曲线。
1.2.5 细胞凋亡及周期实验 769-P细胞以5×105/孔接种于6孔板中,24 h后按照实验设计将培养基更换为含维替泊芬的培养液,药物浓度依次为0、1、5、10 μmol/L,细胞于孵箱中继续培养24 h后用按照APC/PI凋亡试剂盒和BD公司的周期试剂盒说明书指示进行细胞处理,流式细胞仪进行后续细胞凋亡和细胞周期的检测。
1.2.6 划痕实验 状态良好的769-P细胞以1×106/孔的密度接种于6孔板中,待细胞增殖至密度达90%~100%时,用无菌的中枪头在细胞中迅速划痕,更换相应药物浓度的培养基,加药浓度依次为0、1、5、10 μmol/L加药前于倒置显微镜下拍照,培养48 h后再拍照1次。
1.2.7 克隆实验 肾癌769-P细胞以1000/孔的密度接种于6孔板中,24 h后按照实验设计将培养基更换为含维替泊芬的培养液,药物浓度分别为0、1、5、10 μmol/L,细胞培养10 d后用PBS缓冲液冲洗干净,固定液固定0.5 h,继续冲洗后加入结晶紫染色0.5 h,冲洗干净染色液后拍照。细胞克隆为超过50个细胞的细胞团。
1.2.8 实时荧光定量PCR 用TRIzol裂解细胞并提取总RNA。严格按照逆转录试剂盒及实时荧光定量PCR说明书(TaKaRa)指示进行细胞总RNA的逆转录及荧光定量检测。实时荧光定量PCR引物序列见表1。内参基因选用GAPDH,利用2-ΔΔCt法分析结果。

表1 实时荧光定量PCR引物序列
1.2.9 Western blotting 收集各组细胞并洗涤干净,加入适量的强效细胞裂解液并充分吹打混匀,放置于冰上裂解0.5 h。低温离心机中12 000 r/min离心12 min后收集上清液。BCA蛋白定量法检测各实验组细胞裂解液中的蛋白浓度,加入适量的蛋白上样缓冲液并充分混匀,100 ℃双蒸水中煮 8min后将样品保存于超低温冰箱中。SDS-PAGE电泳:预先制备好SDSPAGE凝胶,每个电泳通道的上样蛋白量为35 μg,恒压80 V电泳20 min后切换到110 V电泳约70 min;利用250 mA恒流湿转法将SDS-PAGE凝胶上的蛋白转印到标记好的PVDF膜上;5%BSA溶液封闭约70 min后孵育相应一抗溶液,低温摇床上摇晃孵育一抗过夜;TBST洗涤一抗5次,总共0.5 h;室温下孵育二抗约70 min;TBST洗脱二抗4次,总共2 0min;加入预先配制的ECL发光液并放置于Tannon成像系统中,显色,拍照。
1.2.10 统计学方法 计数资料及计量资料均采用双侧检验,参数检验采用t检验而非参数检验采用χ2检验,P<0.05认为差异具有统计学意义。数据采用GraphPadPrism 7软件处理。
2 结果
2.1 维替泊芬对肾癌细胞769-P形态及生长的影响
维替泊芬对769-P细胞的半数抑制浓度为4.917 μmol/L。2 μmol/L的维替泊芬作用于769-P细胞24 h后即能改变细胞形态,抑制细胞生长。
2.2 维替泊芬抑制769-P细胞增殖
CCK8实验结果显示,随着维替泊芬浓度的升高以及作用时间的延长,细胞增殖速率变慢,说明维替泊芬抑制肾癌769-P细胞增殖具有浓度依赖性和时间依赖性(P<0.05,图1A-B)。
2.3 维替泊芬促进肾癌769-P细胞凋亡并阻滞769-P细胞生长周期
流式细胞术结果显示随着维替泊芬浓度的增大,769-P细胞凋亡率越高。各浓度维替泊芬处理后769-P细胞G0/G1期比例增加,S期及G2/M期比例均比对照组细胞少(P<0.05,图1C-D)。
2.4 维替泊芬抑制769-P细胞迁移
细胞划痕实验显示,随着维替泊芬浓度的增大,细胞迁移距离变小,说明维替泊芬抑制肾癌细胞迁移的能力(P<0.05,图2A-H)。
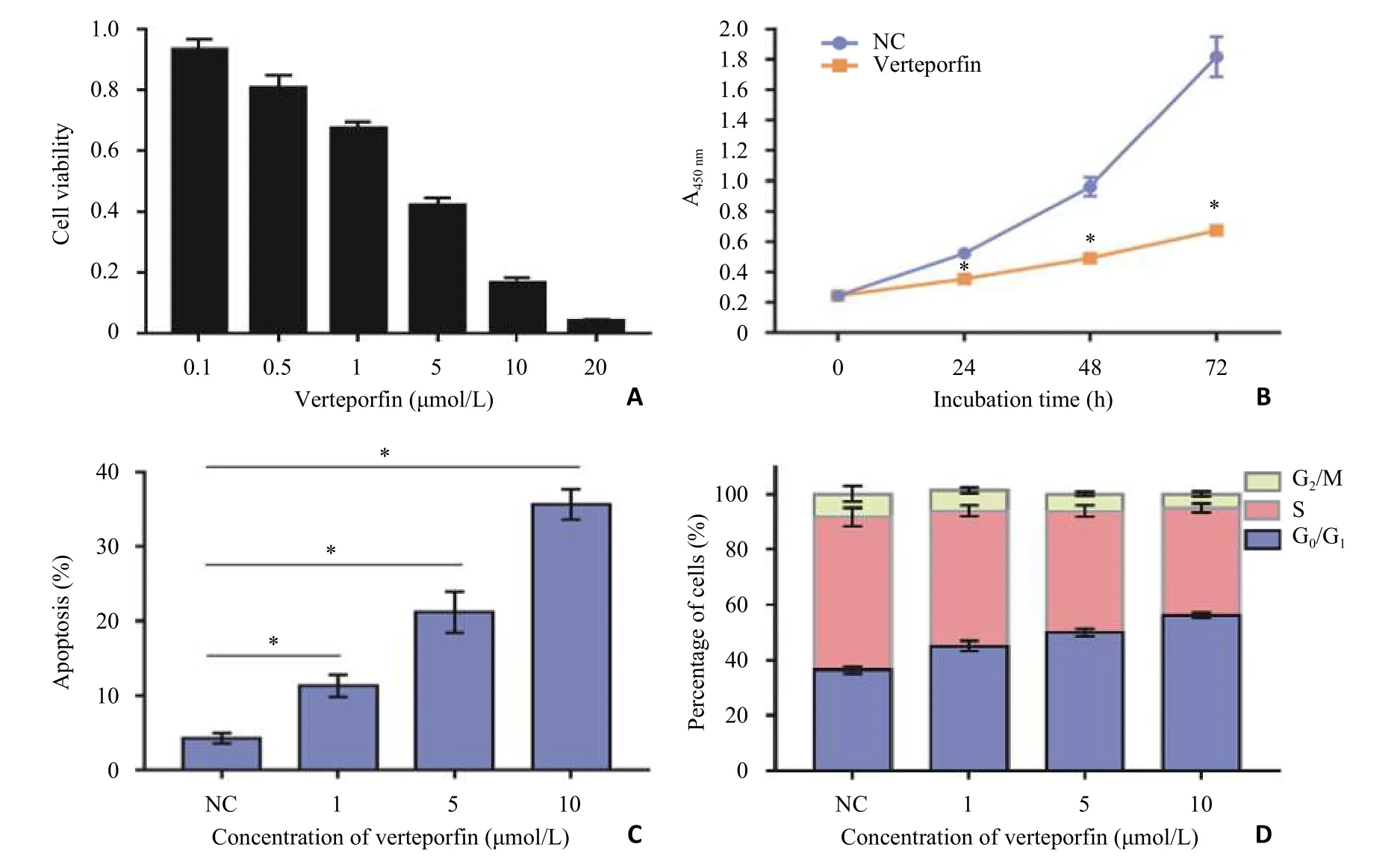
图1 维替泊芬对769-P细胞增殖、凋亡及周期的影响

图2 细胞划痕实验
2.5 克隆实验
空白对照组明显可见细胞克隆形成,1 μmol/L维替泊芬处理组细胞克隆形成数目略少于正常对照组,5 μmol/L维替泊芬处理组细胞克隆较少,10 μmol/L维替泊芬处理组基本未见细胞克隆形成(P<0.05,图3)。
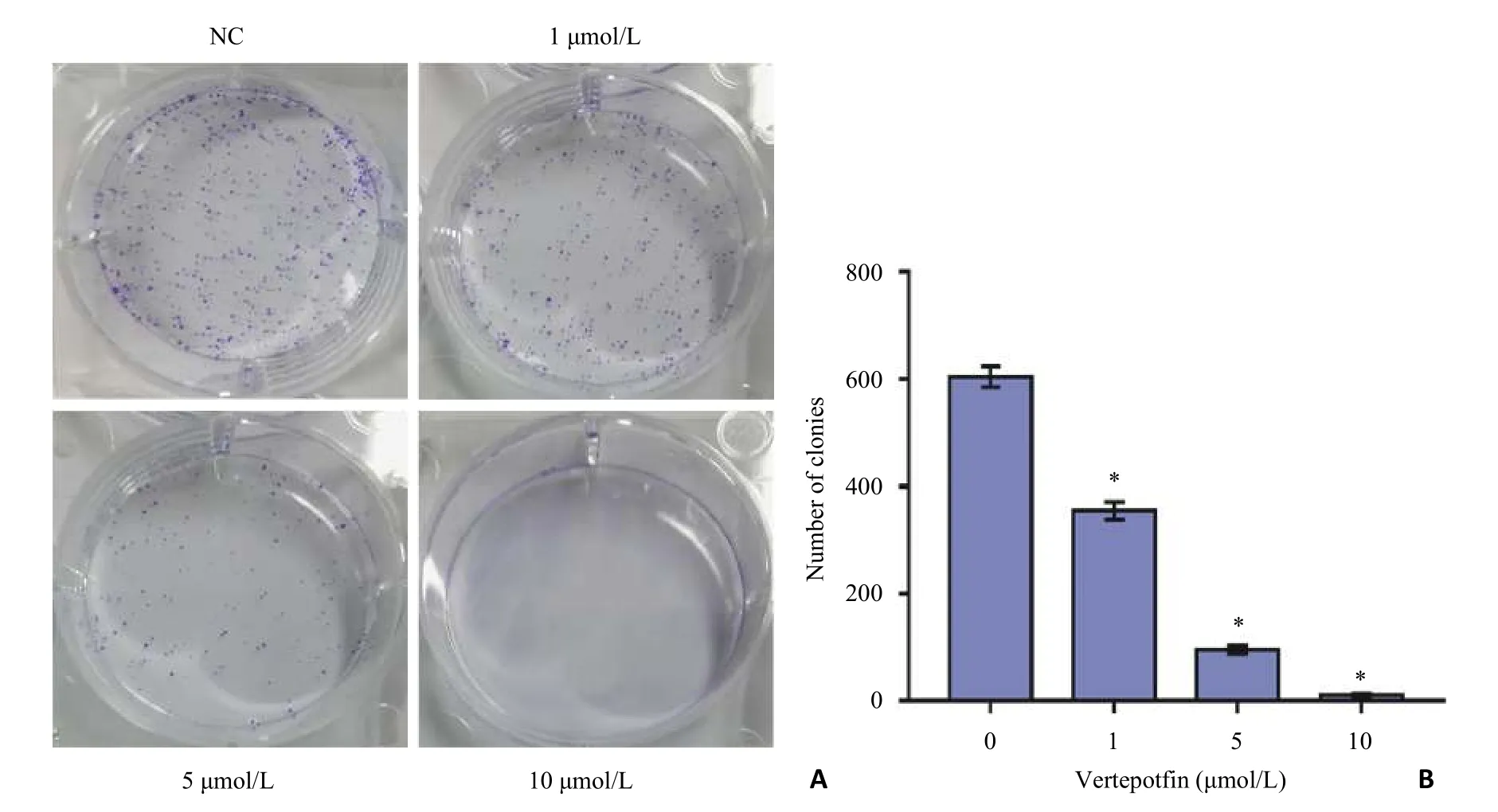
图3 不同浓度维替泊芬对对769-P细胞克隆形成能力的影响
2.6 实时荧光定量PCR
维替泊芬作用于肾癌769-P细胞后降低Bcl-2基因、YAP基因、TEAD基因及CyclinD1基因表达量,Bax基因、CDK4基因及Caspase-3基因的表达量上升(P<0.05,图4A)。
2.7 Western blotting
维替泊芬作用于肾癌769-P细胞后降低Bcl-2蛋白、YAP蛋白、TEAD蛋白及CyclinD1蛋白表达量,Bax蛋白、CDK4蛋白及Caspase-3蛋白的表达量增加(P<0.05,图4B)。

图4 维替泊芬对相关基因及蛋白表达的影响
3 讨论
目前,肾细胞癌的发生率逐年升提高,其发病率在泌尿生殖系统恶性肿瘤中排行第2位,仅次于膀胱癌,并且部分病人在初诊时已经出现癌细胞转移。目前肾癌的主要治疗方法为外科治疗,由于肾癌对放疗和化疗敏感性弱,促使科研工作者们致力于研究并探寻新的治疗肾癌药物[1-2]。维替泊芬是一种用于治疗老年黄斑相关疾病的光学增强剂,近年来多项研究发现维替泊芬可调节肿瘤相关基因及细胞信号通路从而抑制多种癌细胞增殖,具有治疗肝癌、前列腺癌、膀胱癌、卵巢癌及白血病等多种恶性肿瘤[10-17]。
本研究发现维替泊芬具有抑制肾癌769-P细胞增殖能力,并且抑制效率呈浓度依赖性。维替泊芬具有抑制肾癌细胞迁移及侵袭的能力。流式细胞术检测结果发现加大维替泊芬浓度,肾癌769-P细胞凋亡率呈浓度依赖性上升。荧光定量PCR及免疫印迹实验结果显示,维替泊芬作用于肾癌769-P细胞后导致Bcl-2的表达量降低,而Bax表达量增加,最终提升Bax/Bcl-2比率,激活caspase-3并增加其表达量。Bcl-2是一种抑制凋亡分子而Bax是一种促进凋亡的分子,两者都是重要的凋亡通路调节分子[18-19]。Caspase-3是一种剪切酶,在激活凋亡通路中发挥着非同凡响的作用。当细胞处于静息状态时,caspase-3以酶原形式定位于胞质中,处于一种非激活的状态。细胞凋亡信号通路一旦被激活,细胞质中的多种蛋白水解酶将对caspase-3进行裂解,使得caspase-3进一步活化[20]。维替泊芬通过Bax/Bcl-2诱导胰腺癌细胞凋亡,Bax/Bcl-2比例升高可活化PARP、caspase激酶活性,诱导肿瘤细胞凋亡的发生[21]。我们的研究结果同样显示维替泊芬可调节Bax/Bcl-2及caspase-3促进肾癌769-P细胞凋亡。
此外,本研究发现维替泊芬影响肾癌细胞生长周期,能将769-P细胞阻滞于G0/G1期,S期和G2/M期比例减少,抑制细胞增殖。荧光定量PCR及免疫印迹实验结果显示,经维替泊芬药物处理后肾癌769-P细胞的YAP、TEAD和CyclinD1蛋白表达量减少。研究发现在慢性粒细胞中,维替泊芬作用于癌细胞后可减少YAP及TEAD蛋白的表达,抑制YAP及TEAD蛋白的相互作用,进一步降低CyclinD1蛋白水平,阻滞癌细胞生长周期于G0/G1期,减少处于S期细胞数,降低癌细胞增殖率[22]。细胞周期蛋白依赖性激酶4简称CDK4,可促进细胞从G1期向S期转化[23],本研究发现维替泊芬可同时减少肾癌细胞的CyclinD1和CDK4表达量,抑制769-P细胞生长周期于G0/G1期,减少肾癌细胞的DNA合成量,进而抑制肾癌细胞生存能力。
综上所述,我们首次发现维替泊芬可抑制肾癌769-P细胞的生存、迁移及侵袭能力,阻滞癌细胞生长周期并促进细胞凋亡,为肾癌的治疗提供新方向及新选择。