白三烯受体拮抗剂(LTRA)对哮喘-慢阻肺重叠(ACO)患者气道炎症的影响及相关机制
刘美璇 张 倩 黄建浩 王凯玲 陶梦非 徐圣葆 郭忠良
(上海市东方医院呼吸内科 上海 200123)
支气管哮喘(哮喘)与慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是呼吸系统最常见的慢性气道炎症疾病。两种疾病可单独存在,但随着病程发展两者可出现相似的临床特性:如过敏倾向、持续性气流受限但有可逆性,吸入支气管扩张剂后症状明显缓解等[1]。2014年,全球哮喘防治倡议(GINA)及全球COPD防治倡议(GOLD)共同提议[2],将同时兼具哮喘和COPD这两种疾病特点的患者称为哮喘-慢阻肺重叠综合征(asthma-COPD overlap syndrome,ACOS)。2017年,GINA/GOLD再次更新修订[3-4],建议使用“哮喘-慢阻肺重叠(asthma-COPD overlap,ACO)”替代ACOS,认为ACO并不是单一的疾病实体,而是与哮喘、COPD一样,是由不同潜在机制所致的不同表型的气道疾病。与单纯哮喘或COPD相比,ACO患者的肺功能下降程度更快,急性加重次数更加频繁,住院率和病死率更高,严重影响了患者的生存质量[5-6]。因此,早期识别ACO并规范其诊治策略尤为重要。根据2017《GINA/GOLD指南》推荐,吸入糖皮质激素联合长效支气管扩张剂依然是治疗ACO的一线药物,具体用药剂量与病情严重程度相关。近年来,白三烯受体拮抗剂(leukotriene receptor antagonists,LTRAs)作为ACO的辅助用药逐渐引起重视。Talemura等[7]研究发现,LTRAs可通过减轻cys-LTs、LTD4等炎症介质而发挥抗气道炎症作用,在慢性咳嗽中具有重要的治疗价值,但LTRAs对ACO的临床疗效尚不明确。本研究旨在观察LTRAs对ACO临床症状、气道炎症、肺功能等方面的影响,并探讨其可能的作用机制。
资 料 和 方 法
研究对象纳入标准:(1)选取2016年10月至2017年5月在同济大学附属东方医院呼吸内科确诊的ACO患者83例,诊断依据符合2014年《GOLD指南》制定的关于ACO的标准;(2)入组前均未应用过任何LTRAs类药物治疗。排除标准:(1) 4 周内呼吸道感染者及全身感染者;(2)严重心肺疾病患者;(3)严重肝肾功能障碍;(4)妊娠或哺乳期妇女;(5)对研究药物过敏者。按随机数字法将所有ACO患者随机分为试验组(A组)44例及对照组(B组)39例,试验组给予孟鲁斯特(10 mg,qn)口服联合布地奈德/福莫特罗粉吸入剂(160 μg/4.5 μg,bid)吸入治疗,对照组给予布地奈德/福莫特罗粉吸入剂(160 μg/4.5 μg,bid)吸入治疗。两组患者分别治疗观察6个月,比较治疗前后症状评分(CAT评分、ACT评分)、诱导痰炎症细胞、FENO、肺功能参数等相应指标变化。选取同期我院体检中心的年龄、性别匹配的30例健康志愿者作为健康对照组(C组)。本研究通过东方医院伦理委员会审核,所有参加研究者均签署知情同意书。具体研究方案技术路线参见图1。
FeNO测定采用NIOX MINO仪器进行测定,操作过程严格按照ATS/ESR推荐的FeNO标准化测定指南进行[8]受试者于安静状态下进行检测,要求流速控制在50 mL/s,以×109ppb(parts per billion)为单位记录结果。
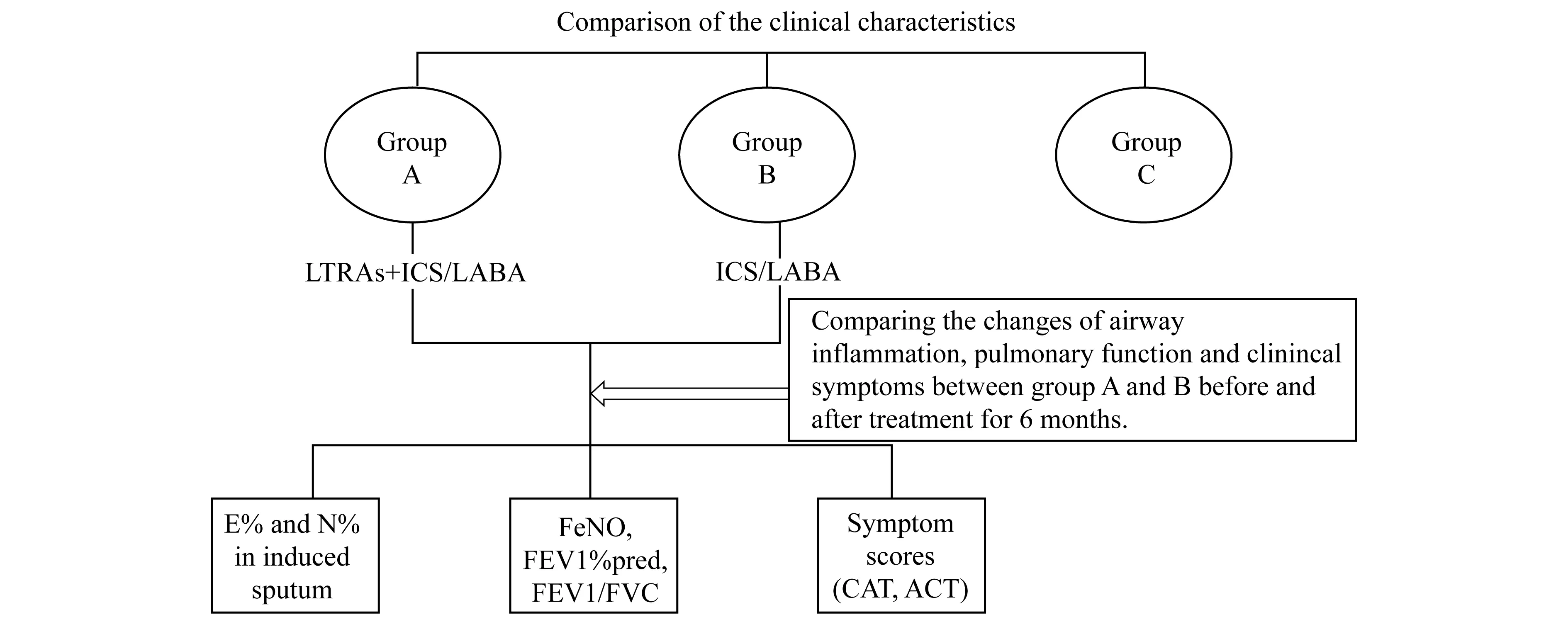
图1本研究方案的技术路线图
Fig1Theflowchartofthepresentstudyprotocol
肺功能测定应用Master Screen Body型肺功能仪(德国Jaeger公司)测定,具体操作方法和指标评估依据ATS标准[9],以FEV1%pred及FEV1/FVC作为主要评价指标。
诱导痰处理诱导前20 min先吸入400μg沙丁胺醇,利用浓度3%高渗盐水超声雾化吸入方法进行痰液诱导。收集下呼吸道的诱导痰标本并挑取其粘稠部分进行处理,在37 ℃水浴条件下利用0.1%二硫苏糖醇将标本溶解,震荡15 min,300目尼龙网过滤,常温750×g离心沉淀。细胞沉渣涂片采用HE染色法,高倍显微镜下分类计数400个细胞,记录痰嗜酸粒细胞、中性粒细胞百分比。每个痰标本的鳞状细胞比例<10%表示合格。

结 果
入选对象的基本临床资料所有研究对象全部完成试验,无中途退出或失访,整个研究过程无不良反应发生。与健康对照组相比,两组患者的吸烟比例、过敏特性、外周血IgE含量、诱导痰嗜酸粒细胞及中性粒细胞百分比显著升高(P<0.05),肺功能参数FEV1%pred及FEV1/FVC显著降低(P<0.05),3组间其他指标差异无统计学意义(表1)。

表1 3组研究对象基线资料比较Tab 1 Baseline clinical characteristics of all subjects ±s]
Group A:Patients treated with LTRAs and ICS/LABA;Group B:Patients treated with ICS/LABA;Group C:Healthy subjects.(1)vs.healthy subjects,P<0.05.
两组患者的CAT评分及ACT评分治疗前A、B两组患者的CAT评分及ACT评分差异无统计学意义,治疗后两组患者的CAT评分及ACT评分均有不同程度的改善(P<0.05),且试验组患者的改善程度优于治疗对照组(P<0.05,表2)。
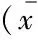
表2 两组患者治疗前后的CAT评分和ACT评分Tab 2 The CAT scores and ACT scores in the two ACO groups before and after treatment ±s)
(1)vs.before treatment,P<0.05;(2)vs.Group B after treatment,P<0.05.
两组患者诱导痰E%和N%的变化治疗前两组患者诱导痰E%和N%的含量较健康组明显升高(P<0.05,表1),但两组患者间差异无统计学意义。与治疗前相比,治疗后两组患者的E%和N%明显下降。A组:痰E%比较,5.21 (0.20~15.20)vs.1.75 (0.20~10.20),P<0.05;痰N%比较,73.05 (43.50~94.10)vs.66.30 (45.80~86.70),P<0.05。B组:痰E%比较,6.44 (0.50~19.40)vs.4.10(0.30~15.60),P<0.05;痰N%比较,74.30 (57.80~91.30)vs.70.40 (59.80~88.40),P<0.05。且与对照组相比,治疗后试验组的痰E%和N%的改善程度更显著(图2A、2B)。
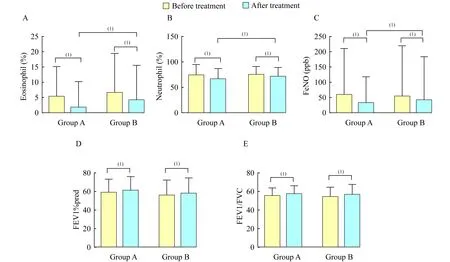
(1)P<0.05.
图2两组患者治疗前后诱导痰E%、N%、FEV1%pred、FEV1/FVC、FeNO比较
Fig2ThechangesofE%,N%ininducedsputum,FeNO,FEV1%predandFEV1/FVCinthetwogroupsbeforeandaftertreatment
两组患者的FeNO变化治疗前两组患者的FeNO含量较健康组明显升高(P<0.05,表1),但两组患者间差异无统计学意义,治疗后两组患者的FeNO水平较治疗前均有不同程度下降[58.67 (11.00~210.00)vs.32.17 (9.00~118.00),P<0.05;54.02 (7.00~219.00)vs.42.54 (9.00~183.00),P<0.05];且与治疗对照组相比,试验组患者的FeNO下降幅度更显著(P<0.05,图2C)。
两组患者的肺功能变化治疗前两组肺功能参数差异无统计学意义,治疗后两组的FEV1%pred及FEV1/FVC较治疗前皆有明显改善。A组治疗前后,FEV1%pred:58.53±14.99vs.61.19±4.72,P<0.05);FEV1/FVC:55.27±8.44vs.57.14±9.15,P<0.05。B组治疗前后,FEV1%pred:55.71±16.50vs.57.86±16.61,P<0.05;FEV1/FVC:54.10±10.63vs.55.85±11.56,P<0.05。治疗后两组间FEV1%pred、FEV1/FVC差异无统计学意义(图2D、2E)。
讨 论
ACO是以气流受限为特点的慢性气道疾病,临床表现方面兼具哮喘和COPD的部分特征[10]。据文献报道,15%~60%的哮喘/COPD患者中同时合并有ACO的表现[11]。尽管哮喘与COPD的炎症表型不尽相同,但两者的临床特性有诸多相似之处。哮喘的主要特征是以嗜酸粒细胞为主、多种细胞及细胞因子参与的Th2型炎症反应[12],COPD是以中性粒细胞为主要效应细胞的Th1型气道炎症疾病[13]。研究显示,一些长期暴露于环境污染或吸烟的哮喘群体可出现气道黏膜水肿、肺弹性回缩力减退以及持续性气流受阻等表现[14]。此外,25%~30%的COPD患者亦可出现呼吸道过敏症状及高IgE含量等哮喘样特点[15]。基于以上发现,目前针对ACO的潜在发病机制及相关炎症表型仍存在诸多争议;同时有关ACO诊断尚无统一标准,多依据患者的症状或肺功能检查结果作出临床判断。因此,评价气道炎症对于ACO的诊断及治疗方案的优化选择有重要的指导意义。
与既往研究结论一致[16],本研究中ACO患者治疗前的诱导痰嗜酸粒细胞、中性粒细胞等炎症指标的含量均显著高于健康者,证明ACO的发病机制与哮喘、COPD类似,是多种炎性效应细胞和炎性因子共同参与的气道炎症疾病。近年来关于LTRAs应用于CVA(咳嗽变异性哮喘)抗气道炎症的研究已有诸多报道[17]。Chen等[18]研究表明,LTRAs主要通过减少气道内白三烯等炎症介质的含量而发挥重要的抗哮喘作用,对于激素疗效不佳的哮喘群体,可作为一种补充性的治疗手段。Tingtinger等[19]发现,孟鲁斯特除了作为传统的CysLT1拮抗剂,还可以靶向作用于嗜酸粒细胞、肥大细胞甚至对激素不敏感的中性粒细胞,表明LTRAs具有广谱抗炎症因子的特性,并推测其对COPD治疗亦有重要意义。本研究中,经治疗干预,试验组的各项气道炎症指标的改善程度优于治疗对照组,进一步解释了LTRAs可明显减少ACO患者气道嗜酸粒细胞及中性粒细胞介导的免疫反应,抑制炎症因子的分泌和释放,并有可能强化ICS的抗炎症作用,进而改善患者呼吸困难情况和体力状态,获得临床收益。证明LTRAs在减轻ACO气道炎症方面具有重要价值。
Essat等[20]研究发现FeNO值与ACO的气道嗜酸粒细胞性炎症程度具有相关性,Tamada等[21]提出以FeNO>35 ppb对ACO的鉴别诊断有较高的敏感度和特异性。本研究选择FeNO作为监测患者气道炎症的无创炎性标记物,结果显示:与健康组相比,ACO患者的FeNO和IgE基线值较高,这与以往研究结果一致[22],分别反映了ACO患者的哮喘样气道炎症及过敏特征。与治疗对照组相比,试验组的FeNO下降更显著,再次证实LTRAs在抑制ACO气道嗜酸粒细胞性炎症的重要地位。值得注意的是,ACO群体中FeNO水平和LTRAs疗效是否相关,目前尚不清楚,关于FeNO对LTRAs疗效的预测价值还需要后续研究。
肺功能方面,本研究中ACO患者的FEV1%pred基线均值在55%左右,说明大部分患者的肺功能已存在中度以上通气障碍,提示气道重塑是ACO潜在的病理生理机制。6个月治疗后ACO患者的肺功能较前皆有改善,但治疗后两组间肺功能并无明显统计学差异。我们分析有如下两个原因:(1)ACO患者有过敏倾向,其气流受限有可逆性特点,激素敏感性较好,故ICS/LABA治疗可明显减轻ACO的气道高反应性,提高肺通气功能。(2)LTRAs主要影响嗜酸粒细胞、中性粒细胞等效应细胞而降低气道cysLTs、IL-5、IL-8等炎症介质的分泌;但ACO患者年龄多在40岁以上,病程往往更长,由于气道平滑肌增生、管壁增厚、黏液分泌增多等因素引起气道重塑[23],导致中重度通气障碍,故短期LTRAs治疗仅能改善气道炎症,而对肺功能的影响不大。
本研究初步探讨了LTRAs对ACO气道炎症的影响及可能作用机制,肯定了LTRAs在管理ACO炎症方面的作用。由于治疗观察时间较短,对肺功能的改善仍缺乏有力证据,因此临床获益的研究需要更长时间随访。本研究主要检测了ACO气道炎症效应细胞的变化,关于下游炎症细胞因子及相关通路的基础研究并未涉及,LTRAs在ACO中的抗气道炎症机制仍有待于进一步研究。

