载脂蛋白A5 (ApoA5)经CIDEC负向调控人脂肪间充质干细胞(AMSC)成脂分化
孔 一 苏 欣 郑小燕
(1中南大学湘雅二医院皮肤与性病科,2心血管内科 长沙 410012)
多项研究已明确肥胖与动脉粥样硬化密切相关[1]。肥胖是脂肪细胞肥大和增生共同作用的结果,过多能量摄入可诱导脂肪组织中存在的脂肪间充质干细胞(adipose mesenchymal stem cell,AMSC)分化为成熟脂肪细胞,加重肥胖发生发展[2]。诱导细胞死亡的DFF45样效应因子C (cell death-inducing DNA fragmentation factor 45-like effector C,CIDEC)属CIDE家族成员,研究发现沉默CIDEC基因可使AMSC丧失成脂分化能力[3-4]。而相关机制研究表明:CIDEC通过作用于AMSC成脂分化早期关键调控因子CCAAT/增强子结合蛋白β(CCAAT/enhancer binding protein beta,C/EBPβ),促进后者表达,启动脂肪细胞特异性基因表达,最终完成AMSC向成熟脂肪细胞转变[5]。
载脂蛋白A5(apolipoprotein A5,ApoA5)是2001年新发现的一种载脂蛋白,也是三酰甘油(triglyceride,TG)代谢的重要调控因子。我们前期研究发现肥胖患者血浆ApoA5蛋白质水平降低与体重指数(body mass index,BMI)呈负相关[6],提示ApoA5可能参与肥胖的病理生理过程。ApoA5进入成熟脂肪细胞后,可显著下调CIDEC蛋白质水平,同时降低细胞内TG含量[7]。结合前期研究结果,我们提出假说:ApoA5通过下调CIDEC表达,继而影响C/EBPβ激活,从而抑制AMSC成脂分化。
材 料 和 方 法
组织来源经中南大学湘雅二医院伦理委员会批准[(2013)伦审第(研067)号]及患者知情同意后,获取进行腹部外科手术患者的皮下组织。所选患者平均年龄为(40.6±13.6)岁,男女比例∶1,平均BMI为(21.4±7.6)kg/m2,均无糖尿病及严重的系统性疾病。
材料来源DMEM/F12培养基、胎牛血清、Ⅰ型胶原酶、0.25%胰蛋白酶溶液等试剂购于美国Gibco公司;促分化试剂、ApoA5一抗、CIDEC一抗等抗体购于美国Sigma公司;人ApoA5蛋白质购于湖南远泰生物有限公司;PCR引物合成试剂盒、油红O吸光度检测试剂盒、TG定量检测试剂盒等购于上海碧云天生物技术有限公司。
人AMSC分离、培养及诱导成脂分化于超净工作台中用眼科剪剔除脂肪组织中肉眼可见的血管和结缔组织,并用PBS液反复冲洗,移入小玻璃瓶中,加入等体积的0.1% Ⅰ 型胶原酶,摇匀后于37 ℃、5%CO2培养箱中消化30 min,随后移入15 mL离心管,1 500×g离心10 min,弃去悬浮组织,沉淀即为AMSC。以含10%胎牛血清的DMEM/F12培养基培养,待细胞生长至80%汇合后进行传代。选择生长良好的第3代细胞接种于6孔板中继续培养。待生长至完全汇合时,以含胰岛素(10 μg/mL)、地塞米松(1 μmol/L)、IBMX (0.5 mmol/L)的诱导剂诱导细胞分化。
细胞干预及收获将同一6孔板的细胞分为实验组(3孔)和对照组(3孔),实验组于诱导开始时加入600、1 200 ng/mL ApoA5进行干预,直至第14天;对照组不加ApoA5。分别于诱导第7、14天收获细胞。
分光光度计测定细胞内油红O吸光度及TG含量将细胞按油红O染色试剂盒处理后,测量492 nm处的吸光度(D)值,计算油红O吸光度;用TG定量检测试剂盒处理后,测定D570值,计算TG水平。
Real-timePCR检测成脂分化标志物mRNA表达水平分别制备实验组和对照组的细胞总RNA,按照逆转录试剂盒逆转录合成cDNA,并分别合成成脂分化标志物基因aP2和FAS的引物。配制PCR反应体系,用ABI PRISM 7300软件进行实时荧光定量PCR并分析结果,记录各基因扩增Ct值。
激光共聚焦观察ApoA5与CIDEC的共定位现象诱导AMSC成脂分化,用Alexa Fluor 488荧光染料标记ApoA5 (ApoA5-488),将ApoA5-488与促分化14天细胞于37 ℃孵育4 h,PBS洗涤3遍,4%多聚甲醛固定细胞,进行免疫荧光检测:加入CIDEC一抗孵育后,再加入相应的荧光二抗,利用激光共聚焦成像系统观察ApoA5在AMSC内的分布情况以及与CIDEC是否存在共定位的现象。
Westernblot检测CIDEC与C/EBPβ蛋白质水平取50 μg各组细胞总蛋白质,6%不连续SDS-聚丙烯酰胺凝胶电泳进行分离,60 V恒压电流下转移4 h,电转移至PVDF膜。将PVDF膜转移至含有封闭液的平皿中,室温下脱色摇床上摇动1 h。将不同的一抗(鼠抗人ApoA5、CIDEC、C/EBPβ等)用含5% BSA的PBST稀释至适当浓度(∶1 000~∶5 000)。从封闭液中取出PVDF膜,室温下将PVDF膜于稀释的一抗中脱色,摇床上漂洗。将辣根过氧化物酶标记的二抗(兔抗鼠)稀释至∶1 000,室温下将PVDF膜于稀释的二抗中孵育2 h,回收二抗,室温下用PBST漂洗。用DAB显色法于膜上显色。将定影后的胶片采用凝胶成像系统扫描分析结果,通过Quantity ONE图像分析软件进行灰度值分析。将所测得各目的蛋白条带灰度值与内参蛋白(β-actin)条带灰度值的比值作为该蛋白的相对表达量。
结 果
ApoA5对AMSC成脂分化的影响通过分光光度计检测油红O吸光度(图1)。干预至第7天,600和1 200 ng/mL ApoA5干预的细胞油红O吸光度与对照组相比,分别下降17%和20% (P<0.05);干预至14天,600和1 200 ng/mL ApoA5干预的细胞油红O吸光度与对照组相比,分别下降22%和37% (P<0.05)。

ApoA5 could decrease the oil red O absorbance in a dose-dependence manner.(1)vs.the control group,P<0.05.
图1分光光度法检测油红O吸光度
Fig1TheoilredOabsorbancedetectedby
spectrophotometricmethod
ApoA5对AMSC中TG含量的影响通过TG定量检测试剂盒检测ApoA5干预后细胞内TG含量变化(图2)。干预至第7天,600和1 200 ng/mL ApoA5使TG含量降低达26%和54% (P<0.05);干预至14天,降低达38%和57% (P<0.05)。
ApoA5对脂肪酸结合蛋白基因(aP2)及脂肪酸合酶基因(FAS)mRNA表达水平的影响通过real-time PCR检测发现,干预至第7天,600和1 200 ng/mL ApoA5使aP2 mRNA水平降低达21%和41% (P<0.05);干预至第14天,降低达34%和52%(P<0.05,图3);干预至第7天,600和1 200 ng/mL ApoA5使FASmRNA水平降低达23%和42% (P<0.05);干预至第14天,降低达39%和52%(P<0.05,图4)。

ApoA5 could decrease the intracellular TG concentration in a dose-dependence manner.(1)vs.the control group,P<0.05.
图2分光光度法检测细胞内TG含量
Fig2TGconcentrationdetectedby
spectrophotometricmethod
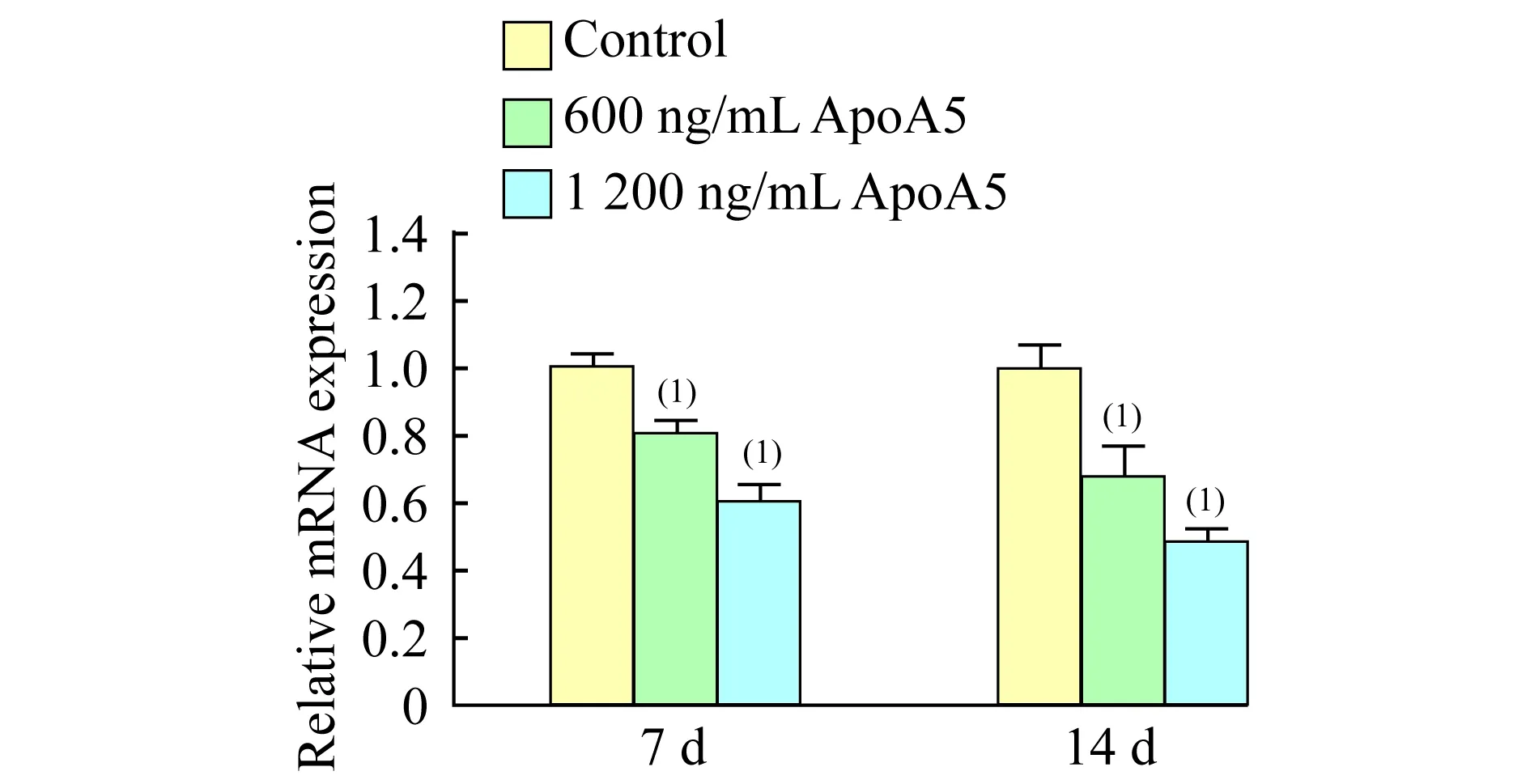
ApoA5 could decrease the intracellular mRNA expression level ofaP2 in a dose-dependence manner.(1)vs.the control group,P<0.05.
图3real-timePCR检测细胞内aP2基因表达水平
Fig3TheintracellularmRNAexpressionlevelof
aP2detectedbyreal-timePCR

ApoA5 could decrease the intracellular mRNA expression level ofFASin a dose-dependence manner.(1)vs.the control group,P<0.05.
图4real-timePCR检测细胞内FAS基因表达水平
Fig4TheintracellularmRNAexpressionlevelof
FASdetectedbyreal-timePCR
激光共聚焦观察ApoA5与CIDEC共定位情况通过激光共聚焦显微镜观察发现:脂肪细胞内ApoA5-488 (绿色荧光)与CIDEC (红色荧光)分布一致,说明ApoA5和CIDEC共定位于脂肪细胞脂滴表面(图5)。
ApoA5对CIDECmRNA和蛋白质水平的影响通过real-time PCR检测发现(图6),干预至第7天,600和1 200 ng/mL ApoA5使CIDECmRNA表达水平降低达25%和51% (P<0.05);干预至第14天,降低达32%和60% (P<0.05)。通过Western blot检测及Quantity ONE图像分析软件进行灰度值分析发现,ApoA5可显著降低CIDEC蛋白质水平,降低程度与ApoA5浓度呈正相关(图7)。

ApoA5 CIDEC Merge ApoA5 and the red fluorescence CIDEC,which stimulated the green fluorescence,were located on the surface of the lipid droplets,and the yellow fluorescence appeared after fusion,indicating that ApoA5 and CIDEC were distributed within the cells.
图5激光共聚焦显微镜观察CIDEC在脂肪细胞内的定位
Fig5ThelocalizationofCIDECinadiposecellsobservedbylaserconfocalmicroscope
ApoA5对C/EBPβmRNA和蛋白质水平的影响通过real-time PCR检测发现,干预至第7天,600和1 200 ng/mL ApoA5使C/EBPβmRNA表达水平降低达23%和50% (P<0.05);干预至第14天,降低达43%和64% (P<0.05,图8)。通过Western blot检测及Quantity ONE图像分析软件进行灰度值分析发现,ApoA5可显著降低C/EBPβ蛋白质水平,降低程度与ApoA5浓度呈正相关(图9)。

ApoA5 could decrease the intracellular mRNA expression level ofCIDECin a dose-dependence manner.(1)vs. the control group,P<0.05.
图6real-timePCR检测细胞内CIDEC基因表达水平
Fig6TheintracellularmRNAexpressionlevelof
CIDECdetectedbyreal-timePCR
讨 论
ApoA5蛋白是TG代谢的调控因子[6]。缺乏ApoA5蛋白质将导致血浆中TG浓度升高,ApoA5蛋白质可降低血浆TG浓度,且ApoA5还参与调节细胞内TG的代谢[7];FAS蛋白质是生物体内源性脂肪合成过程的关键酶,动物实验发现,体内缺乏FAS基因的小鼠明显更能抵制肥胖[8];aP2蛋白质能协助将动物组织细胞内的脂肪酸运至TG合成部位,从而促进脂肪细胞中TG沉积,因此上述基因表达水平能反映AMSC成脂分化程度[9]。与之一致的是,本实验观察到ApoA5可降低人AMSC成脂分化过程中脂滴油红O吸光度、TG含量,并能显著降低成脂分化指标FAS和aP2的mRNA表达水平,因此我们认为ApoA5可抑制AMSC成脂分化。

A:Western blot detected the protein level of CIDEC;B:Quantity ONE image analysis software analyzed the gray value of strip.(1)vs.the control group,P<0.05.
图7ApoA5对脂肪细胞CIDEC蛋白表达的影响
Fig7TheeffectofApoA5onintracellularproteinexpressionlevelofCIDEC

ApoA5 could decrease the intracellular mRNA expression level ofC/EBPβin a dose-dependence manner.(1)vs.the control group,P<0.05.
图8real-timePCR检测细胞内C/EBPβ基因表达水平
Fig8TheintracellularmRNAexpressionlevelof
C/EBPβdetectedbyreal-timePCR
CIDEC蛋白质(在小鼠称为FSP27)是一种新的脂滴相关蛋白质。动物研究发现,FSP27基因敲除小鼠能抵制高脂饮食诱导的肥胖,来源于这种小鼠的脂肪细胞内TG含量显著减少[10]。体外实验中将脂肪细胞CIDEC基因敲除后,脂肪细胞在基础和刺激状态下的脂解活性显著增强,细胞内TG含量下降[11]。上述改变提示:CIDEC/FSP27基因功能缺失的脂肪细胞部分表型发生了由能量储存向能量消耗的转化,同时并不增加其他组织的脂质负荷。本研究发现,ApoA5可呈剂量依赖性降低细胞内CIDEC mRNA和蛋白质水平,下调转录因子C/EBPβmRNA表达,从而发挥抑制AMSC成脂分化的作用。结合前期研究结果,我们推测:ApoA5通过下调CIDEC的表达,从而抑制脂肪细胞增生与肥大。

A:Western blot detected the protein level of C/EBPβ;B:Quantity ONE image analysis software analyzed the gray value of strip.(1)vs.the control group,P<0.05.
图9ApoA5对脂肪细胞C/EBPβ蛋白表达的影响
Fig9TheeffectofApoA5onintracellularproteinexpressionlevelofC/EBPβ
对于ApoA5下调CIDEC mRNA及蛋白质水平的机制,目前已有分析显示:小鼠FSP27基因5’端上游存在转录调节因子的结合位点,如C/EBP、PPAR和SREBP-1等。当上述转录因子与FSP27 mRNA结合之后,可促进后者表达[12]。因此,人CIDECmRNA可能也受上述因子转录调节。前文提到,CIDEC进入细胞核之后,将促进C/EBPβmRNA的表达,而后者又可促进CIDECmRNA表达。由此推测,ApoA5可能通过抑制这条正反馈的调节通路来降低CIDEC表达。以上推测需要进一步研究来证实。
本研究验证了ApoA5能够抑制AMSC成脂分化过程中TG含量,下调成脂分化相关因子aP2和FASmRNA表达水平,说明ApoA5具有抑制AMSC成脂分化的作用。ApoA5呈环状围绕在脂滴周围,与CIDEC共同定位于脂滴表面;在成脂分化过程中,ApoA5可下调CIDEC mRNA及蛋白质水平,抑制CIDEC下游C/EBPβ等成脂分化早期关键因子的mRNA表达,从而抑制AMSC成脂分化。

