传统发酵食品微生物学研究进展
王慧琳, 周炜城, 任 聪,3, 徐 岩,2,3
(1. 江南大学 生物工程学院 酿酒微生物与应用酶学研究室, 无锡 214122;2. 江南大学 食品科学与技术国家重点实验室, 无锡 214122;3. 江南大学 教育部工业生物技术重点实验室, 无锡 214122)
传统发酵食品技艺是一类用于食品保存和食品风味增强的食品加工技术,其历史久远。传统发酵食品的生产多采用自然接种,生产过程中涉及的微生物种类繁多,在分子微生物生态学技术出现之前,人们严重低估了传统发酵食品生产过程中的微生物种类及其代谢产物多样性。近年来,研究者使用基于16s rRNA/ITS的扩增子测序技术,不断解析发酵食品生产过程中微生物菌群的群落结构及其动态变化规律[1];使用宏基因组、宏转录组测序技术,揭示发酵过程的核心功能微生物[2]以及微生物互作机理[3]。
1 传统发酵食品微生物组的基本特征
人们对传统发酵食品微生物组的认识过程是一个由解析微生物结构到逐渐明晰微生物功能的过程,并逐渐总结出传统发酵食品微生物组具有微生物种类繁多、功能多样、微生物之间相互作用复杂的基本特征。在此基础上,深入认识复杂的传统发酵食品微生物组还需要阐明众多参与发酵微生物中的核心功能微生物,建立微生物种类与功能的联系以及微生物相互作用与发酵进程的联系。
1.1 传统发酵食品制造过程中的微生物种类与功能
传统发酵食品多通过自然接种或辅以微生物强化的自然接种,发酵过程由多种微生物共同作用完成。过去主要通过传统的可培养手段认识微生物,该方法具有较大的局限性,耗时费力且只能检测到有限的微生物种类,不能反映发酵体系真实的微生物组成。而近十年来,随着PCR-DGGE技术和高通量测序技术为基础的现代分子微生物生态学技术的广泛使用,人们对传统发酵食品制造过程中微生物种类和微生物演替的认识发生了质的飞跃(表1)。
传统发酵食品中微生物的重要功能之一是产风味物质或风味前体物质,这类产风味物质的功能微生物赋予传统发酵食品风味多元的特点。过去的研究往往集中于解析传统发酵食品发酵过程的微生物组成结构,或探究传统发酵食品中风味物质的种类,而缺少对产风味物质功能微生物的系统研究。近年来,将高通量测序技术与多元统计的分析方法相结合,已有越来越多的研究将微生物与传统发酵食品风味真正地联系起来。微生物与风味物质的关联分析将有助于鉴定发酵食品体系中的核心功能微生物。Wang等通过使用O2PLS(Bidirectional orthogonal partial least squares,双向正交偏最小二乘法:将不同分析平台产生数据集进行统计分析用来揭示数据间的潜在关系)方法,将食醋发酵0~18 d微生物群落结构与风味化合物的数据进行整合,鉴定出7个属的细菌为核心功能微生物,揭示细菌而非真菌,是食醋风味的主要贡献者[4]。
目前在传统发酵食品领域,将不同组学平台产生的数据进行整合分析的报道还较少。随着测序成本的逐渐降低和测序精度的不断提升,大量、精确数据的获得将不再成为限制研究的门槛。研究者更多需要解决的问题是,如何根据生物学问题对海量的数据进行深入而有效分析,以完全剖析酿造体系中微生物的种类与功能,如近年来统计学方法在传统酿造的产风味微生物解析中发挥了巨大的作用。通过将微生物与风味物质相关联,还有利于规避凭借微生物相对丰度高低判定其在发酵过程中重要性大小的错误。过去的研究认为,芽孢杆菌属与肠球菌属的微生物是韩国大酱主要的发酵微生物,但是Jung等通过研究大酱发酵全过程的微生物组成以及代谢物变化,发现虽然芽孢杆菌属与肠球菌属的微生物是整个发酵过程的优势微生物,但是其丰度变化与代谢产物变化不具有一致性。研究者发现,伴随着四联球菌属微生物丰度的上升,发酵体系中葡萄糖、果糖快速消耗,乳酸、乙酸等风味物质大量产生;伴随着乳酸菌属微生物丰度的上升,发酵体系中γ-氨基丁酸含量上升,故实际参与大酱发酵的功能微生物是四联球菌属与乳酸菌属的微生物[5]。
扩增子测序多用于分析微生物菌群的组成结构,而对于微生物代谢功能的研究,则需要借助宏基因组和宏转录组学技术。宏基因组学技术与宏转录组学技术在解析传统发酵食品微生物菌群功能方面各有所长,宏基因组学能对发酵体系中的微生物暗物质[6](未培养微生物)潜在代谢功能进行研究,如对大曲和窖泥中的未培养微生物进行研究,还可以鉴定发酵体系中的核心微生物及其潜在代谢特征。宏转录组学则可以区分出代谢活跃的微生物及其活跃的代谢途径。Jung等分析韩国泡菜发酵过程中微生物的全局基因表达,发现泡菜不同发酵阶段由不同微生物主导:明串珠菌属微生物Lc.Mesenteroides是发酵前期的活跃微生物,而魏斯氏菌属微生物W.koreensis以及清酒乳杆菌(Lb.sakei)是发酵后期的活跃微生物[7]。宏转录组测序结合对发酵进程的跟踪,还可以进一步阐明不同发酵阶段的主要功能微生物及其在发酵过程中发挥的作用。宋哲玮等通过对酱香型白酒发酵体系酵母(Pichia:毕赤酵母属,Schizosaccharomyces:裂殖酵母属,Saccharomyces:酵母属,Zygosaccharomyces:接合酵母属),以及乳酸菌属微生物的丙酮酸代谢途径进行分析,揭示核心功能微生物裂殖酵母属与乳酸菌属微生物在发酵的不同阶段进行功能转换,进而驱动了发酵过程由产生醇类(乙醇)至产生酸类(乳酸)的转变[2]。宏转录组学的应用使我们对发酵体系的了解不仅局限于微生物的种类与丰度,还扩展到微生物的功能与互作关系,从而对传统发酵食品发酵过程的认识实现了从静态到动态的转变。但由于传统发酵食品基质复杂,提取完整的RNA极具挑战,这限制了宏转录组学技术的广泛应用。除宏基因组学和宏转录组学技术外,宏蛋白组学[8]也逐渐应用于传统发酵食品微生物菌群的功能研究,但该项技术应用的主要挑战在于目前尚缺少针对传统发酵食品体系微生物的蛋白质质谱数据库,尤其是对于未培养微生物的蛋白质难以进行准确鉴定。总体而言,综合应用多组学技术,结合可靠的统计分析方法仍然是阐明传统发酵食品微生物群落功能的有力手段。
1.2 微生物相互作用在传统发酵食品制造中的重要作用
传统发酵食品制作过程中,多种微生物相互作用(协同、竞争、共生等),在同一发酵体系中,微生物群落发生有序演替。解析传统发酵食品微生物的相互作用,将有助于:1)深入理解群落演替规律,解析发酵机理;2)探明风味物质来源;3)通过微生物相互作用,抑制有害微生物的生长或有害代谢物的产生,保障传统发酵食品的安全性。
微生物种群演替究竟是由环境条件改变引起,还是由微生物相互作用引起,抑或是二者综合作用的结果?Kastman等从环境因素与生物因素两个角度,对奶酪皮上葡萄球菌属微生物生态分布规律进行研究,为解决这一问题提供了可参考的方法。研究人员发现较晚定殖在奶酪皮上并最终成为奶酪皮上优势菌株的马胃葡萄球菌(Staphylococcusequorum)在体外培养时却具有最弱的竞争力。为解释这一矛盾的现象,研究人员首先分别对3种葡萄球菌的生态位进行调查,而后用共培养方法验证了在统计学上具有显著相关性的葡萄球菌与霉菌的相互作用关系,最终确定是帚霉(Scopulariopsis)促进马胃葡萄球菌的生长。通过比较转录组分析揭示,这种促进作用可能是通过帚霉产生的铁载体蛋白,从而减轻马胃葡萄球菌自身合成铁载体的负担或直接为马胃葡萄球菌提供铁源促进其生长实现的。该项研究结果表明,奶酪皮上的葡萄球菌属微生物的演替主要由生物因素驱动,在生产上,可以通过强化特定霉菌促进有益葡萄球菌生长,从而抑制奶酪生产中潜在病原菌的繁殖[3]。

表1 传统发酵食品微生物组成与功能研究进展
传统发酵食品具有的独特风味是其深受消费者喜爱的重要原因,纯培养菌株的生理代谢特征研究不足以解释传统发酵食品中所有风味物质的来源,微生物相互作用可以增加风味物质产量或合成单一微生物难以合成的风味化合物。以白酒为例,酵母菌与乳酸菌是涉及白酒硫化物代谢的核心微生物,乳酸菌可以为酵母菌提供合成3-甲硫基-1-丙醇和二甲基二硫的前体物质甲硫氨酸,相比单培养,酵母菌与乳酸菌之间的协同作用极大地提高了酵母菌产3-甲硫基-1-丙醇和二甲基二硫的能力,增强了白酒的风味[32]。
除了增强有益风味,设法减少传统发酵食品中的异嗅物质、抑制有害物质生成也是人们一直以来关注的焦点。出于食品安全的角度,可以利用微生物相互作用,抑制产异嗅物质或有害物质的微生物,来达到优化传统发酵食品品质的目的。链霉菌产生的土味素是清香型白酒中的典型异嗅物质,采用芽孢杆菌(Bacillussubtilis2-16 以及Bacillusamyloliquefaciens1-45)能够有效抑制土味素产生菌株Streptomycessampsonii的生长,将这两株芽孢杆菌添加至发酵体系中,土味素的去除率分别可达45%与15%[33-34]。由此可见,不断加深对传统发酵食品微生物相互作用关系的认识,有助于从发酵源头增强风味物质生成或控制不良风味物质的产生。
2 传统发酵食品中的微生物资源
国内外已经有许多研究致力于分离传统发酵食品中具有抗菌、益生等功能的菌株(表2)。
一些分离自传统发酵食品的菌株在其他生物技术领域也具有较好的应用价值。例如,从纳豆中分离出的Bacillussubtilisnatto CCT7712菌株产生的果聚糖蔗糖酶可用于生产低聚果糖与果聚糖[35];从窖泥中分离出的ClostridiumkluyveriN6具有高效利用乙醇生产高值化学品己酸的能力[36];从窖泥中分离出的ClostridiumBEY8,Ruminococcaceaebacterium CPB6具有转化废水中乳酸生产丁酸、己酸的能力[37-38];从高温大曲中分离得到的BacillusamyloliquefaciensMT45与X82共培养可以发酵废酒糟生产表面活性剂[39]。
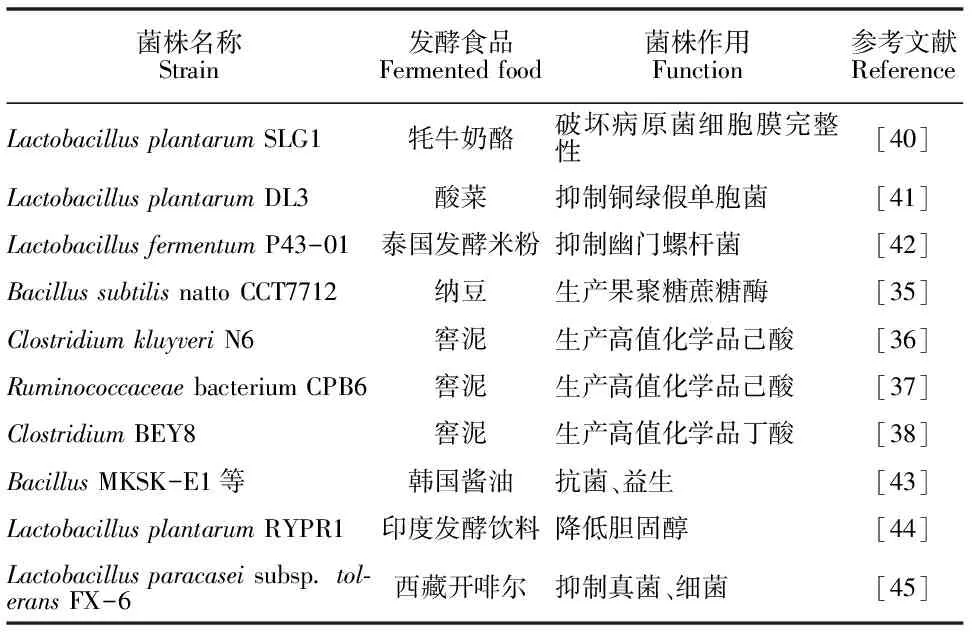
表2 从传统发酵食品体系中分离到的功能菌株
3 传统发酵食品的质量监控及品质优化
传统食品从原料到最终产品的转化主要由发酵过程中的微生物驱动,生产多采用开放式接种方式、发酵过程较长,因此,及时、准确的监控发酵进程对于保障传统发酵食品的安全与品质显得尤为重要。
3.1 传统发酵食品全过程的微生物监控
自然接种的发酵食品微生物来源广泛,生产环境、生产工具以及操作过程带入的微生物可能共同参与了发酵过程。为了保证发酵的正常进行,就需要明晰参与发酵的微生物的主要来源以及对发酵过程进行实时、准确的监控。
生产场所小环境是发酵食品微生物的主要来源之一。Bokulich等研究奶酪与清酒生产相关微生物时均发现,发酵基质中主要的发酵微生物主要来源于生产环境[46-47],王雪山等也揭示在清香型白酒酿造过程中,环境微生物群落是发酵微生物的重要来源,并且驱动了白酒发酵过程的微生物演替以及代谢特征改变[48]。
3.2 传统发酵食品的安全性保障与品质优化
传统发酵食品采用自然接种的方式进行生产,在生产过程中容易受到外源杂菌的污染。
目前,已有较多利用微生物方法来控制发酵食品中有害物质生成的例证。传统发酵豆制品,如豆酱、酱油等在制曲过程中难免会受到黄曲霉毒素的污染(发酵过程污染杂菌或通过原料带入),Li等从酱油醪中筛选得到一株耐高盐酵母CandidaversatilisCGMCC 3790,该酵母可以通过生物降解途径有效去除黄曲霉毒素,在实际体系中黄曲霉毒素去除率超过41.24%[49]。氨基甲酸乙酯(EC,Ethyl carbamate)是酱油、葡萄酒、黄酒、白酒等国内外发酵食品中普遍存在的一种具有潜在致癌风险的物质[50],控制发酵食品中EC含量的方法包括控制EC合成前体(尿素、精氨酸)或直接利用EC降解微生物将EC进行降解。杜海等研究发现,乳酸菌具有与酵母竞争利用精氨酸的能力以及降解尿素的能力;一些非常规酵母(毕赤酵母、裂殖酵母、接合酵母)与酿酒酵母相比,合成尿素能力更弱,且降解尿素的效率更高[51]。这些研究结果指导我们在白酒固态发酵中,可以使用乳酸菌与非常规酵母来控制EC的产生。崔凯翔等利用生物降解的方式在自然发酵体系中减少EC含量,LysinibacillussphaericusMT33菌株对于EC以及尿素的降解具有良好的作用,实验室条件下将该菌株接种至白酒液态发酵体系,发酵终点体系中EC和尿素含量分别下降41.77%和28.15%,成品酒中EC的浓度下降了63.32%[52]。以上的研究结果表明,利用微生物自身代谢特点对发酵食品中有害物质进行控制是一种安全且行之有效的方法。
4 展望
一般而言,部分传统发酵食品优质品率较低,对其生产过程进行现代化改造是保证传统发酵食品质量更优、生产效率更高的关键。但是如何在实现工业化生产、提高生产效率的同时,不改变发酵食品本身丰富的风味一直是困扰人们的难题。日本酱油使用多菌种纯种微生物混合发酵进行酿造,是传统发酵食品工业化成功的典型例证。同样是混合发酵,我国麸曲白酒的品质明显不及大曲白酒。可见,对于不同的传统发酵食品而言,一味地对发酵菌种进行精简,并非完美的解决方案。
人为配比添加的复合菌种发酵食品往往无法达到自然接种发酵食品的品质,这也是其他具有复杂微生物组成的传统发酵食品面临的问题。解决这一问题就需要我们继续深入对传统发酵食品微生物组进行审视:1)综合运用多组学技术对传统发酵食品微生物的基因多样性、代谢特征多样性进行全面探查,并建立成熟的传统发酵食品微生物组分析方法。2)更加注重生物因素对发酵食品微生物菌群组装、演替的影响。只有加深对传统发酵食品中微生物相互作用的认识,才能科学的添加/强化特定微生物,减轻异嗅物质对发酵食品风味的影响、增强传统发酵食品的营养保健功能。3)建立适合于传统发酵食品的可培养技术手段。发酵食品体系特殊的环境条件驯化出较自然生境中性状更为优良的菌株,但是由于目前可培养技术的局限,许多潜在功能菌株还不能实现分离培养,应用新的技术手段已经实现对海洋、土壤、肠道中许多不可培养微生物的可培养,通过对这些技术的学习借鉴,有助于深入挖掘传统发酵食品的菌种资源。

