果糖基转移酶在大肠杆菌中的重组表达及酶学性质
宋春丽, 杨海泉, 马道程, 许菲
(1. 糖化学与生物技术教育部重点实验室 江南大学 生物工程学院, 无锡 214122; 2. 工业生物技术教育部重点实验室 江南大学 生物工程学院, 无锡 214122)
低聚果糖(Fructooligosaccharides)通常是由一个葡萄糖分子和几个果糖单元组成的寡聚物[1]。在肠道中,低聚果糖可选择性刺激肠道益生菌乳酸杆菌和双歧杆菌的生长,具有调节肠道生态系统的作用。低聚果糖可改善高脂血症中的血脂组成,降低血清中的胆固醇水平,且增加Ca2+和Mg2+等矿物质的吸收[2]。除了调节肠道生态系统的益生元作用,低聚果糖还可通过直接或间接的ROS清除机制抵消氧化应激,防止结肠癌等ROS相关疾病的发展[3-4]。因此,近几年,低聚果糖被广泛应用于食品和制药等工业领域[5]。
工业上生产低聚果糖主要以蔗糖为底物经果糖基转移酶催化反应获得,因此,提高果糖基转移酶的生产水平和催化效率有助于促进低聚果糖的发展。工业上以真菌,如日本曲霉(AsnergillusJaponicus,A.Japonicus)等来源的果糖基转移酶催化蔗糖来生产低聚果糖,但真菌在发酵过程中菌丝易弯曲成球给发酵带来诸多不便。近年来,许多研究都围绕提高果糖基转移酶的催化效率进行,以期改善低聚果糖的生产产量。一些研究通过采用固定化果糖基转移酶催化蔗糖,使酶重复利用,提高果糖基转移酶的催化效率[6]。野生型果糖基转移酶生产菌株在产酶水平上均存在较大差异,初步筛选获得的菌株产果糖基转移酶的产量相对较低,且其酶活力较低影响工业生产低聚果糖的水平。国内外学者对果糖基转移酶生产菌株进行了大量筛选工作[7],并通过紫外诱变、紫外-氯化锂复合诱变等手段筛选野生型菌株,以此提高野生型菌株产果糖基转移酶酶催化活力,取得了一定的研究进展[8]。相较于诱变技术,构建果糖基转移酶的重组生产菌株,实现果糖基转移酶的异源表达,是一种更加简便高效的手段,在不同的宿主中异源表达果糖基转移酶能够大幅度提高果糖基转移酶的产量,且酶活力也有所提高,有利于扩大低聚果糖生产规模,提高产量[9-10]。
本研究采用基因工程技术,将黑曲霉(Aspergillusniger,A.niger)来源的果糖基转移酶的基因连接至pET28a表达载体,并导入E.coliBL21中,构建一株E.coliBL21-pET28a-fru重组菌生产果糖基转移酶。重组菌株经异源表达后,采用Ni2+柱纯化获得纯的重组果糖基转移酶,并测定其各方面的酶学性质。本研究成功地将果糖基转移酶在E.coli宿主进行异源表达,对于果糖基转移酶的异源表达有重要意义,且促进低聚果糖的工业化生产。
1 材料与方法
1.1 质粒、菌株及试剂
菌株E.coliJM109和BL21及pET28a质粒为本实验室保藏。A.nigerSG610(CICIM F0902)保藏于中国高校工业微生物资源和信息中心(CICIM-CU)。
快切酶购于赛默飞公司。DNA连接酶、PrimeSTAR GXL DNA Polymerase购于Takara公司,IPTG购于上海生工。实验中LB培养基用于种子培养,TB培养基用于发酵产酶。
1.2 构建重组质粒pET28a-fru
反转录PCR(RT-PCR)获得果糖基转移酶cDNA,以此为模板并设计带有NcoⅠ和BamH Ⅰ酶切位点(下划线)及组氨酸标签的引物,引物序列为:
上游5′-CATGCCATGGGCAAGCTTCAAACGGCTTC;
下游3′-CGGGATCCTTAGTGATGATGATGATGATGAGACTGACGATCCGGCC。
使用PrimeSTAR GXL DNA Polymerase进行果糖基转移酶基因的PCR反应,反应体系与反应条件见Takara公司说明书,经PCR获得A.niger菌株的果糖基转移酶基因fru。
使用快速内切酶分别酶切PCR扩增的果糖基转移酶基因片段和pET28a质粒,随后将酶切片段经连接酶连接,形成重组质粒pET28a-fru。pET28a-fru导入感受态E.coliJM109细胞,将阳性转化子进行双酶切验证。
1.3 重组果糖基转移酶的表达与纯化
将验证成功的阳性转化子导入感受态E.coliBL21细胞,挑取阳性转化子接种至TB液体培养基,37℃摇瓶培养,检测菌液在600 nm下的吸光值达到0.8后,添加0.025 mmol/L IPTG诱导表达果糖基转移酶。经20 h后离心收集菌体,获得胞内果糖基转移酶。
将离心收集的菌体经磷酸缓冲液清洗2~3次后重新悬浮,使用超声波破碎仪破碎细胞,使胞内的果糖基转移酶游离至胞外,离心收集上清,得到含果糖基转移酶的溶液。使用0.22 μm的滤膜过滤除去上清液中杂质,采用HisTrap HP 1 mL的Ni2+柱纯化过滤后的酶液,收集单纯的果糖基转移酶。
1.4 蛋白浓度测定
蛋白浓度测定采用Takara公司的BCA蛋白浓度测定试剂盒,具体方法如下。
标准曲线绘制:以牛血清白蛋白溶液为标准蛋白样品,标准蛋白样品浓度分别为0.025、0.05、0.1、0.2、0.3、0.4和0.5 mg/mL,加入BCA反应液(试剂盒),37℃放置20~30 min。用酶标仪测定562 nm处吸光值,绘制标准曲线。
溶液中蛋白浓度测定:稀释蛋白样品,将其与BCA反应液(试剂盒),37℃放置20~30 min。用酶标仪测定562 nm处吸光值,根据绘制的标准曲线,计算出样品中蛋白浓度。
1.5 果糖基转移酶的酶活测定
果糖基转移酶的一个酶活力单位(U)定义为:在特别条件下,每分钟酶催化底物蔗糖分子生成1 μmol蔗果三糖所需酶量[11-12]。
酶活力测定方法为:50%(W/V)蔗糖溶液500 μL与pH 5.5的0.1 mol/L柠檬酸-磷酸氢二钠缓冲液250 μL混匀,于45℃预热10 min,加入250 μL酶液反应15 min,沸水浴15 min 终止反应。取上清用0.22 μm膜过滤,高效液相色谱(HPLC)测定各组分的含量[9]。
1.6 果糖基转移酶的酶学性质测定
1.6.1 动力学参数测定
以柠檬酸-Na2HPO4为缓冲液,蔗糖为底物,测定不同底物浓度(200~700 g/L)条件下,果糖基转移酶酶活力的变化,并绘制双倒数曲线,以此计算酶的Km和Vmax值。此外,葡萄糖是果糖基转移酶的竞争性抑制剂[13]。由于果糖基转移酶酶促反应过程中生成葡萄糖,对酶促反应产生抑制作用,因此,分析添加过量的葡萄糖(50 g/L和100 g/L)对重组果糖基转移酶的动力学参数的影响,并计算抑制常数Ki值。
1.6.2 最佳温度反应条件和热稳定性测定
在pH 5.5的柠檬酸-Na2HPO4条件下,以步骤1.5中的酶活力测定方法测定30℃~70℃温度下重组酶酶活力,并计算相较于最高酶活力的相对酶活,确定重组果糖基转移酶的最佳反应温度。
将重组果糖基转移酶在35℃、40℃、45℃温度下各保温0~60 min,每隔10 min取样,按照步骤1.5中的酶活力测定方法测定重组酶残留的酶活力,并计算相较于未保温重组酶的相对酶活力,确定重组酶的热稳定性。
1.6.3 最佳pH反应条件和pH稳定性测定
在45℃温度条件下,按照步骤1.5中的酶活力测定方法测定pH 3.0~10.0(缓冲液为柠檬酸-Na2HPO4和甘氨酸-NaOH,浓度为0.1 mol/L)条件下重组酶的酶活力。根据不同pH值条件下重组酶的酶活力变化情况,确定重组果糖基转移酶的最佳pH反应条件。
将重组果糖基转移酶在pH 3.0~10.0(缓冲液为柠檬酸-Na2HPO4和甘氨酸-NaOH,浓度为0.02 mol/L)条件下,25℃保温24 h后,按照步骤1.5中的酶活力测定方法测定重组酶酶活力残留。计算不同pH值条件下保存后残留酶活相较于最高酶活力的相对酶活力,确定重组果糖基转移酶的pH值稳定性。
1.6.4 金属离子对酶活的影响
添加Li+、Ca2+、Mg2+、Ni2+、Zn2+、Mn2+、Cu2+、Fe2+、Ag+和Co2+等不同的金属离子浓度分别为1和5 mmol/L,测定添加金属离子至酶促反应体系后,酶活力的变化趋势,分析添加金属离子对重组果糖基转移酶催化反应的影响[14]。
2 结果与讨论
2.1 表达重组果糖基转移酶

图1 构建pET28a-fru
通过PCR扩增获得A.niger果糖基转移酶基因fru,果糖基转移酶PCR模板为反转录PCR(RT-PCR)获得的cDNA(图1)。将基因片段与载体pET28a分别用限制性内切酶NcoⅠ和BamH Ⅰ进行酶切消化并连接,构建重组质粒pET28a-fru(图1)。pET28a-fru质粒导入E.coliJM109细胞,阳性转化子送至天霖公司(无锡)进行测序。序列比对结果表明,果糖基转移酶基因片段大小为1905 bp,编码635个氨基酸。
将测序成功的阳性转化子pET28a-fru转化感受态E.coliBL21细胞,筛选重组菌E.coliBL21-pET28a-fru阳性转化子。将获得的重组菌E.coliBL21-pET28a-fru接种至TB培养基中,IPTG诱导发酵生产果糖基转移酶,如图2所示。在发酵过程中,重组菌E.coliBL21-pET28a-fru的菌体浓度逐渐增加,且随着发酵的不断进行,重组菌产果糖基转移酶酶活力逐渐提高,在发酵24 h后达到18.4 U/mg。
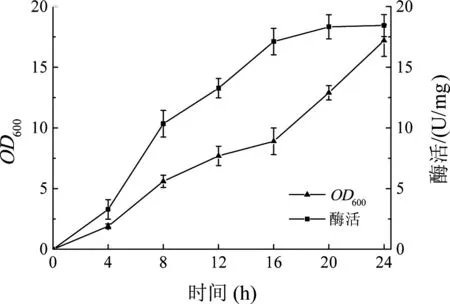
图2 重组菌株E. coli BL21-pET28a-fru产酶曲线
经Ni2+柱纯化重组果糖基转移酶,将纯化前、后的果糖基转移酶进行SDS-PAGE电泳分析,如图3所示。与对照株相比较,表达重组酶菌株所在SDS-PAGE电泳泳道在66.4 ku附近有明显条带,与纯化后的重组果糖基转移酶的目的条带一致,表明果糖基转移酶基因fru在E.coliBL21菌株中成功表达并纯化。表达重组酶菌株的单位菌体胞内蛋白浓度为480.3 mg/g,而对照株的单位菌体胞内蛋白浓度为371.9 mg/g,进一步表明果糖基转移酶基因fru在E.coliBL21菌株中获得成功表达。测得重组果糖基转移酶的比酶活力为706.6 U/mg。王立梅[15]将A.japonicus来源的果糖基转移酶基因在酿酒酵母细胞中异源表达,酶活力平均为26.4 U/mg。

M:Marker;1:对照株(含pET28a空质粒)胞内蛋白;2:目的株胞内蛋白;3:纯化酶
图3果糖基转移酶SDS-PAGE电泳分析
Fig 3 SDS-PAGE analysis of fructosyltransferase
2.2 重组果糖基转移酶的动力学参数测定

研究中分析了酶促反应体系中添加不同浓度的葡萄糖对酶促反应的影响。当添加50 g/L的葡萄糖时,重组果糖基转移酶的Km值由未添加时的1.8 mol/L变为1.9 mol/L(图4-b)。Km值越大,酶与底物的亲和能力越低,因此添加葡萄糖会抑制酶与底物蔗糖的结合。而当添加的葡萄糖浓度由50 g/L变为100 g/L时,重组果糖基转移酶的Km值变为4.8 mol/L,严重影响了酶与底物蔗糖的亲和力。当反应体系中添加50 g/L的葡萄糖时,重组果糖基转移酶的Ki值为3.4 mol/L,当反应体系中添加100 g/L的葡萄糖时,重组果糖基转移酶的Ki值为0.3 mol/L。说明添加的葡萄糖浓度越高,对重组果糖基转移酶的抑制作用越强。

a:不添加葡萄糖;b:添加不同浓度的葡萄糖
图4重组果糖基转移酶的双倒数曲线
Fig 4 Lineweaver-Burk plots
2.3 果糖基转移酶的最适反应温度和热稳定性测定
分析30℃~70℃温度条件下重组果糖基转移酶酶活力的变化。结果如图5-a所示,重组酶在45℃条件下进行催化反应时酶活力达到最高,而其他温度条件下进行催化反应的酶活力都会比45℃时的酶活力有所降低。当催化反应在40℃~50℃温度条件下进行时的酶活力相对于最高酶活力大于80%以上。而当催化反应在60℃进行时,酶活力仅剩最适反应温度条件下酶活力的20%。文明等研究了来源于大蒜果糖基转移酶的酶学特征,发现该果糖基转移酶具有热不稳定性,其最适反应温度为35℃,40℃以上温度条件下时,酶活力下降明显[17]。分析重组果糖基转移酶的热稳定性,结果如图5-b所示。重组酶在35℃条件下保温时,酶活力降低缓慢,酶的半衰期(t1/2)为25.2 min。在40℃时,重组酶酶活力损失加快,酶的t1/2为9.0 min。在45℃条件下,重组酶迅速失活,t1/2仅为1.6 min。
2.4 重组果糖基转移酶的最适反应pH值及稳定性
分析了pH 3.0~8.0及pH 8.0~10.0的不同pH条件对重组果糖基转移酶酶反应的影响。结果如图6-a所示,在pH 5.5时重组果糖基转移酶的酶活力达到最高,pH值升高或降低重组果糖基转移酶的酶活力都有所降低。而pH值在5.0~6.5范围内时,重组果糖基转移酶具有80%以上的酶活力。Han等研究洋葱来源的果糖基转移酶化最适反应条件为pH 5.0,温度45℃[18]。
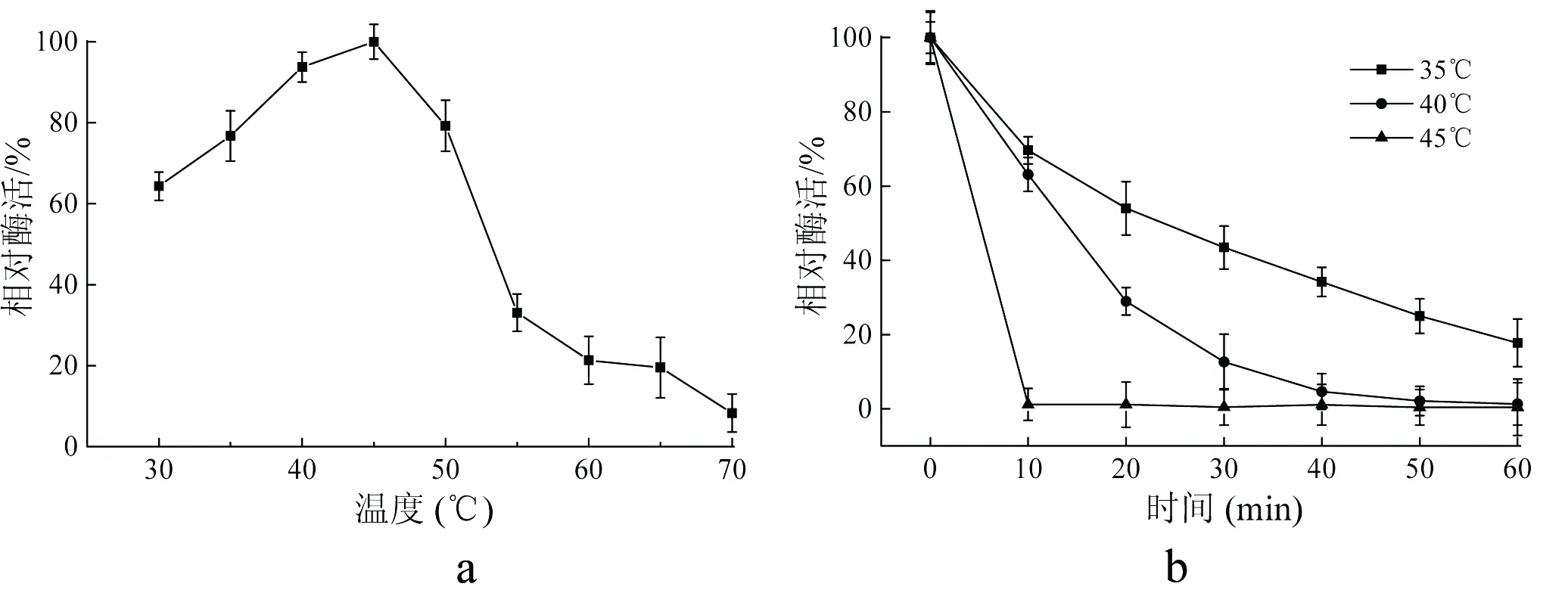
a:温度对重组果糖基转移酶催化活性的影响;b:重组果糖基转移酶的稳定性
图5温度对重组果糖基转移酶催化活性和稳定性的影响
Fig 5 Effect of temperature on activity and stability
of recombinant fructosyltransferase
分析重组果糖基转移酶的pH值稳定性,如图6-b所示,重组酶在pH 3.5~8.0时相对于最高酶活力大于80%以上,且在pH 5.0~7.5时相对于最高酶活力大于90%以上,因此,重组果糖基转移酶的pH值稳定性较好。

a:pH值对重组果糖基转移酶催化活性的影响;b:pH值对重组果糖基转移酶稳定性的影响
图6 pH对重组果糖基转移酶催化活性和稳定性的影响
Fig 6 Effect of pH on activity and stability of recombinant fructosyltransferase
2.5 金属离子对重组果糖基转移酶的影响
金属离子可以改变蛋白质的总电荷而影响其性质,也可以与酶的催化结构域相互作用,从而减少或增加酶的催化活性[19]。研究中分析了终浓度为1.0 mmol/L和5.0 mmol/L的不同金属离子对重组果糖基转移酶酶活力的影响。结果如表1所示,1 mmol/L和5 mmol/L的Co2+、Mn2+、Zn2+对重组果糖基转移酶的催化反应具有激活作用。1 mmol/L和5 mmol/L的Fe2+和Ag+对重组果糖基转移酶的催化反应具有显著抑制作用。1 mmol/L的Cu2+对重组果糖基转移酶具有促进作用,但5 mmol/L的Cu2+对重组果糖基转移酶具有抑制作用。Ghazi等研究了金属离子对来源于A.aculeatus的果糖基转移酶的影响,金属离子Hg2+和Zn2+对重组果糖基转移酶的催化反应具有抑制作用[20]。李慧娟等研究发现,Zn2+和Cu2+能够抑制来源于莴苣的蔗糖:蔗糖-1-果糖基转移酶的催化活性,且Ca2+能够促进酶的催化反应[21]。
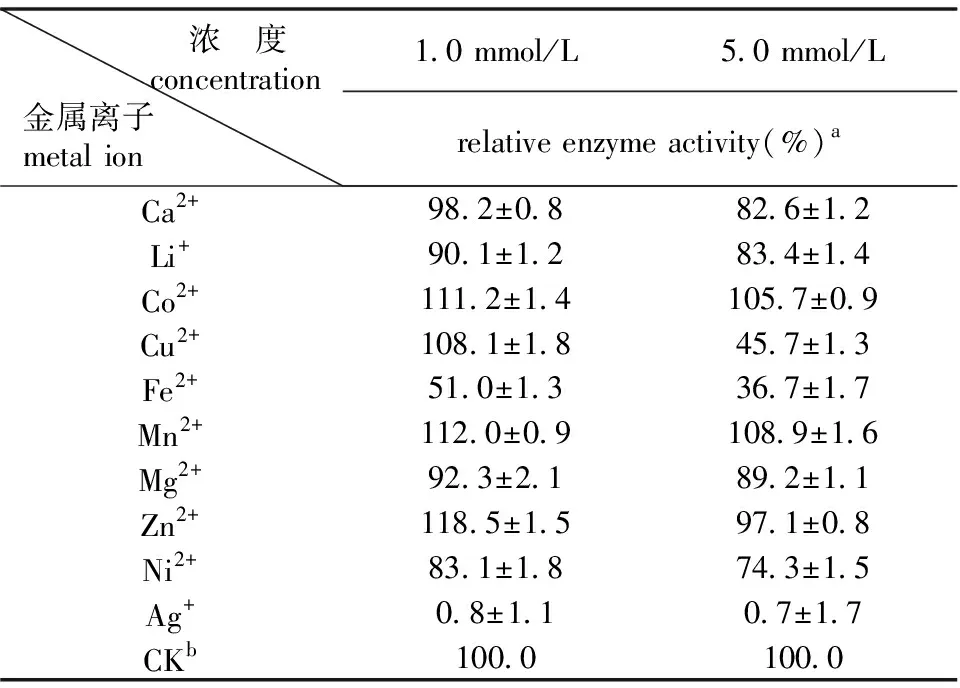
表1不同金属离子及浓度对果糖基转移酶的影响
注:a±为标准偏差,N=3;bCK为对照
3 结论
本研究成功实现了A.niger来源的果糖基转移酶基因在E. coliBL21(DE3)中的异源表达,并测定纯化后的重组果糖基转移酶的各项酶学性质,包括其反应动力学参数,葡萄糖、温度、pH值及金属离子对重组酶酶活力的影响等。发现重组果糖基转移酶在E.coli中进行异源表达时,生产周期明显缩短,酶活力较高,且催化效率较好。异源表达的重组果糖基转移酶的最适反应温度和pH值条件适中,且在较宽的pH值范围内保持稳定。在重组果糖基转移酶的酶促反应过程中,葡萄糖会抑制酶促反应的进行,而且葡萄糖浓度越高抑制作用越显著。Co2+、Mn2+及Zn2+对重组果糖基转移酶的催化反应具有显著激活作用。本实验充分研究了重组果糖基转移酶的酶学性质,对于利用果糖基转移酶生产低聚果糖的工业化过程中具有重要的意义。

