猴源轮状病毒SA11 株Balb/c乳鼠动物模型的建立
乔洪图, 周 艳, 尹 娜, 陈林林, 刘 洋, 苏 婷, 孙茂盛, 李鸿钧
(中国医学科学院 北京协和医学院 医学生物学研究所, 云南省重大传染病疫苗研发重点实验室, 昆明 650118)
轮状病毒(Rotavirus,RV)是导致5岁以下婴幼儿严重腹泻的重要病原体之一[1]。每年全世界大约有2亿婴幼儿感染轮状病毒并发生腹泻,大约50万儿童死于该疾病[2-3]。轮状病毒动物模型的建立有利于研究RV的感染机制及研发预防和治疗RV感染的疫苗和特效药物。国内外曾报道与轮状病毒相关的动物模型,包括无菌小猪、鼠、牛、羊、兔等,其中无菌小猪和乳鼠的研究较为成熟[4-5]。无菌小猪免疫系统与人类较为接近,且致病周期长,但是对实验室条件要求较高,操作起来较为困难[6]。而乳鼠对轮状病毒易感且繁殖能力强,易于试验操作,因此我们选择了Balb/c乳鼠来进行轮状病毒的建模。
本研究采用猴源轮状病毒SA11,分别用不同剂量的毒株经单次灌胃感染7 d龄的Balb/c乳鼠,建立猴源轮状病毒SA11的Balb/c乳鼠动物模型,为后续疫苗的研发及疫苗保护性评价提供依据。
1 材料和方法
1.1 材料
MA104细胞、SA11毒株由本实验室保存;轮状病毒胶体金试剂盒(北京万泰生物);组织细胞原位凋亡检测试剂盒(购自Vazyme公司);FITC标记的兔抗山羊IgG(H+L)抗体(购自KPL公司);SPF级Balb/c乳鼠(购自昆明医科大学实验动物中心)。
1.2 方法
1.2.1 病毒培养
SA11株RV的增殖和滴度测定在MA104上进行。当细胞长成致密单层时接种RV。接种前,将原始病毒液从-80℃冰箱中取出,室温溶解,向待接种的轮状病毒液中加入终浓度为20 μg/mL的胰酶和600 μg/mL的氯化钙,37℃水浴45 min。水浴完毕,将长成致密单层的MA104细胞培养瓶中的含10%新生牛血清MEM生长液弃掉,加入无血清MEM维持液,反转培养瓶清洗细胞,如此操作重复3遍,将清洗细胞的MEM维持液弃掉,加入已经激活的轮状病毒液,置于37℃,5% CO2细胞培养箱中吸附90 min。向MEM维持液中加入终浓度为1 μg/mL的胰蛋白酶,并将其转入吸附病毒的细胞培养瓶中,置于37℃,5% CO2细胞培养箱中静止培养。培养期间,观察细胞病变效应(CPE),当90%以上的细胞出现CPE时,即可收获病毒。将收获的病毒培养液反复冻融3次,使细胞破碎,释放病毒,8000 r/min,4℃离心20 min,去除大的细胞碎片等成分,收集上清液,即病毒原液保存于-80℃冰箱备用。
1.2.2 乳鼠灌胃攻毒
灌胃攻毒之前,采集乳鼠粪便,离心取上清,轮状病毒胶体金试剂盒及ELISA检测粪便上清中是否存在RV抗原,尾静脉采取Balb/c母鼠全血,ELISA检测母鼠血清中是否存在抗轮状病毒特异性抗体,排除所有轮状病毒抗体阳性的动物。由于乳鼠过小,人工饲养困难,同一组乳鼠与哺乳母鼠同笼喂养。攻毒之前将7 d龄乳鼠与哺乳母鼠隔离,对乳鼠进行饥饿1 h处理。分组情况如下:106PFU SA11/只、105PFU SA11/只、104PFU SA11/只、PBS,每组10只,利用8号灌胃针对乳鼠进行单次灌胃感染。
1.2.3 攻毒后乳鼠腹泻及精神状态观察
攻毒后0到7 d,将乳鼠与母鼠同笼喂养,每天观察攻毒后乳鼠的精神状态、腹泻情况等。每隔24 h通过按压乳鼠腹部采集乳鼠粪便,依据Boshuizen等对乳鼠腹泻的评分规则,根据粪便的颜色、软硬、数量等,对乳鼠的腹泻进行评分(0~4),无粪便排出评分0分、棕色成形大便评分1 分、 棕色软大便评分2 分、黄色软大便评分3 分、黄色稀水样便评分4 分、肛周粪便污染评分4 分,大于2分被认为是有腹泻[7]。并进一步将粪便重悬于10%(M/V)冰冷的PBS中,8000 r/min离心取上清,分别使用轮状病毒胶体金试剂盒及ELISA检测粪便中的病毒抗原载量。将粪便上清在已加入PBS稀释液的已包被山羊抗轮状病毒多克隆抗体的ELISA板中进行梯度稀释,将待测粪便上清以每孔100 μL的量加入到ELISA板的第一列(每孔含有100 μL的PBS稀释液),形成1∶2的首稀释度,然后将ELISA板第一列中2倍稀释的粪便上清吸出100 μL加入到第二列孔中,形成1∶4的稀释度,如此以2倍的稀释度重复梯度稀释10次,形成1∶2到1∶2048的稀释度范围,则待测粪便上清(100 μL)中的抗原量即等于其阳性孔的最高稀释度,其数值再乘以10即可得出待测轮状病毒抗原每毫升的抗原量(EU/mL)。
1.2.4 攻毒后乳鼠空肠的病理改变
乳鼠感染轮状病毒24、48、72和96 h后每个试验组各解剖乳鼠2只,取其空肠,将其固定于10%的福尔马林溶液中,制作石蜡切片,经HE染色观察空肠的形态学改变。另取一份空肠固定于戊二醛中,用于电镜观察。
1.2.5 攻毒后乳鼠脏器的轮状病毒抗原分布情况
乳鼠感染轮状病毒24、48、72和96 h后每个试验组各解剖乳鼠2只,取其心、肝、脾、肺、肾、小肠(空肠)、脑组织,存放于液氮中,用于制作冰冻切片,免疫荧光检测各组织中轮状病毒抗原的分布。冰冻切片用丙酮于4℃固定30 min,风干后用3% BSA(PBS-BSA)于37℃放置1 h;然后将山羊抗轮状病毒多克隆抗体(Goat anti-Rotavirus polyclonal antibody)按1∶1000稀释,37℃孵育90 min;0.05%Tween(PBS-T)洗3次;将FITC标记的兔抗山羊IgG(H+L)抗体(Fluoresein Labeled Rabbit anti-Goat IgG(H+L)antibody)按1∶200稀释,37℃孵育60 min;0.05%Tween(PBS-T)洗3次,显微镜观察荧光。
1.2.6 攻毒后乳鼠空肠原位凋亡检测
用原位细胞凋亡检测试剂盒(1684817,Roche),对感染RV 72 h后的实验组和对照组乳鼠空肠石蜡切片作原位细胞凋亡检测,操作步骤严格按照说明书进行。轮状病毒感染小肠绒毛细胞后,会引起细胞发生凋亡,细胞DNA发生断裂。本试剂盒采用TUNEL法,应用末端脱氧核糖核苷酸转移酶在凋亡细胞断裂DNA的3′-羟基(3′-OH)末端催化掺入荧光素-12-脱氧三磷酸尿苷(FITC-12-dUTP),FITC-12-dUTP标记的DNA可以用荧光显微镜直接观察。
2 结果与分析
2.1 乳鼠感染轮状病毒后的临床症状及排毒情况
乳鼠攻毒不同剂量的RV 24 h后,高、中剂量组乳鼠均出现明显腹泻,精神萎靡、毛色光泽暗淡、嗜睡、活动能力减弱等症状,攻毒72 h后乳鼠腹泻最为严重,乳鼠肛门周围有大量粪便污染,高剂量组部分乳鼠尾根部发生溃烂流血;攻毒96 h后乳鼠腹泻减轻,乳鼠体征状态开始好转;感染120 h后乳鼠腹泻已经基本停止,乳鼠开始恢复到正常状态。在整个实验周期内,对照组和低剂量组乳鼠无明显腹泻发生。乳鼠开始出现腹泻的时间及腹泻的严重程度与感染所使用毒种的剂量呈正相关,毒种的剂量越高,乳鼠出现腹泻的时间越早,腹泻持续的时间越长,腹泻评分及腹泻百分比越高(图1)。乳鼠攻毒后的0到7 d,每天收集乳鼠的粪便,使用轮状病毒胶体金试剂盒检测乳鼠粪便的排毒情况。轮状病毒胶体金检测结果显示(表1),在攻毒24 h和72 h后,轮状病毒阳性最强,72 h后检测逐渐减弱,120 h至144 h胶体金检测阴性。ELISA检测攻毒24 h后各实验组每只乳鼠的排毒情况,结果发现,高剂量攻毒组中乳鼠的最大排毒量可达1280 EU/mL,中剂量攻毒组中乳鼠的最大排毒量也可达到320 EU/mL(表2)。

表1 胶体金检测乳鼠粪便中RV抗原结果
A:攻毒106PFU/只SA11 72 h 后乳鼠粪便胶体金检测结果; B:攻毒105PFU/只SA-11 72 h 后乳鼠粪便胶体金检测结果; C:攻毒104PFU/只SA11 72 h后胶体金检测结果; D:灌胃PBS乳鼠粪便胶体金检测结果。阳性结果以“+”号表示;阴性结果以“—”号表示。根据滴加粪便上清后,T检测带出现的时间长短,将RV抗原的阳性强度进行划分:++++≤2 min, 2 min<+++≤4 min, 4 min<++≤6 min, 6 min<+≤10;超过10 min T检测带出现或不出现都判为—

A:分别攻毒106PFU/只、105PFU/只和104PFU/只每组乳鼠腹泻平均分的统计结果;B:分别攻毒106PFU/只、105PFU/只和104PFU/只每组乳鼠腹泻百分数的统计结果
图1攻毒不同剂量每组乳鼠腹泻平均分及腹泻百分数统计结果
Fig 1 The average score of diarrhea and the percentage of
diarrhea in each group neonatal mice with different dose
2.2 攻毒后乳鼠小肠的病理改变
乳鼠感染轮状病毒72 h后,解剖乳鼠,采集小肠组织,制做石蜡切片,经HE染色观察小肠的形态学改变,轮状病毒感染组的小肠绒毛可见明显的肿胀及破损,小肠绒毛顶端可见大量的空泡化细胞,对照组未见异常(图2)。电镜观察发现,与PBS对照组相比较,轮状病毒组的小肠绒毛排列紊乱,发生明显皱缩以及细胞内出现大量脂滴样结构(图3)。

表2 ELISA检测攻毒24 h后乳鼠粪便RV抗原结果
ELISA检测攻毒24 h后乳鼠粪便RV抗原结果(单位:EU/mL)。A组:攻毒106PFU/只 粪便ELISA检测结果; B组:攻毒105PFU/只 粪便ELISA检测结果; C组:攻毒104PFU/只 粪便ELISA检测结果; D组:PBS组粪便ELISA检测结果。“—”表示未采到粪便
2.3 轮状病毒抗原在各脏器中的分布情况
在感染轮状病毒后,于不同时间点解剖乳鼠,采集相应组织,制做冰冻切片,进行免疫荧光检测,结果发现,在感染RV 24、48、72和96 h后,106PFU SA11组和105PFU SA11组乳鼠的小肠(空肠部位)以及肾脏组织内均检测到了轮状病毒抗原抗原(图4),而104PFU SA11组和PBS对照组乳鼠的空肠和肾脏组织内均未发现轮状病毒抗原。在不同剂量RV感染组中的心、肝、肺等其他组织内未检测到轮状病毒抗原(资料未显示)。
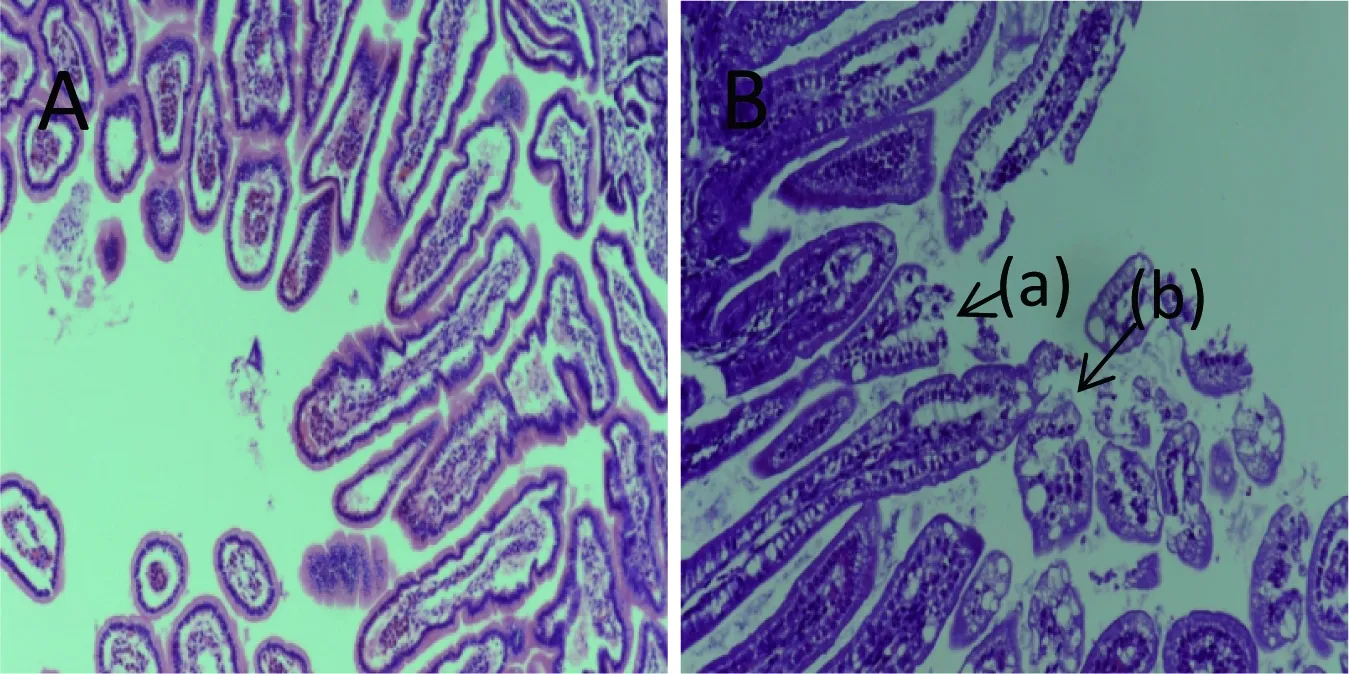
A:对照组; B:实验组(攻毒105PFU/只SA11)。(a):小肠绒毛顶端破损;(b):绒毛空泡变性
图2感染RV 72 h后实验组和对照组乳鼠小肠病变情况(HE×200)
Fig 2 The small intestine lesions of the experimental
group and the control group (HE × 200)
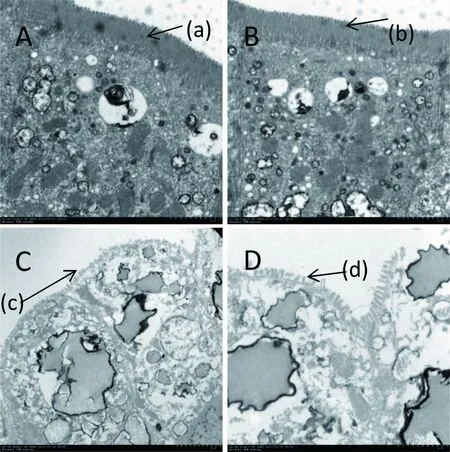
A、B:对照组;C:攻毒106PFU/只SA11组;D:攻毒105PFU/只SA11组。实验组与对照组相比小肠微绒毛发生明显缩短,出现大量脂滴结构。(a)(b):小肠微绒毛排列整齐,结构完整;(c):小肠微柔毛脱落;(d):小肠微柔毛皱缩变短、排列紊乱
图3小肠电镜图片
Fig 3 Small intestine electron microscopy picture(TEM×20 000)
2.4 组织细胞原位凋亡检测
通过对实验组和对照组空肠组织原位凋亡检测,发现攻毒RV 72 h 后,106PFU/只和105/PFU/只SA11实验组小肠绒毛顶端细胞发生明显凋亡,凋亡细胞沿绒毛顶端成串排列,并可见凋亡细胞从绒毛上脱落。对照组和攻毒104PFU/只SA11组未检测到明显的凋亡细胞(图5)。
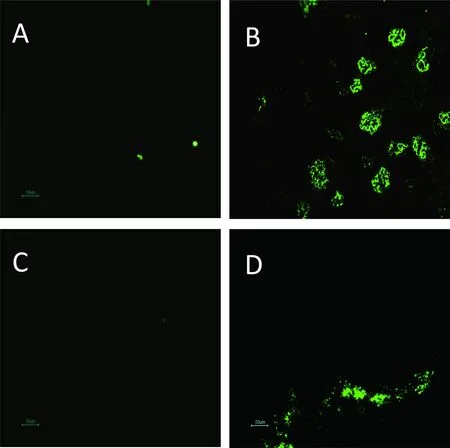
A:对照组肾脏;B:攻毒106PFU/只SA11组肾脏;C:对照组小肠;D:攻毒106PFU/只SA11组小肠
图4对照组和实验组肾脏和小肠组织免疫荧光图片(免疫荧光×200)
Fig 4 Immunofluorescence images of renal and small intestine tissues in the
control and experimental groups (Immunofluorescence×200)
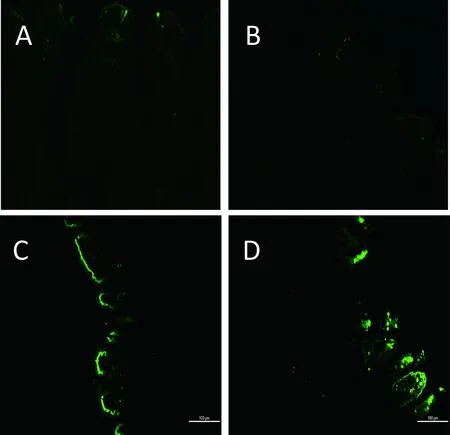
A:对照组;B:攻毒104PFU/只SA11组小肠;C:攻毒106PFU/只SA11组小肠;D:攻毒105PFU/只组小肠
图5小肠原位凋亡检测(免疫荧光×200)
Fig 5 Detection of apoptosis in small intestine (Immunofluorescence×200)
3 讨论与结论
轮状病毒动物模型对于疫苗的研制与开发、抗病毒药物的筛选、抗体体内的治疗、致病机理的研究等都具有重要的意义。目前轮状病毒的动物模型主要分为两种,一种是腹泻模型,如无菌猪和乳鼠;一种是无腹泻症状的感染模型,如大鼠、兔子、羊、牛等[8-9]。无菌猪和乳鼠是目前为止研究较为成功的轮状病毒模型[10]。李晋涛等采用人源轮状病毒Wa株、G1和G3分别感染巴马新生仔猪,引起仔猪发生明显腹泻及肠道病理改变,成功构建了人源轮状病毒的腹泻模型[11]。无菌猪免疫系统与人类较为接近,且致病周期长,但是对实验室条件要求较高,操作起来较为困难;而乳鼠对轮状病毒易感且繁殖能力强,易于实验操作,因此我们选择了Balb/c乳鼠来进行轮状病毒的建模。
乳鼠在攻毒后会出现精神萎靡、活动力下降等临床症状,且在24 h内出现不同程度的腹泻,72 h腹泻最为严重,96 h逐渐减弱,120 h腹泻完全消失。乳鼠开始出现腹泻的时间及腹泻的严重程度与感染所使用的毒种类别及毒种的剂量有关。当使用同一毒种时,毒种的剂量越高,乳鼠出现腹泻的时间越早,腹泻持续的时间越长。本研究发现,SA11组中感染106PFU/只和105PFU/只可以使乳鼠发生明显的腹泻;轮状病毒攻毒后,通过胶体金及ELISA的方式能够检测到实验小鼠肠道有排毒,通过免疫荧光能够检测到小肠组织内有轮状病毒抗原,表明攻毒感染后轮状病毒在实验小鼠肠道组织内得到了复制增殖;另一方面通过石蜡切片HE染色及电镜观察发现,实验乳鼠小肠的病理组织发生了明显的改变,攻毒组的小肠绒毛排列紊乱,发生明显皱缩以及小肠绒毛细胞内出现大量的空泡化及脂滴样结构;轮状病毒感染还能造成小肠部位凋亡细胞的增加。以上结果表明我们成功构建了小鼠轮状病毒感染的腹泻模型。
有报道称轮状病毒在一定情况下也可导致肠道外脏器的感染。轮状病毒感染乳鼠后可穿过肠道形成病毒血症,感染肠道外的脏器[12-14]。通过免疫荧光,我们发现轮状病毒感染乳鼠后,部分乳鼠肾脏的肾小球位置能检测到轮状病毒抗原。这说明轮状病毒感染存在病毒血症,但病毒血症的发生与感染的病毒株、感染剂量及乳鼠自身的免疫状态等有很大的关系。谭震在就诊的120例轮状病毒感染的患儿中发现只有7例发生了病毒血症,而Kapion等在经轮状病毒感染的重度免疫缺陷婴幼儿中发现均可发生病毒血症[15-16]。
综上所述,本研究成功构建了猴源轮状病毒SA-11株 Balb/c 乳鼠动物模型,为后续疫苗的研制与开发奠定了一定的理论基础。但由于乳鼠的致病周期短,无法长期观察其病理过程,以及其与人的亲缘关系较远和体型过小等原因并不能完全用于评价疫苗的免疫效果。Monica等利用一种新分离的野生型猴源轮状病毒TUCH灌胃攻毒14~42 d龄的婴猴,攻毒后虽无腹泻发生,但粪便中检测到大量病毒抗原[17]。我们今后也将在恒河猴婴猴身上展开一系列人源轮状病毒ZTR-68及猴源轮状病毒SA11的相关实验,以期建立更为合适的轮状病毒感染模型,为后续疫苗保护性评价提供更为完善的理论基础。

