三叶因子3在甲状腺乳头状癌TPC-1细胞株黏附中的作用机制*
林 旭 代 金 吴靖芳△ 张 静 张文静 薛 刚 高福禄
(河北北方学院,1 基础医学院,2 附属第一医院耳鼻咽喉头颈外科,张家口 075000;3 河北师范大学,石家庄 050024)
甲状腺乳头状癌(papillary thyroid cancer,PTC)是头颈部最常见的恶性肿瘤之一,其预后良好,但仍有部分患者在确诊前发生淋巴结转移或经治疗后复发[1]。癌细胞转移是一个复杂的过程,癌细胞的高黏附作用与肿瘤高转移性密切相关。三叶因子3(trefoil factor 3,TFF3)是三叶因子家族成员之一,有学者认为TFF3是潜在的癌基因,且高表达的TFF3具有促进肿瘤发生、发展、转移的作用[2-5]。β-catenin作为Wnt/β-catenin信号通路中一个核心的靶点,直接参与了细胞黏附[6]。本课题组前期工作表明,TFF3在PTC中高表达并与淋巴结转移有关[7],但关于TFF3是否通过影响PTC细胞的黏附作用进而影响该细胞向淋巴结转移和侵袭能力尚未见报道。本研究对敲低TFF3表达的TPC-1细胞株进行同质和异质黏附实验,明确TFF3对TPC-1黏附作用机制,为PTC淋巴结转移机制提供依据。
1 材料和方法
1.1 主要试剂
RPMI 1640培养基、胎牛血清(fetal bovine serum,FBS)、BSA基购自Gibco;TPC-1细胞株购自ATCC;鼠抗人β-catenin、activated leukocyte cell adhesion molecule (ALCAM)、MMP-9、MMP-2、E-cadherin购自Santa Cruz公司;FastQuan RT Kit购自TIANGEN公司;纤维连接蛋白(FN)购自美国Sigma公司;TRIzol裂解液购自Invitrogen公司;BCA蛋白浓度测定试剂盒、RIPA裂解液、ECL发光液购自上海碧云天生物技术有限公司;蛋白预染marker、PowerUpTMSYBR Green Master Mix购自赛默飞科技有限公司。DAB显色液购自中杉金桥公司。
1.2 细胞培养及分组
TPC-1细胞培养于含有10% FBS、1%青霉素-链霉素的RPMI 1640培养液中;稳定沉默TFF3表达的TPC-1细胞株(shTFF3-TPC-1)培养于含有10% FBS、1%青霉素-链霉素、嘌呤霉素(2mg/L)的RPMI 1640培养液中;转染空质粒载体的TPC-1细胞株(shRNAC-TPC-1)培养于含有10% FBS、1%青霉素-链霉素、嘌呤霉素(2mg/L)的RPMI 1640培养液中,3株细胞慢病毒转染成功建立了稳定敲低TFF3表达的TPC-1细胞株(shTFF3-TPC-1)和转染空质粒载体的TPC-1细胞株(shRNAC-TPC-1),置于5% CO2、37℃的孵育箱内培养。
1.3 细胞同质黏附实验
取对数生长期的shTFF3-TPC-1、shRNAC-TPC-1、TPC-1 3组细胞用培养基制备成1×105/ml密度,每孔100μl接种于48孔板,37℃培养1h后洗去未黏附细胞,PBS洗3次收集未黏附细胞(同质黏附细胞数=加入细胞数-未黏附细胞数)。
1.4 细胞异质黏附实验
以10mg/L FN包被基底膜,超净台吹干后PSB洗3次,以1% BSA每孔200μl封闭1h,将3组细胞数调整为1×105/ml密度,每孔接种100μl,37℃孵育,90min后终止培养。4%多聚甲醛固定15min,400×显微镜下计数黏附细胞数量。
1.5 Real-time quantitative PCR (qPCR)检测β-catenin、TFF3 mRNA水平
TRIzol法提取shRNA-TFF3-TPC-1、shRNAC-TPC-1、TPC-1 3组细胞总RNA;根据FastQuan RT Kit试剂盒说明书反转录cDNA;根据PowerUpTM SYBR Green Master Mix说明书进行qPCR检测。β-catenin上游引物5′-TGCAGTTCGCCTTCACTATG-3′,下游引物5′-ACTAGTCGTGGAATGGCACC-3′;β-actin上游引物5′-CCTGGGCATGGAGTCCTGTG-3′,下游引物5′-AGGGGCCGGACT CGTCATAC-3′;TFF3上游引物:5′-AATGCACCTTCTGAGGCAC CT-3′,下游引物5′-CGTTAAGACATCAGGCTCC AGAT-3′。
1.6 免疫细胞化学检测β-catenin、ALCAM、MMP-9、MMP-2、E-cadherin的蛋白表达水平
消化3组细胞,调整细胞密度到1×104/ml。盖玻片放于6孔板内,将1ml细胞悬液滴加于盖玻片上,过夜。待细胞融合度达80%后,4%多聚甲醛固定15min。正常羊血请封闭15min,一抗4℃孵育过夜(β-catenin、ALCAM、MMP-9、MMP-2、E-cadherin,工作浓度均为1∶100),二抗(羊抗兔lgG)37℃孵育30min,三抗(辣根酶标记链霉卵白素)37℃孵育30min,DAB显色,苏木精复染,乙醇脱水,二甲苯透明,中性树胶封片。阴性对照以PBS代替一抗。
1.7 免疫印迹检测β-catenin、ALCAM、MMP-9、MMP-2、E-cadherin的蛋白表达水平
以RIPA液裂解3组细胞,提取总蛋白,BCA法测定蛋白浓度,SDS-PAGE电泳分离蛋白并且转膜到PVDF膜上,脱脂奶粉封闭1h,PBST洗3次后,分别孵育一抗(β-catenin、ALCAM、MMP-9、MMP-2、E-cadherin,工作浓度均为1∶300)4℃过夜,辣根过氧化物标记的山羊抗兔/鼠抗体(1∶5000) 二抗37℃孵育1h,ECL显色。
1.8 统计学处理
2 结果
2.1 同质黏附细胞数
shRNA-TFF3组同质黏附细胞数(2111.15±427)显著高于shRNAC组(1796.6±51)(P<0.01)与TPC-1组(1772.4±90)(P<0.01),shRNAC组与TPC-1组同质黏附细胞数无差异。
2.2 异质黏附细胞数
shRNA-TFF3组异质黏附细胞数(638.83±68.88)显著低于shRNAC组(885.67±45.12)(P<0.01)与TPC-1组(898.16±25.69)(P<0.01),shRNAC组与TPC-1组同质黏附细胞数无差异。
2.3 TFF3及β-catenin mRNA水平
shRNA-TFF3组TFF3 mRNA水平显著低于shRNAC组与TPC-1组(P<0.01);shRNAC组与TPC-1组TFF3 mRNA水平无差异(P>0.05)。shRNA-TFF3组β-catenin mRNA水平显著低于shRNAC组与TPC-1组(P<0.01);shRNAC组与TPC-1组β-catenin mRNA水平差异无统计学差异(P>0.05)(图1)。
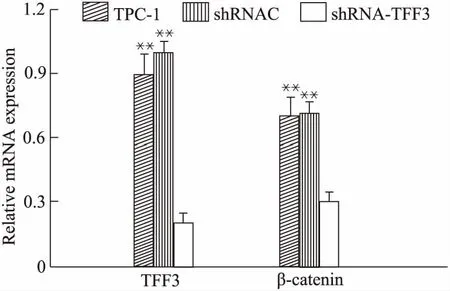
图1 沉默TFF3后细胞TFF3和β-catenin mRNA水平降低Fig 1 β-catenin mRNA and TFF3 mRNA levels decreased after silencing TFF3**P<0.01 vs shRNA-TFF3
2.4 ALCAM、β-catenin、MMP-9、MMP-2、E-cadherin蛋白水平
免疫细胞化学法显示,ALCAM、E-cadherin、MMP-9、MMP-2、β-catenin阳性信号为棕黄色,均位于胞质。shRNA-TFF3组ALCAM、MMP-9、MMP-2、β-catenin 免疫阳性信号明显低于TPC-1组和shRNAC组;E-cadherin蛋白免疫阳性信号明显高于TPC-1组和shRNAC组(图2)。
免疫印迹检测显示,与TPC-1组与shRNAC组相比,shRNA-TFF3组ALCAM、β-catenin、MMP-9、MMP-2蛋白水平显著降低,E-cadherin蛋白水平升高(图3)。
3 讨论
3.1 TFF3对细胞黏附的作用
黏附能力改变是肿瘤转移的始动步骤,细胞黏附分子在肿瘤细胞表面表达量或分布模式的改变直接或间接影响细胞间以及细胞与胞外基质的黏附及转移潜能,是肿瘤细胞从原发灶逃逸以及定植的关键性环节。同质黏附是指相同细胞之间的粘附,异质黏附是指肿瘤细胞与宿主基质的粘附。肿瘤细胞同质黏附能力下降,使细胞间黏着力降低,易于脱离原发灶[8],异质黏附能力上升,增加了逃逸肿瘤细胞异位种植能力[9]。沉默TFF3基因表达后,TPC-1细胞的同质细胞数增加,即可以增强同质细胞的黏附力。E-cadherin是广泛分布于上皮细胞的钙依赖性糖蛋白,介导同种细胞之间的黏附连接(同质黏附),E-cadherin表达降低或缺失会导致同质黏附能力下降,细胞骨架改变,癌细胞脱离原发灶。研究表明,E-cadherin在肺癌、乳腺癌、结肠癌中表达降低,肿瘤恶性程度越高其表达越低,细胞间黏附能力越差,侵袭能力越高[10-12]。Yuan等[13]在宫颈癌细胞中通过siRNA技术沉默TFF3后发现:STAT3 磷酸化下降,E-cadherin表达升高,提示TFF3可能经STAT3/E-cadherin途径通过调节细胞黏附能力来影响宫颈癌细胞侵袭能力。在TPC-1细胞中敲低TFF3表达后E-cadherin表达显著升高,可增加细胞间黏着

图3 3组细胞E-cadherin、MMP-9、MMP-2、β-catenin、ALCAM蛋白表达水平(A)及各蛋白定量表达(B)Fig 3 Expression of E-cadherin,MMP-9,MMP-2,β-catenin,and ALCAMs in the three groups.A showed the representative bands of Western blotting.Quantitative analysis of Western blotting was shown in B**P<0.01 vs shRNA-TFF3
力,抑制肿瘤细胞的转移,这与Pandey[14]等报道TFF3可以通过介导调节STAT3下调E-cadherin的表达,进而降低ER+乳腺癌细胞侵袭能力的研究一致。同时这也说明E-cadherin是TFF3的下游蛋白,是TFF3介导癌细胞侵袭的关键调节因子[13]。孙琳等[15]通过检测PTC患者组织和血清中E-cadherin含量水平显示,E-cadherin在PTC患者血清中高表达,在癌组织中低表达,他们认为可溶性E-cadherin与PTC淋巴结转移密切相关,血清中高表达的E-cadherin具有破坏细胞黏附的作用,从而促进癌细胞转移。
黏附分子ALCAM是免疫球蛋白超家族成员之一,其主要通过同嗜性黏附形式(ALCAM-ALCAM)和异嗜性黏附形式(ALCAM-CD6)在细胞黏附过程中发挥关键作用,与多种肿瘤的发生发展及转移密切相关[16]。Chaker等[17]认为ALCAM在PTC组织较癌旁组织高表达。孙琳等[18]报道PTC组织ALCAM的高表达与β-catenin、E-cadherin的异常表达有关,且三者的异常表达与PTC淋巴结转移密切相关。Degen等[19]认为ALCAM可能通过调节黏附作用来影响该种细胞的恶性生物学行为。沉默TFF3后可以显著减低TPC-1细胞中ALCAM的表达,与Chaker等[17]发现ALCAM高表达可以降低细胞黏附从而促进肿瘤转移的研究一致。Tomita等[20]通过对前列腺癌细胞系研究发现,ALCAM可以通过α-catenin与细胞骨架相
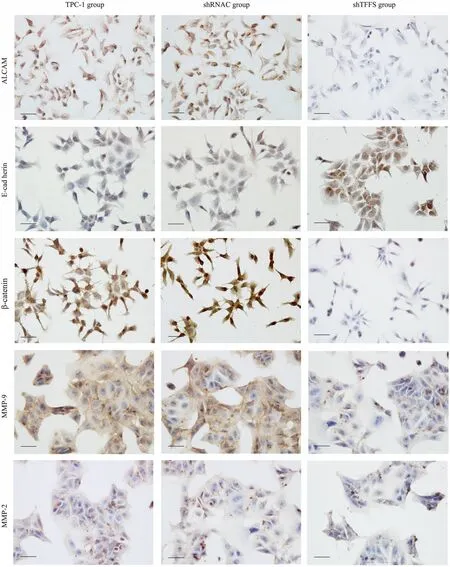
图2 ALCAM、E-cadherin、β-catenin、MMP-9、MMP-2蛋白在3组细胞的表达,免疫细胞化学,bar=20μmFig 2 Protein expression of ALCAM,E-cadherin,β-catenin,MMP-9,and MMP-2 in the three groups,immunocytochemistry,bar=20μm
连接,并且α-catenin缺失可导致ALCAM向细胞质定位,从而获得侵袭表型。在TPC-1细胞中沉默TFF3后,细胞胞质中ALCAM显著降低。Lunter等[21]指出ALCAM可能通过调控MT1-MMP来影响MMP-2的活化,从而影响MMPs(基质金属蛋白酶)的激活。目前,对于甲状腺癌细胞侵袭研究多集中在MMP-2和MMP-9上,Selemetjev等[22]指出MMPs特别是MMP-9可以通过增强VEGF-C作用促使TPC-1细胞向淋巴结转移。在敲低TFF3组中,MMP-2和MMP-9低表达,提示沉默TFF3表达降低TPC-1细胞降解基底膜和胞外基质的能力,降低癌细胞转移能力,这与Lunter等[21]研究一致。
3.2 TFF3对WNT/β-catenin信号通路的作用
WNT/β-catenin信号通路是调控细胞正常发育过程的重要信号通路之一,在癌细胞黏附、运动、生长等过程中发挥调控作用[23]。WNT/β-catenin信号通路未激活时,β-catenin在细胞膜表面表达极低,参与细胞间的黏附过程[6]。这一通路激活的标志是β-catenin异常积累并向细胞核内转移。在甲状腺乳头状癌TPC-1细胞中β-catenin主要在细胞核和胞质内表达,但在沉默TFF3组β-catenin在胞核和胞质内表达明显降低。另有文献报道E-cadherin表达减少可以引起β-catenin向细胞核内转移,同时激活WNT/β-catenin信号通路[24]。我们认为沉默TFF3肿瘤细胞黏附能力改变,与WNT/β-catenin信号通路有关,这与之前Raja等[25]的研究一致。
综上所述,沉默TFF3可以增强TPC-1细胞之间的同质黏附能力,降低TPC-1细胞与基底膜的黏附的异质能力,并且TFF3可能通过WNT/β-catenin信号通路影响TPC-1细胞黏附分子ALCAM、E-cadherin及降低MMPs的表达影响黏附能力,抑制淋巴结转移。

