芍药苷对大鼠术后肠粘连影响及其作用机制探讨
常 琦 刘 涛 张 磊 高 琪
术后肠粘连是腹腔手术后最为常见的并发症,发生率约93%[1]。肠粘连最常见的并发症是肠梗阻,其次会引起育龄妇女不育。目前预防术后肠粘连形成的药物或材料较多,如各种形式的膜类材料、粘性胶和腹膜内溶液类及中药制剂等。但是能有效地预防术后肠粘连形成的材料仍然缺乏[2]。研究[3]显示,芍药苷可通过降低炎症反应而减轻关节炎,故本研究通过构建肠粘连模型,评估粘连形成结局,检测术后的转化因子-β(transforming growth factor-β,TGF-β)、白介素-8(interleukin 8,IL-8)的表达量,明确芍药苷是否可通过降低炎症反应减轻术后粘连形成,为临床提供参考。
1 材料与方法
1.1 材料 选取健康雄性大鼠40只,3周龄,体质量为(130.00±10.00)g(购于延安大学实验动物中心);TGF-β、IL-8 ELISA试剂盒购自武汉建成生物科技公司;TGF-β、IL-8抗体购自Sigma公司购买;明质酸钠盐购自上海华源生命科学研究开发有限公司;芍药苷购自上海麦克林生物科技公司;其余实验器材均共享自延安大学基础实验室。
1.2 方法
1.2.1 实验动物分组 采用电脑编号随机抽取大鼠,分为空白对照(Sham)组、对照组(Control)组、透明质酸钠盐(Hyaluronate)阳性对照组(HA组)以及芍药苷组(Paeoniflorin)4个组;每组大鼠为10只。
1.2.2 造模及给药 术前3天将4组动物放入饲养室中,使动物习惯饲养环境,手术前晚禁食不禁水;采用戊巴比妥麻醉,麻醉剂量为40 mg/kg,麻醉后所有动物剃毛消毒,无菌下进行手术。Sham组正常开腹后找到盲肠向外拉出然后放回;其余3组均参照李培宁教授[4]的盲肠摩擦+对应腹壁损伤模型进行肠粘连造模,即进行盲肠无菌湿纱布摩擦,均匀摩擦致浆膜破损出现微小出血点;对应腹壁使用手术刀片刮损直至壁层腹膜破损。HA组完成造模后于摩擦面给予HA 10 mg(浓度为10 mg/mL)。造模完成后逐层关闭腹腔。芍药苷组造模完成后麻醉清醒即通过灌胃给予60 mg/(kg·d)芍药苷。芍药苷的给药剂量与方式, 参照文献[5-6]并结合芍药苷毒理学剂量。
1.3 观察指标 构建大鼠模型后第10天二次剖腹,按照Evans[5]的标准对各组粘连进行分级后并评分;通过病理分析各组炎症渗出情况;比较各组GF-β、IL-8的表达水平。
1.3.1 粘连评分及标本采集 术后第10天,采取U型开腹,观察粘连形成情况。由2位非直接参与实验人员参照文献[5]对粘连进行分级后并评分。0分:无粘连;1分:1 ~ 2处轻微粘连, 轻拉即开;2 分:2处以上粘连, 尚能分离,分离后不留痕迹;3分:多处粘连, 较难分离或粘连虽不多, 但不能分离;4 分:粘连成团, 不能分离。评分完毕后进行粘连标本采集,将标本直接放入-80℃冰箱保存备用;取腹主动脉血用于检测细胞因子。
1.3.2 病理学分析炎症渗出 常规石蜡切片HE染色,光镜观察粘连组织中炎症细胞等病理参数的变化情况;每只大鼠粘连组织切5张切片,随机选取2张切片,其中每张切片随机选取3个高倍视野(20×10)进行评分,参照Saber法[6]对每只大鼠切片进行评分。炎症评分:1分,无炎症反应细胞;2分,镜下可见巨核细胞、淋巴细胞和浆细胞;3分,镜下可见巨核细胞、浆细胞、嗜酸性细胞和中性粒细胞;4分,镜下可见炎症细胞浸润和微小脓肿形成。纤维形成评分:0分,无纤维形成;1分,轻度纤维形成;2分,中度纤维形成;3分严重纤维形成。
1.3.3. TGF-β、IL-8的表达 采用蛋白质印迹(Western blot)定量分析TGF-β、IL-8的表达。取粘连组织40 mg充分研磨,RIPA裂解后常规使用BCA法蛋白定量。根据蛋白标准曲线统一上样量为40 μg,其他凝胶配置及溶液配置均参照试剂盒说明书。设置电压浓缩胶:75 V 30 min;分离胶恒压110 V 1.5 h;一抗TGF-β浓度为1∶800、IL-8浓度为1∶500;最后进行Image Lab(美国)发光、图像采集及数据处理。

2 结果
2.1 4组大鼠术后肠粘连的分级及评分比较 术后第10天,肉眼观察Control组大鼠有大量的肠粘连出现,创面与小肠、腹壁间粘连广泛,粘连组织致密,难以分开;Sham组中伤口周围有部分肠粘连,无其他粘连;HA与Paeoniflorin(芍药苷)组肠粘连显著减少,而Paeoniflorin组肠粘连较HA组较少(见图1)。Control组大鼠粘连等级都在3~4级,平均评分为(3.43±0.35)分;Sham组粘连等级在1~2级,平均评分为(1.33±0.41)分;HA组中粘连等级在2~3之间,评分为(2.13±0.61)分;芍药苷组中粘连等级为1~2级,平均评分为(1.81±0.44)分,与Control组比较,差异有统计学意义(P<0.05),详见图2。


图1 术后各组大鼠肠粘连情况对比
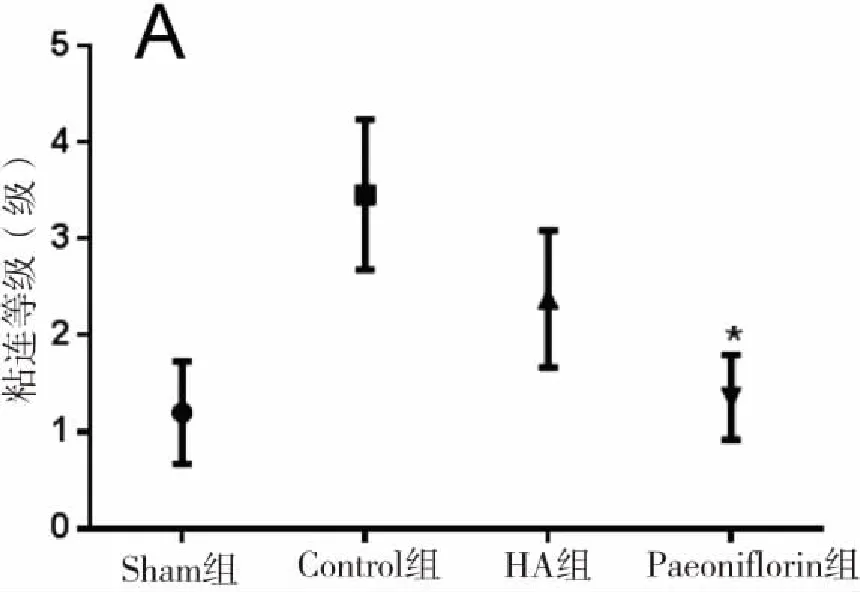

图2 术后各组粘连的评分
注:A为术后粘连等级图;B为术后粘连评分图;*本组与Control组比较差异有统计学意义(P<0.05)
2.2 4组大鼠炎症渗出比较 通过病理分析各组大鼠炎症渗出,结果显示Control组粘连组织中有大量的炎症细胞渗出,有新生的毛细血管产生;在Sham组中无炎症细胞渗出;在HA组中炎症细胞中等渗出;Paeoniflorin组中炎症较Control组显著降低,并且优于HA组,详见图3、4。
2.3 TGF-β、IL-8的表达水平及定量分析 采用ELISA检测TGF-β、IL-8的表达,结果显示Paeoniflorin组中TGF-β、IL-8的表达水平明显降低,与对照组比较,差异有统计学意义(P<0.05),详见图5。采用Western blot定量分析TGF-β、IL-8水平,结果显示在Paeoniflorin组中TGF-β、IL-8的表达水平降低,与血中TGF-β、IL-8的表达结果一致,详见图6。

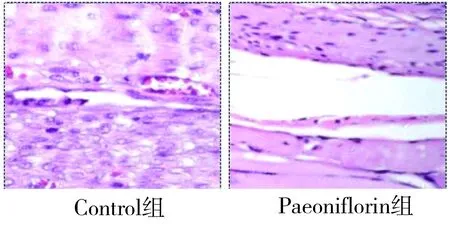
图3 术后各组炎症病理(HE×200)

图4 术后各组HE染色炎症评分
注: *表示与对照比较,差异有统计学意义(P<0.05)
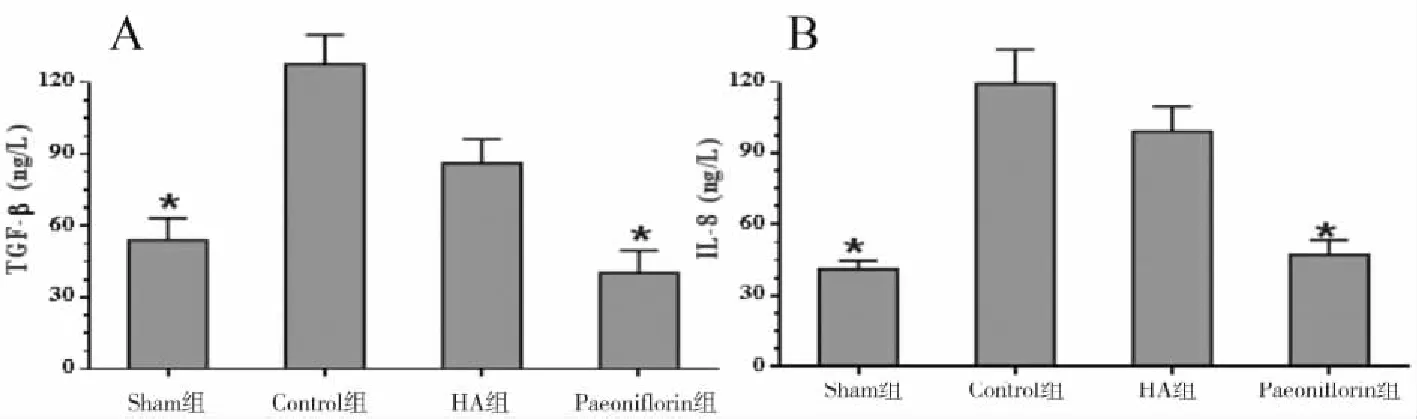
图5 ELISA分析术后炎症因子TGF-β与IL-8
注:A为术后各组GTF-β含量的变化;B为术后各组IL-8含量变化。*与对照比较,差异有统计学意义(P<0.05)

图6 Western blotting定量分析炎症因子TGF-β与IL-8
3 讨论
腹膜间皮细胞受损后其修复是一个复杂的过程。当敏感的间皮细胞受到打击或局部手术创伤后则有一系列血管反应事件随之而来,最终导致炎症和组织修复[7]。在创伤愈合中炎症细胞因子在纤维蛋白沉积和降解的平衡中是至关重要的。炎症细胞因子的总体作用是改变纤维蛋白沉积和降解的平衡,并有利于纤维形成,其中TGF-β以及IL-8在此过程中发挥重要的作用。
TGF-β是一种强效的细胞因子,具有调节、启动以及终止组织修复的作用[8-9]。在粘连的形成中,无论是在动物模型还是体外实验,TGF-β是目前研究较为明确的炎症细胞因子之一。研究[10-11]显示,在动物模型中,术后创面使用重组TGF-β试剂后,粘连显著增加;使用TGF-β抑制剂后粘连显著降低。手术创伤后TGF-β受体在腹膜组织以及腹膜积液中显著升高。TGF-β过度表达可直接致组织纤维化,促进纤维粘连的转化[8]。因此,可能会降低早期纤维素渗出的溶解能力,最终导致纤维堆积及胶原沉积促进粘连形成。由此可见,TGF-β是主要的纤维蛋白溶解抑制剂以及纤溶酶原激活物抑制剂。因此,通过抑制TGF-β表达则可促进纤维溶解,降低胶原沉积,最终减轻肠粘连的形成。
IL-8由腹膜间皮分泌,是炎症细胞高度选择性趋化因子[12],可以激活嗜中性粒细胞脱粒。受损的间皮细胞分泌IL-8后促进炎症细胞的进一步聚集[13]。间皮细胞分泌IL-8后可刺激TNF- α和IL-1的分泌,升高的TNF- α具有较强的抑制腹膜纤溶活性。与无胃肠道穿孔的患者相比,有穿孔患者其腹腔液中IL-8浓度在手术时增加100倍[14-15]。IL-8在术后粘连形成的作用的具体机制仍不清楚,可能是通过升高TNF- α及炎症渗出促进纤维形成最终导致粘连形成。
此外,中医药的理论在调理术后机体胃肠道功能及抑制术后腹腔粘连方面具有确切的疗效,越来越多的理念被引入术后康复中[16]。芍药同时具有活血祛瘀作用,可改善肠壁循环,促进肠壁水肿消退和粘连吸收, 增强肠蠕动,从而减少创面间的接触时间,降低了创面间的纤维沉积。
本实验显示,芍药苷显著降低了TGF-β、IL-8表达水平,使用芍药苷后粘连组织炎症渗出、粘连程度明显低于模型对照组, 说明芍药苷对TGF-β、IL-8的表达具有抑制效果,具有良好的抗炎效应,从而减轻术后粘连的形成。TGF-β、IL-8的高表达与纤溶抑制以及纤维形成紧密相关,本研究显示,术后使用芍药苷粘连形成明显减少,实验组大鼠术后粘连组织中的TGF-β、IL-8表达量均显著低于对照组(P<0.05)。表明芍药苷预防大鼠术后肠粘连的作用机制可能是抑制TGF-β、IL-8的过度表达、降低纤维蛋白的形成、促进纤溶活性、减少胶原沉积,最终发挥减轻术后肠粘连的作用效果。
综上所述,术后使用芍药苷可能通过降低炎症反应与纤维形成致胶原过度沉积,进而减轻术后腹腔粘连的形成,芍药苷将有望成为预防腹腔粘连的新方向。

