阿克苏地区枣黑斑病菌 PCR 检测方法的建立与应用
白剑宇,毕司进,宋峰惠,史彦江
(1.新疆林业科学院经济林研究所,乌鲁木齐 830063;2.新疆农业大学农学院,乌鲁木齐 830052)
0 引 言
【研究意义】阿克苏地区枣黑斑病病原为链格孢菌(Alternariaalternate)[1]。该病原菌致病性强,传播迅速,具有爆发性的发生特点,常常在枣果和叶片上形成黑斑,病果果肉变褐色,并向内部延伸。枣黑斑病潜伏期长,在未表现出症状的情况下,直接观察会提供错误判断,而病原菌的形态学鉴定又容易受人为因素和环境条件的干扰,加之传统的分类鉴定方法熬时长、程序繁琐,不适合快速检测的要求,很难实现对病害发生动态的及时监测和有效控制病原菌的传播和病害流行。建立快速、准确的枣黑斑病菌(A.alternata)分子检测技术,对于探索病害防控的关键点以及制定适时有效的防治措施具有重要的理论和实际意义。【前人研究进展】自林忠敏等[2]报道了山西省枣果上发生了一种新病害,并命名为枣黑斑病以来,该病在山东、河北等[3-4]省市相继发生,且病原种类与新疆发生的枣黑斑病的致病病原存在差异,报道的病原包括细菌中的黄单胞杆菌属(Xanthomonas)和假单胞杆菌属细菌(Pseudomonas)[5],真菌中的桑壳小圆孢菌(Coniothyriumfucsidμlum)、仁果茎点霉(Phomapomirum)、链格孢(Alternariaalternata)、细极链格孢(Alternariatenuissima)和茎点霉属(Phomasp.)等[6-10]。自2008年以来,在新疆发生枣黑斑病主要危害枣树的果实,其次为枣树的叶片和花期,致病病原主要为A.alternaria和A.tenuissima两种[11-13]。2016年白剑宇等[1]对阿克苏地区发生的枣黑斑病,采用形态学观察、致病性实验和分子生物学相结合的鉴定技术,对致病病原进行了准确鉴定,明确了阿克苏地区枣黑斑病的致病病原为A.alternaria。【本研究切入点】研究阿克苏地区枣黑斑病菌 PCR 检测方法的建立与应用。【拟解决的关键问题】研究在准确鉴定病原(A.alternata)基础上,利用文献公布的A.alternata热休蛋白基因基因特异性引物,通过PCR反应体系优化后的引物特异性扩增与灵敏度的检测,建立枣黑斑病菌(A.alternata)的分子检测技术,利用该技术在红枣整个生育期对疑似枣黑斑病菌侵染的枣树叶片和果实样本进行病原菌的田间追踪检测,并针对落叶、落果、枯枝等病残体及土壤是否携带链格孢菌进行快速准确的检测与分析。通过病害田间侵染动态和越冬场所的分子检测与验证,研究枣黑斑病的田间侵染动态,分析病害防治的最佳时间,阐明枣黑斑病病原菌的越冬场所,为阿克苏地区枣黑斑病的流行监测和早期防治提供理论依据和技术支持。
1 材料与方法
1.1 材 料
1.1.1 供试菌株
枣黑斑病菌(A.alternata)为新疆林科院经济林研究所鉴定保存的菌株;用于引物特异性检测的其它7个真菌菌株由新疆农业大学植物病理实验室保存并提供,包括由芸苔生链格孢(Alternariabrassicae)、瓜链格孢(Alternariacucumerina)、长喙链格孢(Alternarialongirostrata)、细极链格孢(Alternariatenuissima)、侵染链格孢(Alternariainfectoria)、米曲霉(Aspergillusoryzae)和灰绿青霉(Penicilliumglaucum)。
1.1.2 供试引物
参考Margaret T. Mmbaga等[14]依据链格孢菌(A.alternata)的热休克蛋白(Hsp70)序列(GenBank 登录号:U87808)设计的特异性引物aa-hsp-f1:ATCTCTGCTAAGA- ACGCT CTCG,aa-hsp-r2:ACCAGCTCCGTAGAACTTC ATC,产物大小为237 bp,由北京鼎国生物工程技术有限公司合成。
1.1.3 主要试剂和仪器
美国伯乐公司BIO-RAD T100 PCR仪购自美国伯乐中国上海分公司;DNA产物纯化试剂盒、琼脂糖凝胶DNA回收试剂和质粒提取试剂盒以及2×PCR反应液等试剂购自天根生化科技有限公司。
1.2 方 法
1.2.1 供试菌株培养
将各供试菌株在PDA平板上培养3~5 d,用打孔器打成直径4 mm的菌饼,转入灭菌后的马铃薯液体培养基中震荡培养5 d,抽滤后冻干保存备用。
1.2.2 DNA提取与引物的特异性检测
取震荡培养后冻干的各供试菌株菌丝适量,液氮研磨后,分别称取各菌株粉末50 mm,转入2 mL离心管中。采用 CTAB 法提取总 DNA(Lee & Taylor,1990;孟鹤等,2011)作为 PCR模板,对引物(aa-hsp-f1)/(aa-hsp-r2)进行特异性检测。PCR 反应体系(25 μL):10 μmol/L的上、下游引物各1 μL,10×Buffer 2.5 μL,Taq酶 0.5 μL,模板 DNA 1 μL,dd H2O 19 μL。PCR 反应条件:95 ℃,10 min;94 ℃,1 min,60 ℃,45 s,72 ℃,2 min,35 个循环;72 ℃延伸 10 min。
1.2.3 引物灵敏性检测
将枣黑斑病菌(A.alternata)基因组 DNA 用紫外分光光度计测定浓度后,按10倍梯度稀释109、108、107、106、105、104、103、102、10、1cfu/mL系列浓度,采用已建立的PCR体系进行扩增,检测引物对(aa-hsp-f1)/(aa-hsp-r2)的灵敏度。
1.2.4 枣黑斑病田间发生动态追踪检测
以阿克苏市依杆旗乡8大队2组红枣种植园、温宿县万亩枣园和阿瓦提县多浪乡红枣示范园,3个历年枣黑斑病发生较重的枣园为样品采集和检测地点,枣树品种均为骏枣,树龄分别为7a、9a和10a。自每年枣树展叶起,分别于5月、6月、7月、8月、9月和10月采集疑似枣黑斑病果实和叶片样品各50份,提取各样品总DNA,利用已建立的PCR分子检测体系,进行枣黑斑病菌田间发生动态的追踪检测。表1
1.2.5 病原菌越冬场所的分子检测
2016年分别与秋冬两季收集枣园中的枣树树上和树下落叶、落果等病残体及冠下表层土壤样本各25份,依据植物及土壤DNA提取试剂盒操作说明分别提取样本总DNA,作为 PCR 反应模板。利用已建立的枣黑斑病菌分子检测技术,针对各样本是否携带枣黑斑病菌进行快速检测。
2 结果与分析
2.1 引物的特异性检测
以灭菌后的双蒸水为阴性对照,以 10 个供试菌株的基因组 DNA 为模板,检测(aa-hsp-f1)/(aa-hsp-r2)引物的特异性,结果表明,以枣黑斑病菌(A.alternata)DNA 为模板,可以稳定地扩增出 237 bp 的单一片段(图13),其它6个菌株均未扩增出条带,且目的片段条带明亮,扩增稳定性及特异性好。
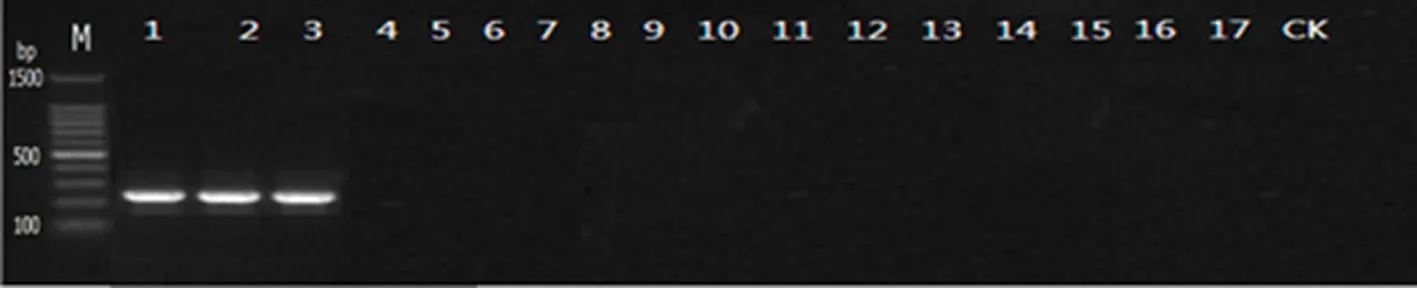
注:M:100 bp Marker;1~3:链格孢菌;4~5:芸苔生链格孢;6~7:瓜链格孢;8~9:长喙链格孢;10~11:细极链格孢;12~13:侵染链格孢;14~15:米曲霉;16~17;CK:阴性对照。
Note: M: 100 bp Marker; 1-3:A.alternata; 4-5:Alternariabrassicae; 6-7:A.cucumerina; 8-9:A.longirostrata; 10-11:A.tenuissima; 12-13:A.infectoria; 14-15:Aspergillusoryzae; 16-17:Penicilliumglaucum; CK: Negative control
图1 枣黑斑病菌引物的特异性PCR检测扩增结果
Fig.1 The amplification results of black spot of jujube by PCR
2.2 引物的灵敏性检测
枣黑斑病菌(Alternariaalternata)DNA 分光光度计测定浓度为488.6 ng/μL ,将初始 DNA 按10倍梯度稀释至 10-5(4.886 pg/μL)仍能检测到 DNA 的存在,说明(aa-hsp-f1)/(aa-hsp-r2)引物用于 PCR 检测枣黑斑病菌时具有较高的灵敏度,可以用于枣黑斑病菌的田间发生动态的追踪检测和病原菌越冬场所的检测与验证。图2
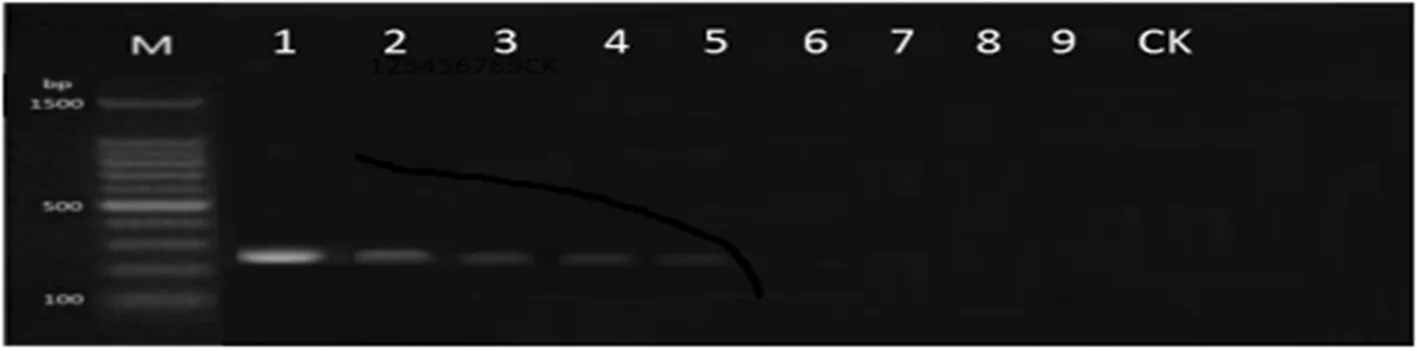
注:M:DNA Marker;1~9:DNA 依次稀释梯度为 1~10-9;CK:阴性对照
Note: M: DNA Marker; 1 ~ 9: Serial dilution of DNA 1-10-9; CK: Negative control
图2 枣黑斑病菌普通 PCR引物灵敏性检测
Fig.2 Sensitivity detection of common PCR primer in black spot pathogen of jujube
2.3 枣黑斑病田间发生动态的追踪检测
研究表明,在不同年份不同地块采集的病害样本中均可检测到枣黑斑病菌的存在,且随着月份的增加,病原菌检出率呈升高趋势。其中5~6月采集的枣树叶片样本的病菌检出率相对较低,最高检出率为40%,最低检出率为8%,而在7~10月采集的叶片样本中病害检出率相对较高,最高检出率为76%,最低检出率为44%;7~8月采集的枣树果实样本的病菌检出率相对较低,最高检出率为44%,最低检出率为8%,而在7~10月采集的叶片样本中病害检出率相对较高,最高检出率为78%,最低检出率为52%。表1
表1 样品材料及枣黑斑病田间发生动态检测结果
Table 1 Specimen materials and the detection results of dynamic condition of black spot of jujube in field
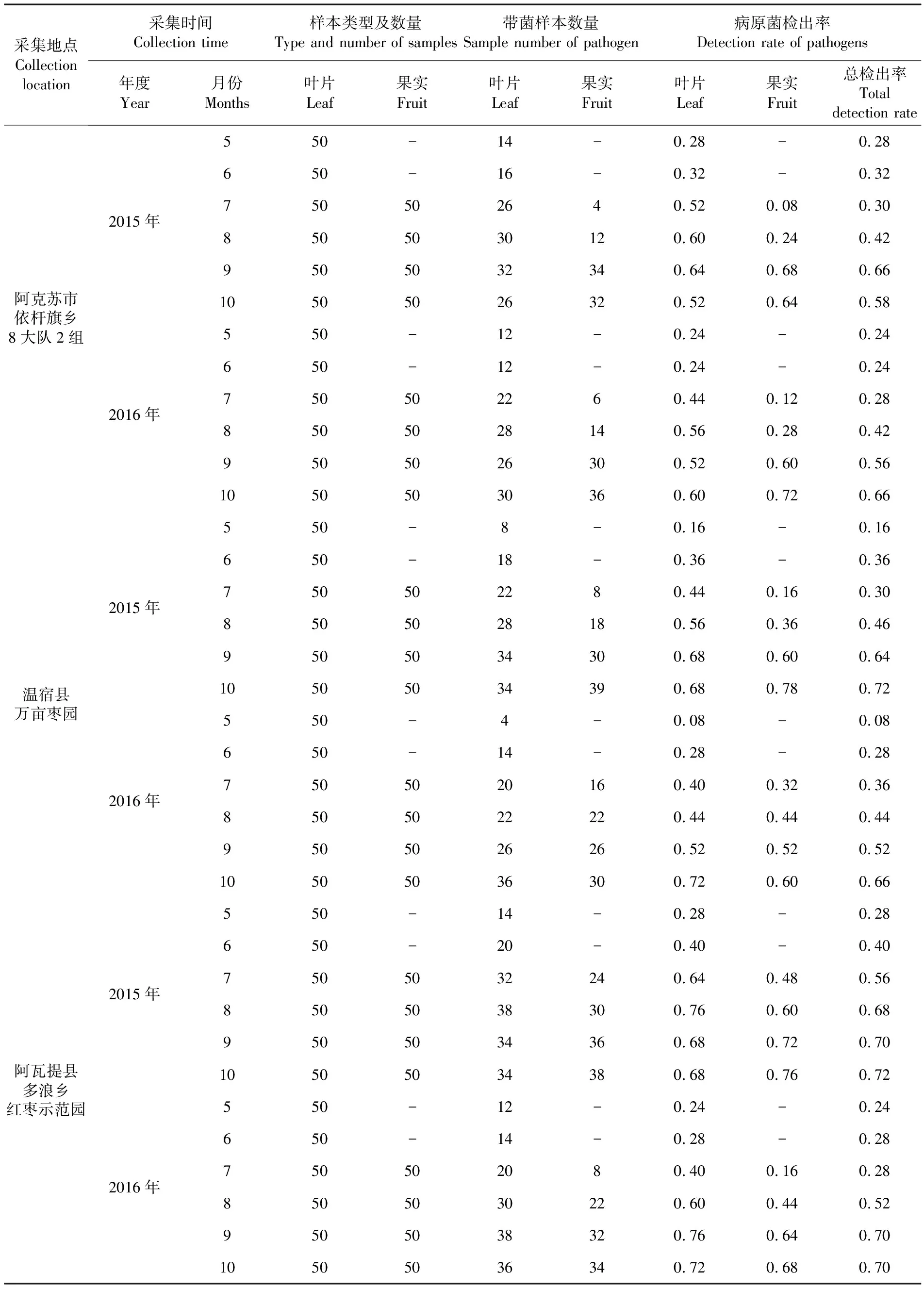
采集地点Collection location采集时间Collection time样本类型及数量Type and number of samples带菌样本数量Sample number of pathogen病原菌检出率Detection rate of pathogens年度Year月份Months叶片Leaf果实Fruit叶片Leaf果实Fruit叶片Leaf果实Fruit总检出率Total detection rate阿克苏市依杆旗乡8大队2组2015年2016年550-14-0.28-0.28650-16-0.32-0.32750502640.520.080.308505030120.600.240.429505032340.640.680.6610505026320.520.640.58550-12-0.24-0.24650-12-0.24-0.24750502260.440.120.288505028140.560.280.429505026300.520.600.5610505030360.600.720.66温宿县万亩枣园2015年2016年550-8-0.16-0.16650-18-0.36-0.36750502280.440.160.308505028180.560.360.469505034300.680.600.6410505034390.680.780.72550-4-0.08-0.08650-14-0.28-0.287505020160.400.320.368505022220.440.440.449505026260.520.520.5210505036300.720.600.66阿瓦提县多浪乡红枣示范园2015年2016年550-14-0.28-0.28650-20-0.40-0.407505032240.640.480.568505038300.760.600.689505034360.680.720.7010505034380.680.760.72550-12-0.24-0.24650-14-0.28-0.28750502080.400.160.288505030220.600.440.529505038320.760.640.7010505036340.720.680.70
2.4 病原菌越冬场所的分子检测
利用已建立的枣黑斑病菌分子检测技术,针对冬春两季收集的枣树树上、树下残留的病叶、病果及冠下表层土壤样本是否携带枣黑斑病菌进行快速的检测,研究表明,冬、春两季采集的病果、病叶及枣树冠下表层土壤等病残体均能检测到枣黑斑病菌的存在,三者之间带菌率存在明显差异,其中病果带菌率远高于病叶及表层土壤带菌率,表层土壤样本带菌率最低。冬季病残体及表层土壤样本总带菌率略高于春季样本的总带菌率,其中冬季树上病果的带菌率在68%~96%,树下病果的带菌率在80%~92%;春季树上病果的带菌率在76%~84%,树下病果的带菌率在80%~92%,而病叶无论树上还是树下样本,其带菌率均较低,最高带菌率为56%,最低带菌率为24%。枣树冠下表层土壤的带菌率最高为56%,最低带菌率为36%,而以树上残留的健康枣果和叶片均未检测到枣黑斑病菌的存在。表2
表2 枣黑斑病样品材料及越冬场所分子检测结果
Table 2 Specimen materials and the detection results of overwinter sites of black spot of jujube in field

采集地点Collection location样本类型Types of samples样本数量Number of samples带菌样本数量Sample number of pathogen病原菌检出率Detection rate of pathogens (%)总检出率(%)Total detection rate冬季春季阿克苏市依杆旗乡8大队2组冬季树上残留病果252496冬季树上残留病叶25936冬季树下残留病果252288冬季树下残留病叶251456冬季冠下表层土壤251352春季树上残留病果252184春季树上残留病叶25624春季树下残留病果252392春季树下残留病叶251352春季冠下表层土壤25145665.661.6温宿县万亩枣园冬季树上残留病果252080冬季树上残留病叶251144冬季树下残留病果252080冬季树下残留病叶251560冬季冠下表层土壤251352春季树上残留病果251976春季树上残留病叶25832春季树下残留病果252184春季树下残留病叶25728春季冠下表层土壤25114463.252.8阿瓦提县多浪乡红枣示范园冬季树上残留病果251768冬季树上残留病叶25728冬季树下残留病果252392冬季树下残留病叶251144冬季冠下表层土壤251144春季树上残留病果251976春季树上残留病叶25728春季树下残留病果252080春季树下残留病叶25936春季冠下表层土壤2593655.251.2
3 讨 论
在南疆红枣生产过程中,由链格孢菌(A.alternata)引起的枣黑斑病不仅危害枣果,而且危害枣树叶片和花器,受害果实多在枣果泛白期开始显症,而泛白期前病害症状不明显,通常忽略前期对枣黑斑病的防治,仅在枣果显症期进行防治,致使防治效果很难达到预期的目标。因此,利用分子检测技术开展枣黑斑病的早期监测,探索病害防治的关键时间节点显得尤为重要。Margaret T. Mmbaga等[14]依据链格孢菌(A.alternata)的热休克蛋白(Hsp70)基因序列设计出特异性引物,建立了针对A.alternata常规PCR检测技术来鉴定和检测病原菌。试验在此基础上利用引物对(aa-hsp-f1)/(aa-hsp-r2)对枣黑斑病菌进行的常规PCR扩增,扩增片段大小为237 bp,检测的灵敏度达到4.886 pg/μL,而且引物对(aa-hsp-f1)/(aa-hsp-r2)存在于热休克蛋白基因片段内,高度保守,不仅特异性强而且灵敏度高,具有实际可操作性,可作为枣黑斑病田间发生动态的追踪检测。
在枣黑斑病菌田间追踪检测研究中,发现枣黑斑病菌自5月开始侵染枣树叶片,随着枣树的生长发育,叶片发生率逐渐升高,7~8月达到侵染高峰,这一定与王兰等研究结果一致。在针对不同时期采集的枣果样品的检测中,发现枣黑斑病菌在果实泛白期前便可检测到,由此说明病原菌在枣果泛白期已开始侵染,但仍处于潜伏期,没有明显发病症状,直到8月开始显症,9~10月开始大量显症,这与部分研究报道结果一致。但在病害调查和样品采集中,每年的7月在枣园树势较弱的枣树叶片和果实上均可采集到一种症状不同与枣黑斑病症状(黑色圆斑)的枣树病害,经PCR检测,病原依然是A.alternata,这还需要进一步的研究确认。
通过对冬、春两季枣园中病残体及冠下表层土壤等样本的检测,发现枣黑斑病病菌在病果、病叶及冠下表层土壤中均可检测出枣黑斑病的存在,其中病果检出率最高,其次是病叶和冠下表层土壤,三者均为枣黑斑病的越冬场所。因此,及时针对越冬场所等传染源进行综合处理,可作为预防和减轻病害发生程度的有效手段。此外,应用建立的分子检测技术开展枣黑斑病的田间侵染动态追踪检测,能为枣黑斑病的适时开展高效防治提供科学依据。
4 结 论
4.1 依据Margaret T. Mmbaga等报道的链格孢菌(A.alternata)的热休克蛋白基因特异性引物对(aa-hsp-f1)/(aa-hsp-r2),通过引物特异性验证和灵敏度检测建立了阿克苏地区枣黑斑病菌(A.alternata)的常规PCR分子检测技术,该检测技术特异性强,灵敏度高,具有实际可操作性,检测灵敏度达到4.886 pg/μL ,可运用于枣黑斑病田间发生动态的追踪检测。
4.2 枣黑斑病菌自枣树展叶期开始侵染枣树叶片,7~8月达到侵染高峰,后期叶片危害减轻。枣果在果实泛白前就已开始受到枣黑斑病原菌侵染,但仍处于潜伏期,没有明显发病症状,在果实泛白期开始显症,9~10月以后开始大量显症,果实受害严重。
4.3 果实采收后枣黑斑病菌主要以病叶、病果等病残体和表层土壤越冬,其中病果带菌率最高,病叶和冠下表层土壤带菌率较低,但仍然是枣黑斑病病原菌的越冬场所。

