SIRT2沉默对胃癌SGC-7901细胞增殖、迁移和侵袭的影响
牛虹,杨峰,唐静雯,田同德,李华华,岳光星,范伊晓,周浩本
SIRT2沉默对胃癌SGC-7901细胞增殖、迁移和侵袭的影响
牛虹,杨峰,唐静雯,田同德,李华华,岳光星,范伊晓,周浩本
450008 郑州大学附属肿瘤医院中西医结合肿瘤内科
探究沉默信息调节蛋白 2(SIRT2)对人胃癌 SGC-7901 细胞增殖、迁移和侵袭的影响及机制。
采用实时荧光定量 PCR(qRT-PCR)检测 SIRT2 在胃癌 SGC-7901 细胞和正常胃上皮 GES-1 细胞中的表达。采用 RNA 干扰技术处理 SGC-7901 细胞,SIRT2 沉默组转染靶向 SIRT2 的干扰小 RNA(SIRT2-siRNA1 组、SIRT2-siRNA2 组),阴性对照组转染 SIRT2-siRNA 阴性对照序列,空白对照组不转染。CKK-8 法和平板细胞克隆形成实验检测 SGC-7901 细胞增殖,Transwell 法检测 SGC-7901 细胞侵袭迁移能力,蛋白印迹检测 SGC-7901 细胞中 SIRT2、丝氨酸/苏氨酸蛋白激酶(Akt)和磷脂酰肌醇-3 激酶(PI3K)蛋白表达。
人胃癌细胞 SNU-1、KATO III、SGC-7901 中SIRT2 mRNA 和蛋白水平均高于正常胃上皮 GES-1 细胞(< 0.05)。转染SIRT2-siRNA 的 SGC-7901 细胞中SIRT2 mRNA 和蛋白水平均低于阴性及空白对照组(< 0.05);转染SIRT2-siRNA 后,SGC-7901 细胞增殖能力、克隆形成能力、迁移和侵袭能力均降低(< 0.05);转染SIRT2-siRNA 后SGC-7901 细胞中 Akt、PI3K 蛋白磷酸化程度显著下降(< 0.05)。
SIRT2 在胃癌细胞中表达上调,沉默 SIRT2 可能通过调节 PI3K/Akt 通路抑制胃癌细胞增殖、迁移和侵袭,推测 SIRT2 可能作为潜在靶标应用于胃癌的基因治疗。
沉默信息调节蛋白 2; 胃癌; 增殖; 侵袭; 迁移
胃癌(gastric cancer,GC)是一类发生于胃黏膜上皮的恶性肿瘤,流行病学研究显示,GC 的发病率在世界范围内居第五位,死亡率居第三位[1]。虽然近年关于 GC 的检测和治疗技术取得很大改进,但 GC 患者的 5 年存活率仍很低,低于 30%[2]。由于 GC 患者早期无特异性症状,确诊时多数已进展至晚期,甚至转移至远端器官,研究显示,转移是导致GC 患者死亡的重要原因[3],然而影响胃癌转移的机制尚不完全明确。因此,探究胃癌的转移、进展机制,有利于筛选更有效的治疗分子靶点,对于延长 GC 患者存活时间,改善预后具有重要意义。沉默信息调节蛋白 2(sirtuin-2,SIRT2)是组蛋白去乙酰化酶家族的一员,参与调解氧化应激、细胞程序性死亡等生物过程[4-5]。Hoffmann 等[6]研究发现,抑制 SIRT2 表达可明显促进非小细胞肺癌细胞的凋亡,降低迁移和侵袭能 力,然而目前尚缺少 SIRT2 对胃癌细胞的影响相关研究。本文在上述研究基础上,通过转染靶向作用于 SIRT2 的干扰小 RNA(siRNA),观察沉默 SIRT2 对胃癌细胞增殖、迁移和侵袭的影响,并初步探讨其机制,以期为胃癌的临床诊疗提供一定参考。
1 材料与方法
1.1 实验材料
人胃癌细胞系 SNU-1、KATO III、SGC-7901 细胞和人正常胃上皮 GES-1 细胞购自中国科学院细胞库;胎牛血清和 RPMI-1640 培养基购自美国ThermoFisher 公司;LipofectamineTM3000 转染试剂盒购自美国 Invitrogen 公司;AceQ®qPCR SYBR®Green Master Mix、Trizol 试剂、蛋白提取试剂购自南京诺唯赞生物科技有限公司;Transwell 小室购自美国 BD 公司;SIRT2-siRNA1、SIRT2-siRNA2、SIRT2-siRNA阴性对照(negative control,NC)序列,由生工生物工程(上海)股份有限公司合成;兔源磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)抗体、兔源 p-PI3K 抗体、兔源丝氨酸/苏氨酸激酶(serine/threoninekinase,Akt)抗体、兔源 p-Akt 抗体和缀合辣根过氧化物酶(HRP)羊抗兔二抗购自美国 Abcam 公司。
1.2 方法
1.2.1 细胞培养 SNU-1、KATO III、SGC-7901 及 GES-1 细胞常温条件下复苏,采用加有 10% 胎牛血清的新鲜 RPMI-1640 进行培养,加入链霉素、青霉素,放入 CO2培养箱常规进行传代培养,每两天更换一次培养基。稳定2 ~ 3 代后,细胞处于对数生长期时,收集用于实验。每种细胞设置5 个重复。
1.2.2 细胞转染及分组 收集稳定传代的对数期 SGC-7901 细胞,加入胰蛋白酶进行消化,制备单细胞悬液,以 1 × 105个/孔密度接种于 6 孔培养板,培养至细胞融合达 80% 左右,更换为不含胎牛血清的新鲜RPMI-1640 培养基,遵循 LipofectamineTM3000 试剂盒操作说明进行转染。实验分四组:空白对照组:不对SGC-7901 细胞转染任何外源序列;阴性对照组:对SGC-7901 细胞转染终浓度为 100 nmol/LSIRT2-siRNA NC 序列;SIRT2-siRNA 1 组:对SGC-7901 细胞转染终浓度为 100 nmol/L SIRT2-siRNA1 序列;SIRT2-siRNA 2 组:对SGC-7901 细胞转染终浓度为 100 nmol/L SIRT2-siRNA2 序列,每组设置 5 个重复。转染后置于培养箱中常规培养 6 h,更换为加有 10% 胎牛血清的新鲜RPMI-1640 培养基继续培养 48 h。收集各组 SGC-7901 细胞,实时荧光定量(real time quantitative,qRT)-PCR和蛋白印迹(Western blot)检测转染效率。
1.2.3 CKK-8 法检测SGC-7901 细胞增殖 将各组 SGC-7901 细胞分别以 5000 个/孔密度接种至 96 孔板,培养 0、12、24、36、48、60、72 h 后,遵循 CKK-8 检测试剂盒操作说明进行实验,检测各孔细胞在 450 nm 波长下的光密度(),绘制生长曲线。
1.2.4 平板细胞克隆实验检测SGC-7901 细胞增殖 将各组 SGC-7901 细胞制备单细胞悬液,以1000 个/皿密度接种至加有 6 ml RPMI-1640 的培养皿中,移液枪轻轻吹打混匀,置于 CO2培养箱中培养,每 12 小时观察一次细胞生长情况。当肉眼观察到明显细胞克隆形成时,将培养皿取出,统计培养皿中形成克隆的细胞数量,计算 SGC-7901 细胞克隆形成率,每组设置 5 个重复。克隆形成率=(形成克隆的细胞数量/ 1000)× 100%。
1.2.5 Transwell 法检测SGC-7901 细胞迁移和侵袭 将 Transwell 小室放入 24 孔板,收集各组 SGC-7901 细胞制备单细胞悬液,以 10 000 个/孔密度接种于小室上层,小室下层加入 600 μl含胎牛血清RPMI-1640 培养基,于 CO2培养箱孵育 24 h,取出小室,清洗风干后,95% 乙醇固定,加入 0.5% 结晶紫染色 15 min,洗去多余染液,小心去除小室滤膜上层未迁移细胞,置于显微镜拍照并统计迁移至滤膜下层的细胞数量。细胞侵袭实验首先将小室 50 μl 2.0 mg/ml 基底胶加入小室上层,胶凝晾干后接种SGC-7901 细胞,后续步骤同迁移实验。每组设置 5 个重复。
1.2.6 Western blot 检测 PI3K、Akt 蛋白表达情况 将各组 SGC-7901 细胞收集,采用蛋白提取试剂盒提取各组细胞总蛋白,测定蛋白浓度。分别取适量蛋白加入十二烷基苯磺酸钠(SDS)煮沸后,上样,采用 8% ~ 10% SDS-聚丙烯(PAGE)胶分离不同分子量的蛋白质。采用半干转膜仪将蛋白质由 PAGE 胶转至硝酸纤维膜,加入 5% 脱脂牛奶常温封闭 25 min;分别加入 1:1000 稀释的一抗,4 ℃孵育过夜;洗去一抗后,分别加入 1:5000 稀释的羊抗兔二抗,常温孵育 45 min;洗去二抗后,加入化学发光液,采用 Tanon 软件拍摄图像,以目的蛋白条带灰度值/内参 GAPDH 条带灰度值表示目的蛋白相对表达量。
1.3 统计学处理

2 结果
2.1 SIRT2 在人胃癌细胞系中高表达
人胃癌细胞 SNU-1、KATO III、SGC-7901 中SIRT2 mRNA 和蛋白水平均显著高于正常胃上皮 GES-1 细胞(< 0.05),结果见图 1、表 1。
2.2 转染效果检测
阴性对照组 SGC-7901 细胞中SIRT2 mRNA 和蛋白水平与空白组比较,差异无统计学意义 (> 0.05);SIRT2-siRNA1 组、SIRT2-siRNA2 组 SGC-7901 细胞中SIRT2 mRNA 和蛋白水平均显著低于阴性及空白对照组(< 0.05),见图 2、表 2。
2.3 沉默 SIRT2 抑制 SGC-7901 细胞增殖
阴性对照组 SGC-7901 细胞增殖能力与空白组比较,差异无统计学意义(> 0.05);SIRT2-siRNA1 组、SIRT2-siRNA2 组 SGC-7901 细胞增殖能力显著低于阴性及空白对照组(< 0.05),结果见图 3。

图 1 SIRT2 在人胃癌细胞系中表达情况
Figure 1 SIRT2 expression in human gastric cancer cell lines



细胞系Cell lineSIRT2/GAPDH mRNAProtein GES-11.05 ± 0.221.08 ± 0.24 SNU-13.19 ± 0.61*2.08 ± 0.32* KATO III3.25 ± 0.71*2.11 ± 0.36* SGC-79014.59 ± 0.89*2.47 ± 0.48*
注:n = 5,与 GES-1 细胞比较,*< 0.05。
Note: n = 5, compared with GES-1 cells,*< 0.05.

图 2 转染 SIRT2-siRNA 对 SGC-7901 细胞 SIRT2 表达的影响
Figure 2 Effect of SIRT2-siRNA transfection on SIRT2 expression in SGC-7901 cells

表 2 转染 SIRT2-siRNA 对 SGC-7901 细胞SIRT2 表达的影响()
注:n = 5,与空白组比较,*< 0.05;与阴性组比较,#< 0.05。
Note: n = 5, compared with the blank group,*< 0.05; compared with the negative group,#< 0.05.
2.4 沉默 SIRT2 抑制 SGC-7901 细胞平板克隆形成
阴性对照组 SGC-7901 细胞平板克隆形成率与空白组比较,差异无统计学意义(> 0.05);SIRT2-siRNA1 组、SIRT2-siRNA2 组 SGC-7901细胞平板克隆形成率显著低于阴性及空白对照组(< 0.05),结果见表 3。
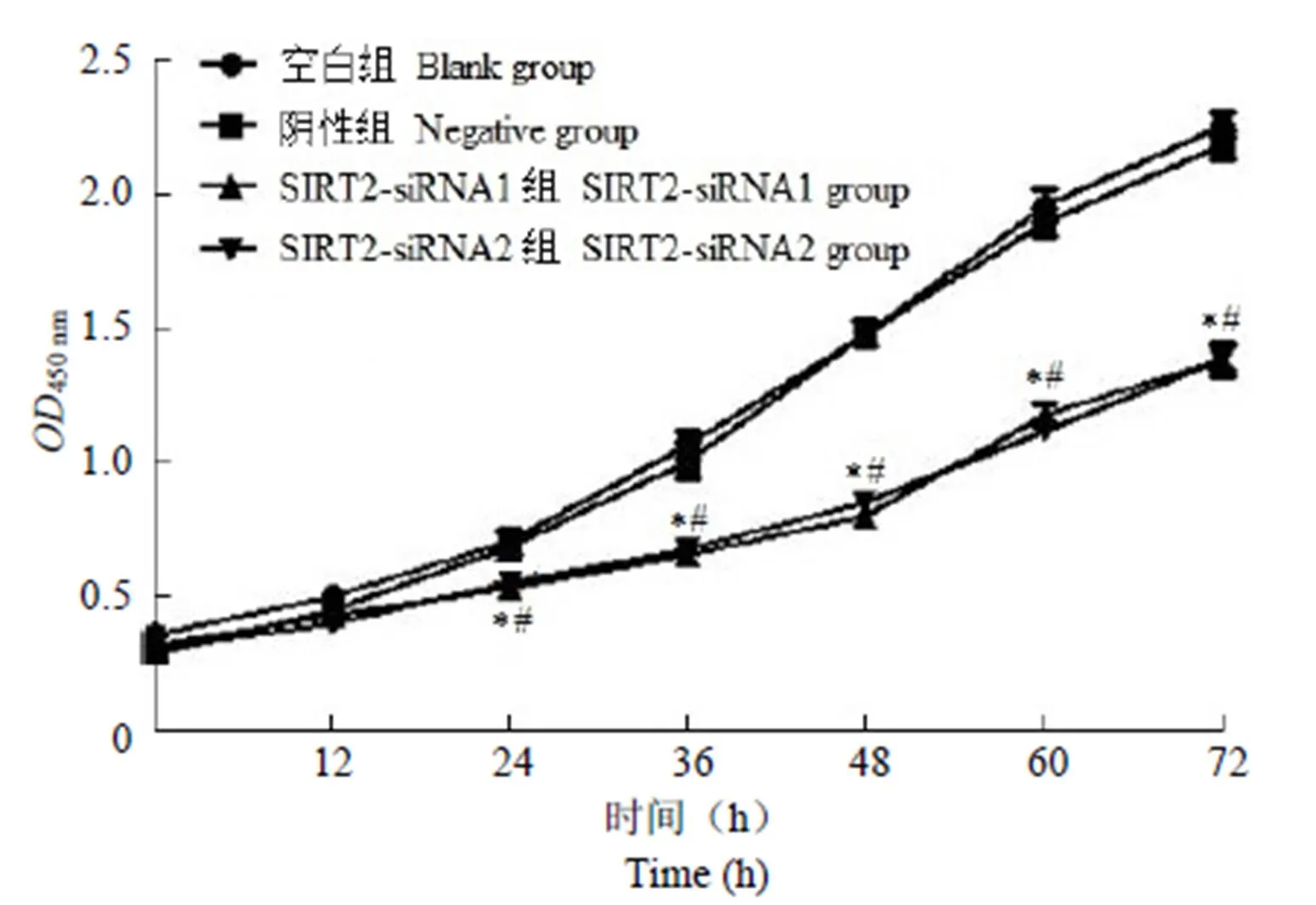
图 3 沉默 SIRT2 对SGC-7901 细胞增殖的影响(n = 5,与空白组比较,*P < 0.05;与阴性组比较,#P < 0.05)
Figure 3 Effect of silencing SIRT2 on the proliferation of SGC-7901 cells (n = 5, compared with the blank group,*< 0.05; compared with the negative group,#< 0.05)

表 3 沉默 SIRT2 对 SGC-7901 细胞平板克隆形成率的影响()
注:n = 5,与空白组比较,*< 0.05;与阴性组比较,#< 0.05。
Note: n = 5, compared with the blank group,*< 0.05; compared with the negative group,#< 0.05.
2.5 沉默 SIRT2 抑制 SGC-7901 细胞迁移、侵袭能力
如图 4 和表 4 所示,阴性对照组发生迁移和侵袭的 SGC-7901 细胞数量与空白组比较,差异无统计学意义(> 0.05);SIRT2-siRNA1 组、SIRT2-siRNA2 组发生迁移和侵袭的 SGC-7901 细胞数量显著低于阴性和空白对照组(< 0.05)。
2.6 沉默 SIRT2 抑制 SGC-7901 细胞中 Akt、PI3K 磷酸化程度
阴性对照组、空白组、SIRT2-siRNA 组 SGC-7901 细胞中 Akt、PI3K 蛋白表达总量比较,差异无统计学意义(> 0.05)。阴性对照组 SGC-7901 细胞中 Akt、PI3K 蛋白磷酸化程度与空白组比较,差异无统计学意义(> 0.05);SIRT2-siRNA1 组、SIRT2-siRNA2 组 SGC-7901细胞中 Akt、PI3K 蛋白磷酸化程度显著低于阴性和空白对照组(< 0.05),结果见图 5、表 5。

图 4 沉默 SIRT2 对 SGC-7901 细胞迁移(A)、侵袭(B)的影响(标尺 = 100 μm)
Figure 4 Effect of silencing SIRT2 on migration (A) and invasion (B) of SGC-7901 plate clones (scale = 100 μm)

表 4 沉默 SIRT2 对 SGC-7901 细胞迁移能力的影响()
注:n = 5,与空白组比较,*< 0.05;与阴性组比较,#< 0.05。
Note: n = 5, compared with the blank group,*< 0.05; compared with the negative group,#< 0.05.
3 讨论
我国的胃癌发生率很高,目前已居于常见恶性肿瘤的第一位。胃癌患者早期症状不具有特异性,因此发现患病时多已进展至晚期,手术效果有限,目前主要使用手术结合化疗的治疗策略,但化疗的毒副作用大且肿瘤细胞易产生抗药性[7]。胃癌患者在疾病晚期多出现肿瘤病灶浸润和远处转移、侵袭,严重影响治疗效果,导致患者预后差,死亡率高[8]。因此,探究胃癌细胞转移和侵袭机制,寻找关键生物分子,可为其临床诊断和治疗提供新思路。

图 5 沉默 SIRT2 对 SGC-7901 细胞 Akt、PI3K 磷酸化程度的影响
Figure 5 Effects of silencing SIRT2 on the phosphorylation of Akt, PI3K in SGC-7901cells
SIRTs 是一类依赖烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)的去乙酰化酶,共包括 SIRT1 ~ SIRT7 七种同源蛋白,在肌肉、胃、肾脏等多种组织器官中表达[9]。SIRTs 通过调节组蛋白乙酰化/去乙酰化水平,调节 DNA 与组蛋白的结合状态,影响基因转录,在能量代谢、炎症反应、氧化还原平衡等生理过程中发挥重要作用[10]。Cheng 等[11]发现,SIRT1 在结直肠癌肿瘤组织中表达显著高于癌旁组织,与患者远处转移、总体生存率有关,细胞实验表明,沉默 SIRT1 表达可显著抑制结直肠癌细胞迁移和侵袭。Grbesa 等[12]发现,SIRT2 蛋白在非小细胞肺癌细胞系 NSCLC 细胞和肺原发肿瘤组织中表达高于正常肺上皮细胞和正常组织,SIRT2 高表达与肺癌患者无复发生存期有关,下调 SIRT2 表达可显著抑制 NSCLC 细胞增殖,推测 SIRT2 在肺癌中具有致癌作用。本研究发现,SIRT2 在胃癌细胞系 SNU-1、KATO III、SGC-7901 中均显著高表达,与 Li 等[13]研究一致,提示SIRT2 可能参与胃癌发生。

表 5 沉默 SIRT2 对 SGC-7901 细胞 Akt、PI3K 磷酸化程度的影响()
注:n = 5,与空白组比较,*< 0.05;与阴性组比较,#< 0.05。
Note: n = 5, compared with the blank group,*< 0.05; compared with the negative group,#< 0.05.
肿瘤的发生涉及多种因素共同作用,当恶性肿瘤发生时,细胞在基因水平上对自身的控制出现紊乱,细胞增殖出现异常,细胞侵袭能力显著增加,表现为浸润式生长,导致肿瘤发生[14]。细胞异常增殖是肿瘤发生的基础,细胞迁移和侵袭是肿瘤发生远端转移的基础。本研究以 SIRT2 表达水平最高的 SGC-7901 细胞作为沉默 SIRT2 表达的载体,结果发现,转染 SIRT2-siRNA 后,SGC-7901 细胞 SIRT2 表达明显上调,表明转染成功,效率较高。进一步观察发现,SIRT2-siRNA1、SIRT2-siRNA2 组 SGC-7901 细胞生长速度、平板克隆形成率、发生迁移和侵袭的细胞数量均显著低于阴性和空白对照组,表明沉默 SIRT2 可有效抑制胃癌 SGC-7901 细胞增殖、迁移和侵袭能力,与冉龙宽等[15]对肝癌细胞增殖能力的研究一致。
PI3K/Akt 通路是细胞内一种调控细胞增殖、细胞侵袭的重要信号转导通路之一。作为通路中关键因子,PI3K 被磷酸化激活后,可催化细胞中 PIP2 转化为有活性的 PIP3,作用于下游靶蛋白 Akt 促进其磷酸化;活化的 Akt 由细胞质转移至细胞膜,传递生物学信号,进一步促进其下游细胞增殖、细胞迁移等相关靶基因转录活化,调节细胞功能[16]。研究表明,PI3K/Akt 信号通路的异常激活可促进多种肿瘤细胞增殖和迁移,与多种恶性肿瘤的严重程度有关[17]。Yang 等[18]发现,转录因子 SOX2 可通过诱导 PI3K/Akt 通路激活,促进人喉癌细胞的迁移和侵袭。Yan 等[19]研究证实,miR-21 在人乳腺癌细胞中可通过直接靶向 PI3K,抑制 PI3K/Akt 通路活化,从而抑制乳腺癌细胞生长、迁移和转移。近年研究发现,SIRT2 与 Akt 活化相关,SIRT2 过表达可增强 Akt 及其下游靶基因活化[20]。为探究 SIRT2 对胃癌细胞增殖、侵袭的作用机制,本研究对转染 SIRT2-siRNA 后,SGC-7901细胞中 PI3K、Akt 表达情况进行检测,结果发现,SIRT2-siRNA1、SIRT2-siRNA2 组 SGC-7901 细胞中 Akt、PI3K 蛋白磷酸化程度均显著降低,表明沉默 SIRT2 表达可有效抑制PI3K/Akt 通路激活,提示SIRT2 可能通过 PI3K/Akt 通路调节胃癌细胞的增殖、迁移和转移。
综上所述,SIRT2 在胃癌细胞中表达上调,沉默 SIRT2 可抑制 PI3K/Akt 通路激活,抑制胃癌细胞增殖、迁移和侵袭,表明 SIRT2 可能通过 PI3K/Akt 通路调节胃癌细胞的增殖、迁移和转移,推测 SIRT2 可能是胃癌基因治疗的潜在作用靶标。
[1] Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014. CA Cancer J Clin, 2014, 64(1):9-29.
[2] Yoon H, Kim N. Diagnosis and management of high risk group for gastric cancer. Gut Liver, 2015, 9(1):5-17.
[3] Zhu T, Wang Q, Wu XR, et al. Long-term efficacy and prognostic factors of surgical treatment for gastric carcinoma with liver metastases: a Meta analysis. Chin J Dig Surg, 2016, 15(3):257-265. (in Chinese)
朱婷, 王琦, 武希润, 等. 胃癌肝转移手术治疗远期疗效及预后因素的Meta分析. 中华消化外科杂志, 2016, 15(3):257-265.
[4] Xu Y, Li F, Lv L, et al. Oxidative stress activates SIRT2 to deacetylate and stimulate phosphoglycerate mutase. Cancer Res, 2014, 74(13): 3630-3642.
[5] Narayan N, Lee IH, Borenstein R, et al. Retraction: the NAD-dependent deacetylase SIRT2 is required for programmed necrosis. Nature, 2014, 506(7489):516.
[6] Hoffmann G, Breitenbücher F, Schuler M, et al. A Novel Sirtuin 2 (SIRT2) inhibitor with p53-dependent pro-apoptotic activity in non-small cell lung cancer. J Biol Chem, 2014, 289(8):5208-5216.
[7] Quan FT, Yang WZ. The value of lymph node metastasis in evaluating the prognosis of patients with gastric cancer. Chin J Clin Res, 2017, 30(6):804-806. (in Chinese)
权峰涛, 杨维桢. 淋巴结转移率在评估胃癌患者预后中的价值. 中国临床研究, 2017, 30(6):804-806.
[8] Chen L, Yan Y, Zhu L, et al. Systemic immune-inflammation index as a useful prognostic indicator predicts survival in patients with advanced gastric cancer treated with neoadjuvant chemotherapy. Cancer Manag Res, 2017, 9(1):849-867.
[9] Kozako T, Suzuki T, Yoshimitsu M, et al. Anticancer agents targeted to sirtuins. Molecules, 2014, 19(12):20295-20313.
[10] Poulose N, Raju R. Sirtuin regulation in aging and injury. Biochim Biophys Acta, 2015, 1852(11):2442-2455.
[11] Cheng F, Li S, Chao Y, et al. SIRT1 promotes epithelial-mesenchymal transition and metastasis in colorectal cancer by regulating Fra-1 expression. Cancer Lett, 2016, 375(2):274-283.
[12] Grbesa I, Pajares MJ, Martínez-Terroba E, et al. Expression of sirtuin 1 and 2 is associated with poor prognosis in non-small cell lung cancer patients. PLoS One, 2015, 10(4):e0124670.
[13] Li Y, Zhang M, Dorfman RG, et al. SIRT2 promotes the migration and invasion of gastric cancer through RAS/ERK/JNK/MMP-9 pathway byincreasing PEPCK1-related metabolism. Neoplasia, 2018, 20(7):745-756.
[14] Pavlova NN, Thompson CB. The emerging hallmarks of cancer metabolism. Cell Metab, 2016, 23(1):27-47.
[15] Ran LK, Song CL, Li WW, et al. Effect of SIRT2 silencing on proliferation of hepatocellular carcinoma cells. J Third Milit Med Univ, 2014, 36(20):2098-2102. (in Chinese)
冉龙宽, 宋春丽, 李宛蔚, 等. SIRT2基因沉默后对肝癌细胞增殖的影响. 第三军医大学学报, 2014, 36(20):2098-2102.
[16] Martini M, De Santis MC, Braccini L, et al. PI3K/AKT signaling pathway and cancer: an updated review. Ann Med, 2014, 46(6):372-383.
[17] Polivka JJ, Janku F. Molecular targets for cancer therapy in the PI3K/AKT/mTOR pathway. Pharmacol Ther, 2014, 142(2):164-175.
[18] Yang N, Hui L, Wang Y, et al. SOX2 promotes the migration and invasion of laryngeal cancer cells by induction of MMP-2 via the PI3K/Akt/mTOR pathway. Oncol Rep, 2014, 31(6):2651-2659.
[19] Yan LX, Liu YH, Xiang JW, et al. PIK3R1 targeting by miR-21 suppresses tumor cell migration and invasion by reducing PI3K/AKT signaling and reversing EMT, and predicts clinical outcome of breast cancer. Int J Oncol, 2016, 48(2):471-484.
[20] Ramakrishnan G, Davaakhuu G, Kaplun L, et al. Sirt2 deacetylase is a novel AKT binding partner critical for AKT activation by insulin.J Biol Chem, 2014, 289(9):6054-6066.
Influences of SIRT2 silence on proliferation, migration and invasion of gastric cancer SGC-7901 cells
NIU Hong, YANG Feng, TANG Jing-wen, TIAN Tong-de, LI Hua-hua, YUE Guang-xing, FAN Yi-xiao, ZHOU Hao-ben
Oncology Department of Integrated Traditional Chinese and Western Medicine, Cancer Center of Zhengzhou University, Henan 450008, China
To investigate the influences and mechanisms of silencing sirtuin-2(SIRT2) on proliferation, migration and invasion of human gastric cancer SGC-7901 cells.
The expressions of SIRT2 in gastric cancer SGC-7901 cells and normal gastric epithelial GES-1 cells was detected by real-time fluorescence quantitative PCR (qRT-PCR). The SGC-7901 cells were treated with RNA interference technique, the SIRT2 silence group was transfected with interfering small RNAs targeting SIRT2 (group SIRT2-siRNA1, group SIRT2-siRNA2), the negative control group was transfected with SIRT2-siRNA negative control sequence, blank control group was not transfected. CKK-8 assays and panel cell colony formation experiments were used to detect the proliferation of SGC-7901 cells. Transwell assay was applied to detect the invasion and migration abilities of SGC-7901 cells. The expressions of SIRT2, serine/threonine rotein kinase (Akt) and phosphatidylinositol-3 kinase (PI3K) in SGC-7901 cells were detected by Western blot.
SIRT2 mRNA and protein levels in human gastric cancer cells SNU-1, KATO III and SGC-7901 were higher than those in normal gastric epithelial GES-1 cells (< 0.05). The levels of SIRT2 mRNA and protein in SGC-7901 cells transfected with SIRT2-siRNA were lower than those in negative and blank control groups (< 0.05); after SIRT2-siRNA transfection, the proliferation, clonality, migration and invasion of SGC-7901 cells were decreased (< 0.05); after transfection of SIRT2-siRNA, the phosphorylation of Akt and PI3K proteins in SGC-7901 cells were decreased significantly (< 0.05).
SIRT2 is up-regulated in gastric cancer cells and SIRT2 silence may inhibit proliferation, migration and invasion of gastric cancer cells by regulating PI3K/Akt pathway, on which it is speculated that SIRT2 may be used as a potential target for gene therapy of gastric cancer.
Sirtuin-2; Gastric cancer; Proliferation; Invasion; Migration
ZHOU Hao-ben, Email: blueskya143@126.com
周浩本,Email:blueskya143@126.com
2018-08-30
10.3969/j.issn.1673-713X.2018.06.008

