富宁林檎花粉离体和原位萌发观察
马玉杰,李坤明,陈 伟,陈 瑶,王仕玉*
(1.云南农业大学园林园艺学院,云南昆明 650201;2.云南省农业科学院园艺作物研究所,云南昆明 650205)
【研究意义】林擒是蔷薇科(Rosaceae)苹果属(Malus)的一种落叶乔木,按《中国植物志》[1]的分类,中国有台湾林擒(Malus doumeri)和尖嘴林擒(M.melliana)2种,主要分布于中国江西、湖南、福建、广西、云南、贵州及台湾等地区。富宁林檎(M.doumeri var.funingenesis)为野生种,是台湾林檎的变种[2],适应性、抗逆力强,病虫害少,易栽培,丰产稳产,其果实加工产品深受广东、广西等沿海市场欢迎,但由于野生数量少,远不能满足市场的需求,因此,极具开发前景,可以作为山区群众增收致富的经济树种[3]。【前人研究进展】广西、湖南等省(区)山区和少数民族地区群众有利用林擒叶作茶饮的习惯,研究发现林檎叶中含有多种氨基酸和维生素等有益人体健康的营养成分,以及含有黄酮类、甾醇类、萜类、皂苷和有机酸等多种化学成分[4-5],具有较高的保健和药用价值[6-7],对一些细菌、霉菌和酵母有抑制作用[8],可作为防腐保鲜剂使用。林擒亦可作为南方亚热带地区苹果树的嫁接砧木,相关其播种育苗技术已有报道[3]。关于台湾林檎的形态特征、物候期、生长特点和分布及适生环境也已有报道[9],关于其花粉及授粉受精方面的研究尚未有人报道。【本研究切入点】近年来,随着荧光显微技术的发展,已广泛应用于各个领域,采用苯胺蓝染色,荧光显微镜观察花粉管生长对探讨植物授粉受精过程有显著帮助。本试验旨在研究利用现有资源,填补对林檎研究的空白,并为生产实践提供参考。【拟解决的关键问题】对富宁林檎花粉离体和原位萌发进行观察,探究富宁林檎花粉活性、离体萌发的适宜培养条件和原位萌发时花粉管的情况,并描述其行为,以期为杂交育种奠定理论基础。
1 材料与方法
1.1 试验材料
1.1.1 试验样品准备 以云南省农业科学院种植的40年生的富宁林檎为试验材料,采集铃铛期花朵,在室温下进行阴干处理后,收集花粉,保存于-20℃备用;对未开放的花蕾套袋,待开放后选一批自花授粉后套袋,另选一批异花授粉后套袋,最后分别采摘授粉后 2 h、4 h、6 h、8 h、10 h、1 d、2 d、3 d、4 d、5 d、6 d、7 d、8 d、9 d、10 d 的花各5 朵,用 FAA 固定液固定,保存备用。
1.1.2 药品与试剂 蔗糖、硼酸、FAA固定液、2 mol/L NaOH 溶液、30%H2O2、蒸馏水、0.1% 苯胺蓝染液、50%甘油。
1.1.3 仪器与设备 OLYMPUS荧光显微镜、HH-6恒温水浴锅、电子天平、恒温培养箱。
1.2 试验方法
1.2.1 花粉离体萌发观察 以培养基中的蔗糖和硼酸为试验因素,设置浓度:蔗糖分为0、5%、10%、15%、20%和25%,硼酸分为0、0.001%、0.01%、0.1%、0.2%和 0.3%。根据不同浓度的蔗糖和硼酸进行组合见表1,以不添加蔗糖和硼酸为对照,加入1%的琼脂,加热溶解后滴一滴于凹面载玻片上,冷却后制成固体培养基。将保存的花粉轻轻抖落到培养基上,每个组合重复3次,在25℃恒温培养箱中,黑暗条件下培养6 h后统计各培养基中花粉的萌发率,筛选出适合萌发的培养基。用萌发率最高的培养基,分别在20、25和30℃的光照和黑暗条件下培养花粉6 h后统计萌发率,分析花粉萌发的适宜环境条件。

表1 花粉离体萌发培养基组合Table 1 The combinations of medium for pollen germination in vitro

续表1 Continued table 1
1.2.2 花粉原位萌发观察 参考钱武等[10]的方法并略作修改,取出FAA固定液保存的花朵,将花柱从基部切下后用蒸馏水清洗2~3次,然后用2 mol/L NaOH溶液在60℃的恒温水浴锅中软化,直至花柱变透明为止。将软化后的花柱用蒸馏水小心清洗5~6次后,用0.1%苯胺蓝染色2 h。将染好色的花柱平整的铺在载玻片上,滴一滴50%甘油,轻轻盖上盖玻片,用于荧光观察。花粉管生长荧光观察试验参照 Kho[11]的方法,分为3个阶段:柱头荧光、花柱中部荧光和花柱基部荧光。在OLYMPUS荧光显微镜下观察花粉在柱头萌发和花粉管在花柱中的生长情况并拍照。
1.3 数据处理与分析
试验中采用SPSS 20.0软件的Duncan法分析处理间萌发率的差异显著性,用Excel 2010软件制图。
花粉萌发率(%)=视野中萌发花粉数/视野中花粉总数×100
2 结果与分析
2.1 花粉离体萌发观察
2.1.1 不同培养基对花粉离体萌发的影响 由表2可知,在不同蔗糖和硼酸浓度的36个组合中,9、10、13、14、15、19、23、25、26、29、31、32、33 和 34 等14 个组合的萌发率为 50% ~60%;16、20、21、22、27和28等6个组合的萌发率在60%以上;组合21的萌发率最高,为65.46%,其次是组合 28,为65.10%;组合5和6的萌发率低于对照组合,分别为9.57%和0。方差分析表明:36个组合中,组合2、4、5和12与对照组的萌发率无显著差异,其他组合与对照组均有极显著差异;在与对照有极显著差异的组合中,除组合6的萌发率低于对照组外其余组合均高于对照组。由此说明,不同浓度的蔗糖和硼酸对花粉的萌发有很大影响,最适富宁林檎花粉离体萌发的培养基为组合21:15%蔗糖+0.01%硼酸。
2.1.2 硼酸和蔗糖对花粉萌发的影响 由图1可知,花粉萌发率随硼酸浓度的增大先上升后下降;蔗糖浓度对花粉萌发率的影响也是随着其浓度的增大先上升后下降,蔗糖浓度25%时的花粉萌发率仍极显著高于蔗糖浓度0的萌发率。蔗糖浓度为0、5%、15%和25%时,花粉萌发率在硼酸浓度0.01%处达到最高,分别为26.41%、51.60%、65.46%和53.69%;蔗糖浓度为10%和20%时,花粉萌发率在硼酸浓度0.1%处达到最高,分别为60.78%和65.10%。蔗糖浓度在0~20%时,萌发率折线在硼酸浓度0~0.2%间有明显起伏,最高峰处明显高于起点0,差异显著,说明硼酸对花粉萌发有影响;蔗糖浓度25%时,硼酸浓度在0~0.2%间,萌发率折线平缓,最高峰与起点差距不明显,说明此时硼酸对花粉萌发几乎没有影响;硼酸浓度0.3%时,所有蔗糖浓度的萌发率折线都急剧下滑,极显著地小于各自的对照(硼酸浓度0);说明蔗糖浓度不变时,硼酸浓度为0.01%或0.1%时硼酸对花粉萌发的促进作用最大,硼酸浓度0.3%时对花粉萌发有强烈的抑制作用,但硼酸对花粉萌发的影响会随蔗糖浓度的增大而逐渐减弱;硼酸浓度不变时,蔗糖浓度为15%和20%时对花粉萌发率的促进作用最大。点B极显著高于点A,说明单因素处理时,蔗糖浓度15%比硼酸浓度0.01%对花粉萌发的促进作用更显著。
2.1.3 不同离体培养条件对花粉离体萌发的影响
光照培养条件下,25℃时,花粉离体萌发的萌发率最高,为61.90%,极显著高于30℃时的花粉萌发率,与20℃时的花粉萌发率差异不显著;20℃时的花粉萌发率显著高于30℃。黑暗培养条件下,25℃时的花粉离体萌发率最高,为65.82%,极显著高于30℃时的花粉萌发率,与20℃时的花粉萌发率差异不显著;20℃时的花粉萌发率与30℃的差异不显著。在所试验的3组温度下,暗培养的花粉萌发率均高于光培养的萌发率。由此可见,富宁林檎花粉离体萌发的较适温度为25℃,光照对萌发无影响。

表2 不同培养基中花粉的萌发率Table 2 The pollen germination rate in different medium

图1 硼酸和蔗糖对花粉萌发的影响Fig.1 Effects of boric acid and sucrose on pollen germination
2.2 花粉原位萌发观察
2.2.1 花粉在柱头附着、萌发情况 富宁林檎柱头多呈扇形,未授粉的柱头为白色,较嫩,表面有粘液,此时荧光显微镜下观察到柱头表面有乳突状的表皮细胞(图2:A),授粉后,随着时间的增长,先是柱头变为浅褐色,然后是花柱变为浅褐色并逐渐加深,直至变为深褐色或黑色。在荧光显微镜下观察授粉后不同时间花粉在柱头的萌发情况,发现:自花授粉后2 h,柱头上有少量花粉粒附着,但尚未观察到有花粉粒萌发现象(图2:B);授粉后4 h,花粉粒在柱头上的附着量有所增加,并且有少数已经开始萌发(图2:C);授粉后4 ~8 h,随着时间的延长,花粉在柱头上的附着和萌发量都显著增大(图2:D~E);授粉后10 h,大量花粉管进入柱头(图2:F)。同时期异花授粉后2 h,大量花粉粒附着在柱头上(图2:G),8 h花粉管已大量萌发并进入柱头(图2:H)。与异花授粉相比,自花授粉后花粉与柱头的反应较慢。

表3 不同离体培养条件下的花粉萌发率Table 3 The pollen germination rate in different environment

图2 未授粉和授粉后2~10 h柱头的情况Fig.2 Status of stigma in non-pollination and 2 -10 hours after pollination
2.2.2 花粉管在花柱中的生长过程 自花授粉后1 d,从柱头进入的花粉管进入花柱并沿花柱继续向下生长,但较为零散,不集中,多数在花柱约1/5处停止生长,个别继续生长,在2/5处停止(图3:A-1),花粉管中有大量胼胝质沉淀,荧光显微镜下表现为强烈的荧光斑点(图3:A-2,A-3);授粉后2 d,花粉管在花柱上部开始聚集成花粉管束向下生长,约至花柱1/2处停止生长,少数继续生长至3/5处停止,花粉管中有胼胝质沉淀(图3:B);授粉后3~10 d,花粉管在花柱中生长时出现中部膨大(图3:C)、尖端变细(图3:D)、缠绕扭曲(图 3,E)和回折生长(图3:F)等不亲和现象,并且花粉管生长始终停留在花柱1/2处。同时期异花授粉后1~10 d,花粉管在花柱中生长的过程中也有胼胝质沉淀现象,此外,花粉管生长至花柱中部时多数情况下花粉管直直地向花柱基部生长,但也有花粉管弯曲、波浪式生长的情况(图3:G);异花授粉后10 d,多数花粉管生长至花柱基部,在胚中也有发现(图3:H~I)。
3 讨论
3.1 离体培养条件对花粉活力的影响
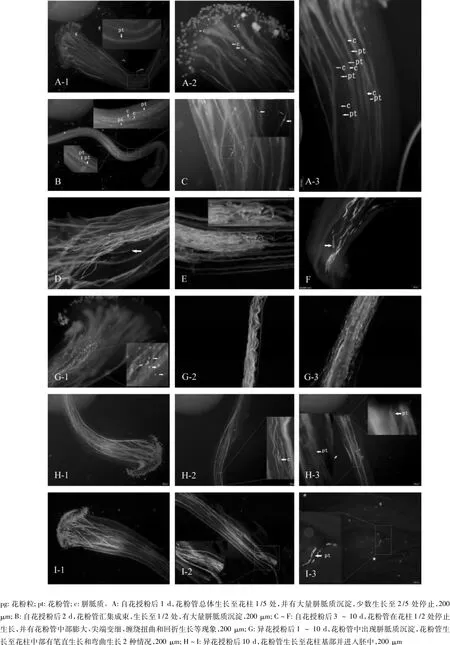
图3 授粉后1~10 d花粉管在花柱的生长情况Fig.3 Growth status of pollen tube in style during 1 -10 days after pollination
花粉活力的强弱直接影响植物授粉受精及果实的品质,而花粉萌发率则是衡量花粉活力的主要指标之一,自身遗传因素和光照、温度等环境因素对花粉离体萌发有很大影响。文章研究了光照、温度和培养基中蔗糖及硼酸浓度对林檎花粉离体萌发的影响。硼一方面可与蔗糖形成络合物,促进花粉对糖分的吸收和代谢[12],另一方面能参与果胶物质的合成,有利于花粉管壁的形成,从而促进花粉萌发[13]。蔗糖在花粉离体萌发过程中除了作为花粉萌发的能量来源和花粉管壁形成的营养物质外,还能保持细胞内外渗透压的稳定[14]。研究表明0.01%为最佳硼酸浓度,对林檎花粉萌发的促进作用最显著,0.3%硼酸则有强烈抑制作用;蔗糖浓度在0~15%对花粉萌发的促进作用逐渐增大,15%~25%时促进作用逐渐下降;此外,蔗糖15% +硼酸0培养基的花粉萌发率显著高于蔗糖0+硼酸0.01%培养基的花粉萌发率,表明蔗糖对花粉萌发的影响要大于硼酸的影响。25℃温度下的花粉萌发率最高,温度过高或过低都不利于花粉萌发,原因可能是低温下花粉活性被抑制,而高温则使花粉活力丧失。关于花粉萌发是否需要光照,文章研究发现有无光照对林檎花粉的萌发率没有影响,龚双姣等[15研究发现光照更有利于腊梅花粉萌发,吴硕等[16]研究发现光照对枣的花粉萌发有一定抑制作用。花粉萌发的最适条件虽然随植物种类的不同而有所差异,但对花粉萌发的影响是相同的,即在一定条件范围内有利于花粉萌发,低于或超出其条件均不利于花粉萌发。
3.2 林檎自花授粉和异花授粉的原位萌发情况
De Nettancourt[17]认为蔷薇科果树为配子体型自交不亲和,其自花和异花花粉均能在柱头萌发,沿着花柱定向生长,但在花柱的中上部,自花花粉管生长受到抑制,而异花花粉管能够达到花柱基部。文章观察到林檎自花授粉2 d后花粉管就已经生长至花柱1/2处,然后停止生长并出现花粉管中部膨大、尖端变细、缠绕扭曲和回折生长等不亲和现象,直至落花,而异花授粉的花粉管并无上述现象,且一直生长至胚中。这与陈迪新等人[18]观察的沙梨自花和异花授粉花粉管生长特性相似,符合配子体型自交不亲和的花粉管特性。Williams[19]对杜鹃的杂交花粉管特性观察后认为花粉管形态的变化是生长受到抑制的表现,与其顶端的生长和胼胝质的堆积有关。柱头和花柱的颜色在授粉后会逐渐变成深褐色,这与何兴波[20]的观察结果一致,这一现象与花粉管的生长长度有关,可以直观地反映植物是否完成授粉。孙辉芳[21]探究了几种常见植物从传粉至受精的间隔时间,表明苹果属植物的间隔时间是5 d,而文章观察到林檎授粉后10 d,花粉管进入胚中,比孙辉芳观察到的时间延迟了1倍,这可能与所处环境温度有关。郭媛等[22]研究了梨花粉和柱头发育与温度的关系,结果表明20℃比8℃下,柱头可授性出现的早,持续时间久,花粉萌发率更高,花粉管生长速度也更快;徐臣善[23]研究了高温对苹果花粉在花柱内萌发和生长的影响,发现35℃高温对苹果花粉的萌发和花粉管的生长有促进作用,但在授粉72 h后,花粉管的形态开始出现变异,导致不能进入胚中完成受精。
4 结论
富宁林檎花粉离体萌发最适条件为:25℃环境,蔗糖15%+硼酸0.01%+琼脂1%的培养基。蔗糖浓度5%~25%对林檎花粉萌发均有显著促进作用,蔗糖浓度15%的促进作用最大;硼酸浓度0.001% ~ 0.3%时,硼酸浓度0.01%对花粉萌发有显著促进作用,硼酸浓度0.3%对花粉萌发有强烈抑制作用;蔗糖浓度15%对花粉萌发的促进作用显著强于硼酸浓度0.01%。蔗糖和硼酸对花粉萌发有交互作用,蔗糖浓度越高,硼酸对花粉萌发的影响越弱。
富宁林檎自花授粉后2 h,花粉粒在柱头上附着,4 h开始萌发,但附着和萌发量都极少;4~8 h,花粉在柱头上大量附着并萌发,10 h进入柱头中;1 d,花粉管生长至花柱1/5~2/5处,并有胼胝质沉淀;2~10 d,花粉管生长始终停留至花柱1/2处,并出现中部膨大、尖端变细、缠绕扭曲和回折生长等不亲和现象;异花授粉的花粉与柱头的反应比自花授粉的快,授粉后10 d花粉管到达花柱底部并进入胚中。

