藿香叶黄酮提取工艺优化及其体外抗氧化活性
, ,
(保山学院资源环境学院,云南保山 678000)
藿香叶为唇形科藿香属植物藿香(Agastacberugose(Fisch.et.Mey.)O.Ktze)的叶[1],藿香为多年生草本植物,又名大薄荷、土藿香、把蒿等。藿香生长适应性很强,保山当地生长旺盛,当地居民常用鲜嫩的藿香茎叶作为蔬菜食用,如:傣味藿香煮鱼等。藿香的食用部位一般为嫩茎叶,其含有很多的天然植物化学成分,如黄酮类化合物[2]、矿物质和维生素[3]等,具有很高的营养保健价值。
目前,对藿香的研究主要集中在栽培技术管理[4]、精油提取[5]以及抑菌[6-8]、抗氧化[9-10]、化学成分[8,11]、药理及营养价值[12]等几个方面。国内外对藿香黄酮提取方面的报道较多,其提取工艺大多采用超声波提取法[5,13],宫海燕[13]对新疆人工栽培藿香总黄酮提取法进行优选,得到超声波提取法所得的总黄酮含量高于振荡提取法,而利用微波辅助法提取藿香黄酮的研究鲜见报道。用微波辅助法提取植物天然有效成分的应用越来越多,微波辅助提取法就是利用微波加热的特性,对物料中目标成分进行选择性提取的方法。微波辅助提取方法的优点就是提取快速、高效,减少浪费,节省能源等,为植物资源的提取技术提供了一个新的研究方向[14]。
本文采用微波辅助提取法提取藿香叶的黄酮,且以黄酮得率为指标,采用L9(34)正交表进行试验,确定最佳工艺参数,并进行验证性试验,同时对藿香叶黄酮的体外抗氧化性进行探讨,旨在为藿香叶黄酮的深加工及药理作用提供一定的理论参考。
1 材料与方法
1.1 材料与仪器
藿香叶 采自保山市隆阳区潞江坝,经保山学院资源环境学院植物学教研室鉴定为唇形科藿香属植物藿香,50 ℃烘干8 h,粉碎过60目筛,索氏抽提除去油脂及色素,在阴凉处阴干,备用;芦丁标准品、DPPH、ABTS 纯度99%,阿拉丁试剂公司;石油醚、亚硝酸钠、三氯化铝、抗坏血酸、氢氧化钠、硫酸亚铁、水杨酸、过氧化氢、无水乙醇等 均为分析纯,国药集团化学试剂科技有限公司。
Q/OANN 10-2008电子天平 奥豪斯仪器上海有限公司;G70F20N2L-DG(SO)微波炉 广东格兰仕微波炉电器有限公司;DFY-800摇摆式高速万能粉碎机 温岭市林大有限公司;UV5100紫外/可见分光光度计 安徽皖仪科技股份有限公司;N-1001旋转蒸发仪 上海爱朗仪器有限公司。
1.2 实验方法
1.2.1 黄酮提取工艺 准确称取0.5 g藿香叶样品粉末,加一定浓度的乙醇摇匀,将微波调至一定功率(实验用微波炉固有功率)加热,冷却至室温后抽滤,取滤液定容至100 mL,避光保存为样品液。
1.2.2 单因素实验 对藿香黄酮得率有影响的4个因素,即料液比(A)、乙醇浓度(B)、微波功率(C)、提取时间(D)进行单因素试验。准确称取0.5 g藿香叶,固定因素为:25 mL 50%乙醇,微波功率406 W,提取时间50 s,分别改变料液比(1∶20、1∶30、1∶40、1∶50、1∶60 g/mL),乙醇浓度(30%、40%、50%、60%、70%),微波功率(126、252、406、567、700 W),提取时间(30、40、50、60、70 s)制备样品液,计算黄酮得率,考察各因素对黄酮得率的影响。
1.2.3 正交试验 以料液比(A)、微波功率(B)、乙醇浓度(C)、提取时间(D)4个因素3个水平进行L9(34)正交试验,以确定藿香叶黄酮的最佳提取条件,其试验因素水平见表1。
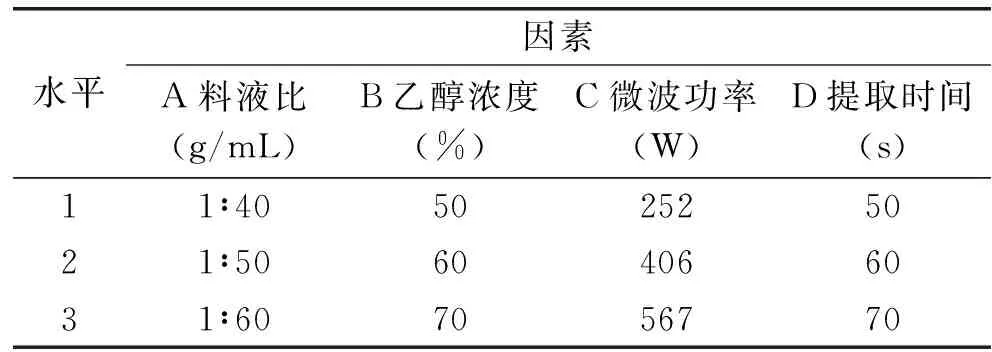
表1 正交实验因素和水平Table 1 Factors and levels in orthogonal array design
1.2.4 标准曲线绘制 称取芦丁标准样品约20.3 mg,用50%乙醇溶解并定容至50 mL,配制成浓度为0.406 mg/mL的标准样品溶液。通过预实验选定510 nm波长为特征吸收峰位置。分别准确吸取0.5、1.0、1.5、2.0、2.5、3.0 mL芦丁标准溶液置于10 mL比色管中,分别加入2 mL水、0.3 mL 5% NaNO2溶液,摇匀,静置5 min,在加入0.6 mL 10% AlCl3溶液,摇匀,静置6 min,最后加入2 mL 1 mol/L NaOH溶液,摇匀后用50%乙醇稀释至刻度线,静置10 min,在510 nm处测定吸光度。以芦丁含量(mg/mL)为横坐标、吸光度A为纵坐标绘制标准曲线。回归方程为y=11.254x-0.0134,决定系数R2=0.9992。芦丁标准品在质量浓度0.0201~0.1436 mg/mL范围内与吸光度值呈良好的线性关系。
1.2.5 黄酮得率的测定 准确吸取样品液,参照标准曲线制作方法,在510 nm波长处测定样品吸光度A,平行测定三次,代入回归方程,计算得到藿香叶黄酮含量。根据回归方程,计算得到藿香叶黄酮含量,进一步计算藿香叶中黄酮得率[15]。

式中:C为线性方程计算出样品的质量浓度(mg/mL),D为测定时定容的体积(mL),V为提取液定容体积(mL),m为称取的样品质量(g),B为吸取测定体积(mL)。
1.2.6 藿香叶黄酮抗氧化活性测定 在最优工艺条件下获得藿香叶黄酮,采用二倍稀释法配制成0.76、1.5、3.1、6.1、12.3、24.5、49.0、98.0、196.0、392.0、784.0 mg/L浓度梯度的藿香叶黄酮溶液备用。
1.2.6.1 清除·OH能力的测定 参照文献[16-18]的方法略作修改,在比色管中依次加入6 mmol/L FeSO4溶液1 mL、6 mmol/L水杨酸乙醇溶液1 mL、60 mmol/L H2O2溶液1 mL和不同浓度的藿香叶黄酮溶液1 mL,摇匀,在37 ℃水浴加热30 min,再用蒸馏水定容至10 mL,在紫外可见分光光度计510 nm波长处,分别测吸光度值A0、A1、A2,重复3次实验。实验设置样品组和对照组,采用抗坏血酸作对照,抗坏血酸的浓度和藿香叶黄酮溶液浓度相同,同样采用二倍稀释法配制11组浓度梯度的抗坏血酸溶液。通过以下公式,即可计算出藿香叶黄酮或抗坏血酸对·OH的清除率,并根据SPSS 19.0软件计算出IC50值(即自由基清除率达到50%时样品的浓度)。
式中:A1为加入藿香叶黄酮样品所测吸光度,A2为用同体积蒸馏水代替过氧化氢溶液所测吸光度,A0为用同体积蒸馏水代替藿香叶黄酮样品液的空白对照组的吸光度。
1.2.6.2 DPPH·清除能力的测定 参照文献[17,19]的方法略作修改,在比色管中依次加入0.5 mmol/L DPPH·乙醇溶液2 mL、无水乙醇2 mL和不同浓度的藿香叶黄酮溶液2 mL,混匀,避光室温放置30 min后,定容至10 mL,在517 nm处分别测吸光度A0、A1、A2,重复3次实验,对照组采用抗坏血酸作对照,抗坏血酸的浓度和藿香叶黄酮溶液浓度相同。通过以下公式即可计算出藿香叶黄酮或抗坏血酸对DPPH·的清除率,并计算出IC50值。
式中:A1为加入藿香叶黄酮样品所测吸光度,A2为用同体积无水乙醇代替DPPH·乙醇溶液所测吸光度,A0为用同体积蒸馏水代替藿香叶黄酮样品液的空白对照组的吸光度。
1.2.6.3 ABTS+·清除能力的测定 依照文献[20-22]的方法进行,ABTS+·储备液:7.4 mmol/L ABTS溶液和2.6 mmol/L过硫酸钾溶液等量混合,室温下避光反应16~18 h。ABTS+·工作液:吸取1 mL储备液以无水乙醇稀释,使吸光值在734 nm处达0.7±0.02,ABTS+·工作液现配现用。取1.5 mL的ABTS+·工作液与0.5 mL的藿香叶黄酮溶液混合,在室温下避光静置10 min后,于734 nm处测定吸光值。对照组采用抗坏血酸作对照,抗坏血酸的浓度和藿香叶黄酮溶液浓度相同。通过以下公式即可计算出藿香叶黄酮或抗坏血酸对ABTS+·的清除率,并计算出IC50值。
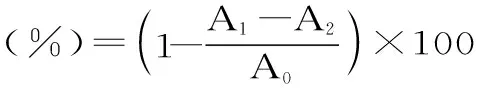
式中:A1为加入藿香叶黄酮样品所测吸光度,A2为用同体积蒸馏水代替ABTS+·工作液所测吸光度,A0为用同体积蒸馏水代替藿香叶黄酮样品液的空白对照组的吸光度。
1.3 数据处理
所有实验数据均为三次重复实验结果的平均值,数据用均数±标准差表示。应用Excel软件对实验数据进行曲线拟合,得回归方程,计算IC50值,运用SPSS 19.0 进行单因素方差分析。
2 结果与分析
2.1 藿香叶黄酮提取的单因素实验结果
2.1.1 料液比对藿香叶黄酮得率的影响 如图1所示,当料液比在1∶20~1∶50 g/mL时,藿香叶黄酮得率随料液比升高而升高,当料液比达到1∶50 g/mL时,黄酮得率达到最大。料液比超过1∶50 g/mL,黄酮得率随着料液比的增大而减小,这是由于液料比过大,溶剂挥发带来的损失会增大,从而导致黄酮得率有所下降[15]。因此,藿香叶黄酮提取的最佳料液比为1∶50 g/mL。

图1 料液比对藿香叶黄酮得率的影响Fig.1 Effect of solid-liquid ratio on extraction yield of flavonoids from the leaf of Agastacbe rugose注:不同小写字母表示差异显著,p<0.05;图1~图4同。
2.1.2 乙醇浓度对藿香叶黄酮得率的影响 结果如图2所示,当乙醇浓度在30%~60%时,藿香叶黄酮得率随着乙醇浓度的增大而增大,当乙醇浓度为60%时,藿香叶黄酮得率达到最大为5.90%,当乙醇浓度超过60%后,黄酮得率随乙醇浓度增大而减小。这是由于乙醇浓度过大,会使一些醇溶性杂质、色素、亲脂性强的成分溶出量增加,这些成分与黄酮类化合物竞争乙醇,从而导致溶出的黄酮类化合物减少[15]。提取藿香叶黄酮时,最佳乙醇浓度为60%。

图2 乙醇浓度对藿香叶黄酮得率的影响Fig.2 Effect of ethanol concentration on extraction yield of flavonoids from the leaf of Agastacbe rugose
2.1.3 微波功率对藿香叶黄酮得率的影响 由图3可知,当微波功率在126~406 W时,藿香叶黄酮得率随微波功率的增大而增大,微波功率为406 W时,黄酮得率达到最大值(5.95%),这是由于功率增大,加热速率也增大,分子运动、物质渗透、扩散和溶解速度加快,有利于黄酮类物质溶出。当微波功率超过406 W时,黄酮得率随微波功率增大而降低,这可能是因为功率较大时,温度过高,对黄酮物质产生破坏,溶解出杂质也增多,导致得率下降[23]。因此,藿香叶黄酮提取的最佳微波功率为406 W。
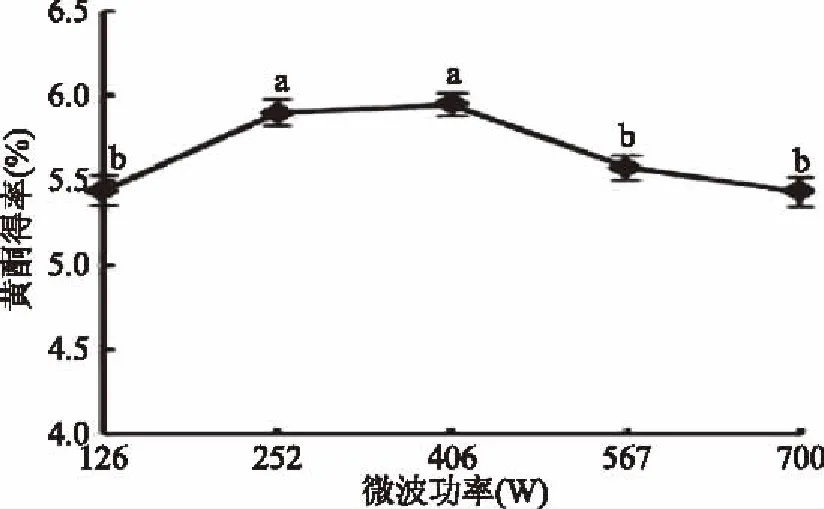
图3 微波功率对藿香叶黄酮得率的影响Fig.3 Effect of microwave power on extraction yield of flavonoids from the leaf of Agastacbe rugose
2.1.4 提取时间对藿香叶黄酮得率的影响 结果见图4,提取时间在30~60 s时,藿香叶黄酮得率随提取时间的延长而升高,当提取时间达到60 s时,黄酮得率达到最大为5.98%。但超过60 s后,黄酮得率随时间的延长而呈下降趋势。藿香叶黄酮得率随着提取时间的增长而呈先增加后下降的变化规律,一方面可能是因为黄酮在高温条件下易发生氧化,提取时间太长,黄酮得率反而下降[15];另一方面,可能是加热时间过短时,温度较低,不利于黄酮的提取,而时间过长时产生过高温度,导致黄酮物质分解,而且时间过长,溶剂也可能大量挥发,还会发生暴沸[23]。因此,藿香叶黄酮得率的最佳提取时间为60 s。
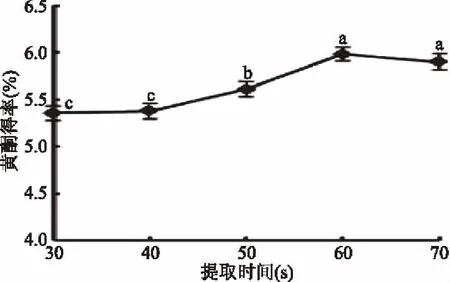
图4 提取时间对藿香叶黄酮得率的影响Fig.4 Effect of microwave time on extraction yield offlavonoids from the leaf of Agastacbe rugose
2.1.5 藿香叶黄酮提取正交试验结果 正交试验结果见表2,综合R值大小来评价影响保山藿香叶黄酮得率的因素顺序为A>C>B>D,即料液比>微波功率>乙醇浓度>提取时间。从藿香叶黄酮得率的结果看,最佳工艺为8号实验A3B2C1D3,其黄酮得率为6.01%;但从k值直观分析可知,藿香叶黄酮提取的最优工艺方案为:A3B2C3D3。对A3B2C3D3和A3B2C1D3分别进行3次平行重复实验,藿香叶黄酮的平均得率分别为6.11%和6.03%。结果表明,藿香叶的黄酮提取的最佳工艺参数组合为A3B2C3D3,即料液比1∶60 g/mL、乙醇浓度60%、微波功率567 W、提取时间70 s。在此条件下黄酮得率达最大值,结果表明所选工艺合理、可行,可用于藿香叶黄酮提取工艺。

表2 正交实验及结果分析Table 2 Results and analysis of orthogonal experiment
2.2 藿香叶黄酮对·OH清除能力的影响
由图5可知,藿香叶黄酮和抗坏血酸对·OH的清除率随浓度的增大而增大,当浓度达到784.0 mg/L时,其清除率分别为92.0%和50.8%,差异明显。藿香叶黄酮和抗坏血酸对·OH清除率的IC50值为:藿香叶黄酮IC50=281.89 mg/L,抗坏血酸的IC50=725.69 mg/L。藿香叶黄酮的IC50值较抗坏血酸的IC50值小很多,说明藿香叶黄酮抗氧化效果优于抗坏血酸,且根据·OH清除曲线可以看出,藿香叶黄酮在较高浓度时具有很强的·OH清除能力。
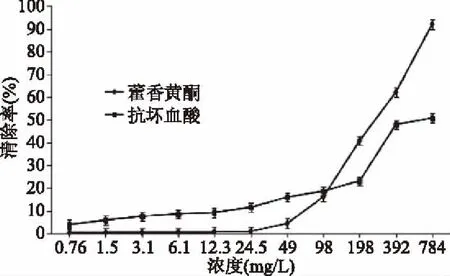
图5 藿香叶黄酮对·OH清除能力的影响Fig.5 Effects of OH radical scavenging capacity of flavonoids from the leaf of Agastacbe rugose
2.3 藿香叶黄酮对DPPH·清除能力的影响
由图6可知,藿香叶黄酮和抗坏血酸对DPPH·的清除率随其浓度的增大而增大,当藿香叶黄酮浓度达到49 mg/L时,DPPH·的清除率增加缓慢,最后趋于平缓直线。从藿香叶黄酮和抗坏血酸对DPPH·清除率的IC50值结果来看,其强弱顺序为:藿香叶黄酮(IC50=3.57 mg/L)>抗坏血酸(IC50=15.36 mg/L)。在浓度0.76~24.5 mg/L范围内,藿香叶黄酮对DPPH·的清除率优于抗坏血酸,说明藿香叶黄酮抗氧化活性优于抗坏血酸,在浓度24.5~784 mg/L范围内,抗坏血酸对DPPH·的清除率优于藿香叶黄酮。综合来看,藿香叶黄酮具有良好的DPPH·清除能力。
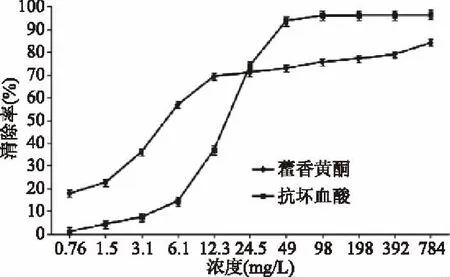
图6 藿香叶黄酮对DPPH·清除能力的影响Fig.6 Effects of DPPH radical scavenging capacity of flavonoids from the leaf of Agastacbe rugose
2.4 藿香叶黄酮对ABTS+·清除能力的影响
由图7可知,在浓度0.76~6.1 mg/L之间,藿香叶黄酮和抗坏血酸对ABTS+·的清除率随其浓度的增大而增大,当浓度达到6.1 mg/L时,藿香叶黄酮对ABTS+·的清除率就达到96.5%,是同浓度抗坏血酸对ABTS+·清除率的2.6倍。从藿香叶黄酮和抗坏血酸对ABTS+·清除率的IC50值结果来看,其强弱顺序为:藿香叶黄酮(IC50=1.52 mg/L)>抗坏血酸(IC50=6.48 mg/L),说明藿香叶黄酮抗氧化活性优于抗坏血酸,具有很好的ABTS+·清除能力。
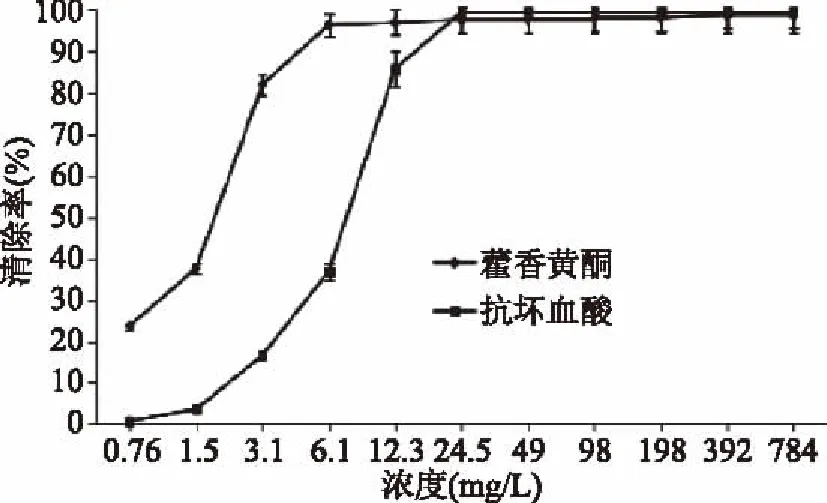
图7 藿香叶黄酮对ABTS+·清除能力的影响Fig.7 Effects of ABTS+ radical scavenging capacity of flavonoids from the leaf of Agastacbe rugose
总的来说,本研究结果与其他学者[17,24]在这方面的研究结果相似。藿香叶黄酮清除·OH、DPPH·、ABTS+·活性的能力良好,尤其对ABTS+·清除能力最优。这一结果与付晓丹等[24]对枇杷叶黄酮抗氧化活性研究结果一致:植物茎叶黄酮表现出较好的清除DPPH·、ABTS+·的能力,在实验浓度范围内,随着黄酮浓度的增加,其清除自由基的活性增大。
3 结论
本研究采用微波辅助乙醇浸提保山藿香叶黄酮,分别考察各单因素对黄酮提取得率的影响,并通过单因素实验和L9(34)正交设计对提取工艺进行优化,得到各因素对黄酮提取得率影响程度大小为:料液比>微波功率>乙醇浓度>提取时间,通过优化得到藿香叶黄酮提取的最佳条件为料液比1∶60 g/mL、乙醇浓度60%、微波功率567 W、微波时间70 s,此条件下藿香叶黄酮提取得率为6.11%。此条件下制得的藿香叶黄酮通过体外抗氧化实验得出:藿香叶黄酮对·OH、DPPH·、ABTS+·具有较好的清除效果,其IC50分别为281.89、3.57、1.52 mg/L,藿香叶黄酮清除·OH、DPPH·、ABTS+·活性的能力良好,尤其对ABTS+·清除能力最优,表明藿香叶黄酮具有较强的体外抗氧化活性。该研究为系统开发藿香叶黄酮成分的应用提供基础,对保山藿香的开发利用具有较大指导意义。

