植物乳杆菌细菌素高产菌株的诱变选育及其对肉丸的防腐保鲜作用
, ,,,,,
(南京农业大学食品科技学院,江苏南京 210095)
细菌素是由核糖体合成的一类有抑菌作用的多肽或蛋白质[1],作为一种天然安全的生物防腐剂,细菌素细胞毒性低,进入人体胃肠道会被分解,不会对人体健康产生影响,在食品防腐剂、饲料添加剂以及制药领域有很好的应用前景[2-4]。但是从自然界筛选的野生菌细菌素产量通常较低,无法大量生产,不利于细菌素的工业化应用。应用理化诱变与基因组改组技术,可以提高细菌素的产量。常温等离子体诱变(ARTP)能够在常温条件下产生高活性粒子浓度的等离子体射流[5],这些活性粒子到达菌体表面,能够引起细胞膜和细胞壁通透性改变,从而导致基因损伤引发突变[6]。甲基硝基亚硝基胍(MNNG)是一种应用广泛的化学诱变剂[7],可以作用于DNA,引起DNA损伤,导致遗传物质改变,细胞的生长发生改变[8]。基因组改组即细胞融合技术是菌株改良和生物代谢工程中的重要方法[9]。它利用原生质体融合的方式对亲本菌株进行基因的随机重组,以使得目的性状得以提高[10-12]。相比于传统诱变方法,基因组改组周期短,在不清楚基因序列的情况下,可以对亲本菌株的基因组随机重组,获得优良性状集中的菌株。利用基因组改组可以提高菌株耐受性[13-15],提高底物利用率[16-18],提高底物产量[19-21]。
本实验以前期实验室分离筛选得到的一株产细菌素的L.plantarumJL-A65为出发菌株,旨在采用等离子诱变和甲基硝基亚硝基胍诱变两种方式提高细菌素的产量,并以此为亲本库进行基因组改组,进一步提高细菌素的产量。最后将双乙酸钠与细菌素复配后应用于肉制品中,研究对肉制品的防腐保鲜效果。
1 材料与方法
1.1 材料与仪器
植物乳杆菌JL-A65 南京农业大学食品科技学院酶工程实验室;大肠杆菌(ATCC25922) 南京农业大学食品科技学院酶工程实验室;平板菌落计数(PCA)培养基 北京陆桥生物技术有限公司;MRS培养基、LB培养基、再生培养基、原生质体缓冲液(LPB)所用试剂 分析纯,国药集团化学试剂有限公司;生理盐水、NaCl(浓度0.85%)、溶菌酶溶液(100 mg/mL)、乙腈 色谱纯,美国B&J公司;三氟乙酸(TFA) 色谱纯,德国Merck公司;正丁醇 分析纯,上海麦恪林生化科技有限公司;MgO、硼酸、盐酸、甲基红、亚甲基蓝、双乙酸钠 国药集团化学试剂有限公司;新鲜猪肉 江苏省南京市苏果超市雨润冷鲜肉专柜。
SW-CJ-1FD型单人单面净化工作台 苏净集团安泰公司;高压蒸气灭菌锅 日本TOMY公司;WH-3微型旋涡混合仪 上海泸西分析仪器厂有限公司;隔水式电热恒温培养箱 上海跃进医疗器械厂;Milli-Q Academic型超纯水系统 美国Millipore公司;飞鸽牌系列离心机 上海安亭科学仪器厂;游标卡尺 上海恒量量具有限公司;UV-2450分光光度计 Shimadzu公司;GXZ-9240 MBE鼓风干燥箱 上海博迅实业有限公司医疗设备厂;UltiMate3000戴安高效液相色谱仪 戴安中国有限公司;ARTP-Ⅱ等离子体诱变仪 无锡源清天木生物科技有限公司;Orion* 3-Star型pH计 美国Thermo公司(上海)。
1.2 实验方法
1.2.1 植物乳杆菌JL-A65 ARTP诱变研究
1.2.1.1 菌悬液的准备与ARTP诱变处理 将植物乳杆菌JL-A65接种于新鲜MRS培养基中(1%,v/v),37 ℃静置培养12 h,5000 r/min,5 min离心去除培养基,用生理盐水复溶,采用紫外分光光度计测定OD值,调节OD值至0.6~0.8。将ARTP处理仪专用的载片在酒精灯上灼烧灭菌,冷却后取调节好OD值的10 μL菌液,均匀涂在载片上面,用镊子夹取载片放置于等离子诱变仪的载片凹槽之中。
参数设置为:载气:高纯氦气(99.999%);入射功率:200 W;载气流速:10 SLM;处理温度:25 ℃;反射功率:40 W;载物台与放射源距离:10.0 mm;照射时间分别为15、30、45、60、75、90和105 s进行诱变,诱变处理结束后,将载片置于装有1 mL生理盐水的离心管中,用涡旋振荡仪清洗2 min,将载片上面的菌液全部洗脱,将得到的菌悬液稀释到合适的梯度(10-5~10-6),涂布于固体MRS平板上,以未经ARTP处理的样品作对照,每个处理涂3块平板。37 ℃静止培养36 h。观察15~105 s照射时间对致死率的影响。
致死率(%)=(B-A)/B×100
式(1)
式中:A为ARTP诱变处理组平板上的菌落数;B为未经ARTP诱变处理的出发菌株平板上的菌落数。
1.2.1.2 利用琼脂扩散法初筛 挑选合适的稀释度,将静止培养的平板上的单菌落用牙签挑于装有MRS培养基的离心管中,静止发酵48 h,5000 r/min,5 min离心,取上清液,利用琼脂扩散法,在大肠杆菌平板上进行抑菌实验,以抑菌圈大小为指标,对诱变处理后菌株进行初次筛选。
1.2.1.3 诱变菌株复筛与细菌素产量提高率的计算 将初次筛选所得菌株接种于新鲜的MRS培养基,每隔12 h,转接至新鲜的MRS培养基中,连续转接三次之后,静置发酵48 h,离心取上清液以琼脂扩散法进行筛选。将筛选后抑菌效果好的菌株活化,接种于100 mL MRS培养基中,发酵48 h,取1 mL发酵液,5000 r/min离心5 min,以1.5倍发酵液体积的正丁醇萃取,将萃取后溶液用0.22 μm的滤膜过滤。利用HPLC检测,计算相对于出发菌株的细菌素产量提高率。
液相检测使用色谱柱为:COSMOSIL 5C18-AR-II(4.6 mm×250 mm,日本Nacalai Tesque公司);液相紫外检测波长为231 nm;进样20 μL;流速:0.5 mL/min;洗脱条件为:流动相为5%的乙腈(0.1%三氟乙酸)与95%的水(0.1%三氟乙酸),洗脱时间为15 min。产量与峰面积的关系为:
细菌素产量Y(mg/mL)=28.248 X+6.4541
式(2)
式中:Y为菌株细菌素产量,mg/mL;X为峰面积。
细菌素产量提高率(%)=(B-A)/B×100
式(3)
式中:A为出发菌株细菌素产量,mg/mL;B为诱变菌株细菌素产量,mg/mL。
1.2.2 植物乳杆菌JL-A65 MNNG诱变研究
1.2.2.1 诱变条件的确定 菌悬液的制备同1.2.1.1,在处理好的菌液中加入预先配制好的MNNG溶液,使得混合液中MNNG的终浓度为0.5、1、1.5、2、2.5、3、3.5和4 mg/mL,用涡旋仪混合完全后置于37 ℃水浴锅中保温10 min,之后将菌液5000 r/min,5 min离心,用生理盐水清洗2次,复溶于生理盐水中,将菌悬液稀释到合适的梯度(10-5~10-6),涂布于固体MRS平板上,37 ℃静止培养36 h。观察0.5~4 mg/mL MNNG对致死率的影响。
1.2.2.2 利用琼脂扩散法初筛 方法同1.2.1.2。
1.2.2.3 诱变菌株复筛与HPLC检测 方法同1.2.1.3。
1.2.3 植物乳杆菌JL-A65基因组改组研究
1.2.3.1 原生质体制备条件 将前期诱变筛选得到的突变菌株过夜培养后,转接于(接种量为5%)50 mL的MRS培养基中,37 ℃,静置培养。培养8 h后取10 mL培养液,离心(4000 r/min,5 min)收集菌体,LPB缓冲液洗涤2次后重悬于LPB中,加入溶菌酶使终浓度为25 mg/mL,37 ℃水浴处理20 min,LPB洗涤两次(2000 r/min,15 min),稀释后分别涂布于普通MRS平板和再生平板,之后固定溶菌酶浓度、水浴温度和处理时间,分别于4、6、8和10 h后各取10 mL培养液;固定培养时间、水浴温度和时间,调节溶菌酶浓度分别15、20、25、30和35 mg/mL;固定培养时间、溶菌酶浓度与水浴时间,水浴温度分别为31、34、37和40 ℃;固定培养时间、溶菌酶温度和水浴温度,水浴处理10、20、30、40和50 min。其他步骤不变。计算原生质体形成率和原生质体再生率,确定原生质体的制备条件。
原生质体形成率的测定:将酶解前的菌悬液和酶解后的原生质体液梯度稀释,涂布于普通MRS培养基上。37 ℃培养36 h,计算菌落数,计算原生质体形成率。
原生质体形成率(%)=(A-B)/A×100
式(4)
式中:A为酶解前的总菌落数;B为未原生质体化的菌落数。
原生质体再生率的测定:用缓冲液稀释酶解后的原生质体液,取原生质体液涂布于再生培养基平板上,置于37 ℃培养箱中,倒置培养36 h,观察再生菌落的形态并计数。
原生质体再生率(%)=(C-B)/(A-B)×100
式(5)
式中:A为总菌落数;B为未形成原生质体的菌落数;C为再生菌落数。
1.2.3.2 原生质体灭活条件 紫外灭活:取一管上述制备好的原生质体菌悬液置于直径为6 cm的玻璃培养皿中,平皿中放入磁力针做转子,并置于磁力搅拌器上,将磁力搅拌器置于超净台中,调整照射距离19.5 cm,照射时间为10、15、20、25、30和35 min,分别取原生质体灭活后的溶液,于避光条件下取100 μL涂布于再生平板上,避光培养36 h后计数菌落数,计算灭活率。
热灭活:将另一管上述制备好的原生质体液移入离心管中,置于60 ℃水浴中计时。分别于15、20、25、30、35、40和45 min时,各取原生质体溶液100 μL,涂布于再生平板上。避光培养36 h后计数菌落数,计算灭活率。
原生质体灭活率(%)=(C-B-D)/(C-B)×100
式(6)
式中:D为经灭活处理的原生质体液在再生固体平板上的菌落数;B为未形成原生质体的菌落数;C为再生菌落数。
1.2.3.3 原生质体融合条件 将上述紫外灭活和热灭活后的原生质体各取500 μL等量混合,3000 r/min低速离心20 min,弃上清液,重悬于500 μL LPB中,加9倍体积的不同体积分数(30%、40%、50%和60%)的PEG 6000,室温下作用15 min;加9倍体积的体积分数40%的PEG 6000,在室温下作用不同时间(10、15、20和25 min),作用时间结束后,立即加5 mL LPB稀释,去除PEG 6000的作用,然后3000 r/min低速离心洗涤两次,重悬于100 μL LPB缓冲液中。将融合后的原生质体溶液稀释不同倍数,涂于再生平板,37 ℃培养箱培养48 h。以未经灭活的原生质体液涂布再生平板,作为对照,确定原生质体融合条件。
原生质体融合率的计算:融合率(%)=R/(C-B)×100
式(7)
式中:R为融合后再生平板上的菌落数;B为未形成原生质体的菌落数;C为再生菌落数。
1.2.4 细菌素plantaricin JL-A65在肉制品中的应用
1.2.4.1 生鲜肉处理 在超净台中将购买的肉泥分为5组每组800 g,分别添加不同剂量的复配防腐剂,搅拌均匀后进行成形分装,将分装好的样品进行编号,放入4 ℃冰箱中进行储藏,每2 d取一次样。不同处理分组为:L0:对照组,不添加任何物质;L1:0.5 g/kg双乙酸钠+8 mg/kg细菌素;L2:1.0 g/kg双乙酸钠+16 mg/kg细菌素;L3:1.5 g/kg双乙酸钠+24 mg/kg细菌素;L4:2.0 g/kg双乙酸钠+32 mg/kg细菌素。
1.2.4.2 测定项目 菌落总数的测定:参照GB 4789.2-2010《菌落总数测定》。挥发性盐基氮(TVB-N)和pH的测定:TVB-N按照GB/T5009.44-2003《肉与肉质品卫生标准的分析方法》中半微量定氮法进行测定。取10 g样品加入100 mL的煮沸冷却后的蒸馏水浸提30 min,过滤后滤液经校正剂校正后,用pH计测定pH。
1.3 数据处理
所有数据都做三组平行实验。数据采用Excel进行分析,计算平均值与标准差。
2 结果与分析
2.1 植物乳杆菌JL-A65 ARTP诱变研究
2.1.1 植物乳杆菌JL-A65 ARTP诱变条件的确定 由图1可知,植物乳杆菌JL-A65致死率随着诱变时间的增加而上升,ARTP诱变处理时间为30 s时,致死率为70%,ARTP诱变处理时间为45 s时,致死率为93%,ARTP诱变处理时间为105 s时,致死率达到了100%。研究表明,致死率为80%~90%时,正突变率较高[22]。所以结合实验结果,选择后续实验处理时间为40 s。

图1 植物乳杆菌JL-A65 ARTP诱变致死率曲线Fig.1 The fatality rate curve of L. plantarumJL-A65 after ARTP mutagenesis
2.1.2 植物乳杆菌JL-A65 ARTP诱变初筛及复筛 以发酵液对大肠杆菌的抑菌圈大小为指标,共对1538株诱变处理菌进行了初筛,有165株菌的抑菌效果较好。将初次筛选所得菌株接种于新鲜的培养基中,连续转接三代,测定发酵液对大肠杆菌的抑菌圈,仍然有16株菌的发酵液抑菌效果比出发菌好,将突变株活化发酵,上清液萃取后利用HPLC检测,计算细菌素产量提高率(见图2)。

图2 ARTP诱变对植物乳杆菌JL-A65细菌素产量的影响Fig.2 The effect of ARTP mutagenesis on bacteriocin production by L. plantarum JL-A65
从图2可以看出,菌株A7-10和A8-110共2株菌发酵液抑菌效果较好。细菌素产量提高率分别为45.1%和48.9%。王兴吉等[23]利用ARTP诱变使突变株产中温α-淀粉酶活力提高了32.2%,王耀耀等[24]利用ARTP诱变使突变株那他霉发酵效价提高了32.5%。菌株A7-10和A8-110细菌素产量提高较高,可以作为亲本库进行下一步融合。
2.2 植物乳杆菌JL-A65 MNNG诱变研究
2.2.1 植物乳杆菌JL-A65 MNNG诱变条件的确定 从图3中可以看出,植物乳杆菌JL-A65致死率随着MNNG浓度的增高而上升,0.5 mg/mL的MNNG处理后致死率为53%,2 mg/mL的MNNG处理后,致死率上升到了90%,MNNG浓度为4 mg/mL时,致死率达到100%。相关研究致死率为80%~90%时,正突变率较高[25-26],最后决定MNNG诱变浓度为1.5 mg/mL。
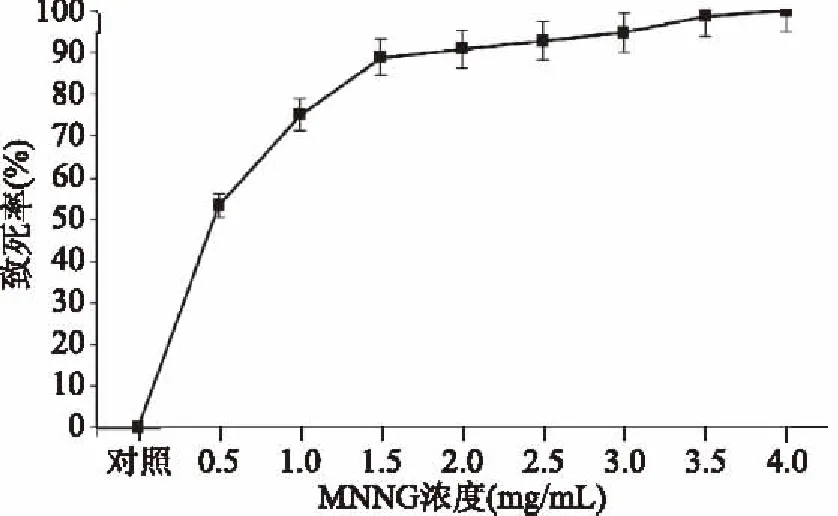
图3 植物乳杆菌JL-A65 MNNG诱变致死率曲线Fig.3 The fatality rate curve of L. plantarum JL-A65 after MNNG mutagenesis
2.2.2 植物乳杆菌JL-A65 MNNG诱变初筛及复筛 以发酵液对大肠杆菌的抑菌圈大小为指标,总共对964株诱变菌进行了初筛,有120株菌的抑菌效果较好。对初次筛选所得菌株,连续转接三代,在大肠杆菌平板上测定发酵液的抑菌圈,仍然有15株菌抑菌效果较好。将抑菌效果好的菌株活化发酵,上清液萃取后用液相检测,计算细菌素产量提高率(见图4)。
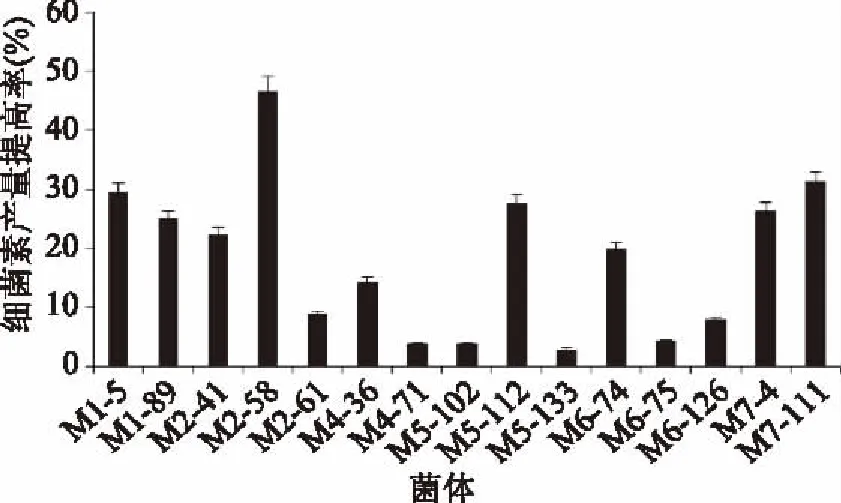
图4 MNNG诱变对植物乳杆菌JL-A65细菌素产量的影响Fig.4 Effect of MNNG mutagenesis on bacteriocin productionby L. plantarum JL-A65
从图4中可以看出,M2-58和M7-111共2株菌产量提高较多,细菌素产量提高率分别为46.6%和31.3%。Yin等[25]利用亚硝基胍诱变突变株谷胱甘肽产量提高了41.8%。丁琳[26]利用亚硝基胍诱变使突变株产林肯霉素相对效价提高了35.4%。M2-58和M7-111细菌素产量提高较多,可以作为亲本库进行下一步融合。
2.3 植物乳杆菌JL-A65基因组改组研究
2.3.1 原生质体制备条件 从图5A可以看出,当培养至8 h时,原生质体形成率达到93.71%,原生质体形成率较高,当培养至8 h时,原生质体再生率达到51.61%。从图5B可以看出,酶浓度在15~35 mg/mL的浓度范围内,原生质体形成率均保持在80%以上的形成率,而当酶浓度为25%时,原生质体再生率达到最大值58.57%。从图5C可以看出,原生质体形成率与再生率均随着酶解温度的延长呈现上升的趋势,当温度达到37 ℃时,原生质体形成率与再生率达到最大值,然后随着温度的升高,呈现下降的趋势。从图5D可以看出,当酶解时间在30 min时,原生质体形成率与再生率达到最大值。

图5 不同条件对原生质体制备的影响Fig.5 Effect of different conditions on protoplast preparation
根据实验结果,选择接种后8 h处于对数生长中后期的菌液,使用25 mg/mL的溶菌酶37 ℃下处理30 min,原生质体形成率为90%以上,再生率为50%以上。
2.3.2 原生质体灭活条件 从图6可以看出,紫外灭活至30 min时,原生质体达到100%的灭活,而为使植物乳杆菌彻底灭活,延长5 min灭活时间,以35 min作为紫外灭活的时间。而当热灭活时间达到40 min,灭活率达到了100%,同样为了使植物乳杆菌彻底灭活,将灭活时间延长5 min,以45 min作为热灭活的时间。

图6 不同处理对原生质体灭活的影响Fig.6 Effect of different treatment on protoplast inactivation
2.3.3 原生质体融合条件 从图7和图8中可以看出,当PEG6000浓度为40%时,原生质体融合率最高,为30%。当融合时间为20 min时,融合率最高,为29%。

图7 PEG浓度对原生质体融合率的影响Fig.7 Effect of different PEG concentration on fusion rate
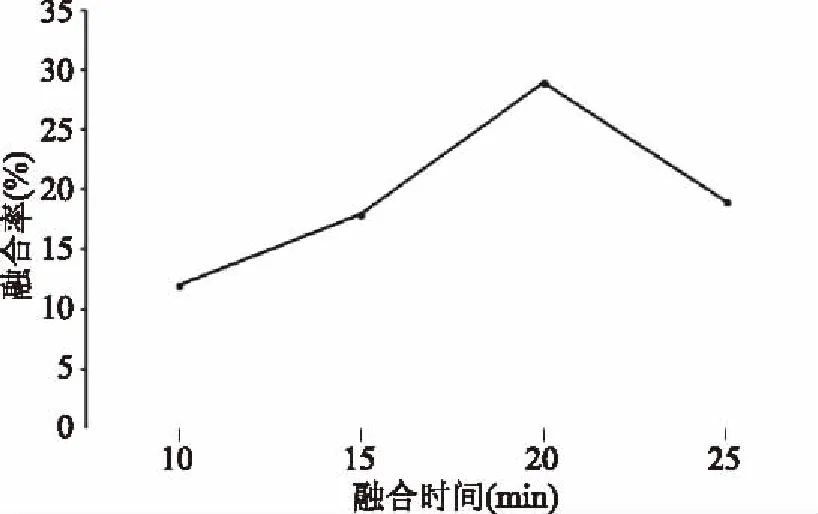
图8 融合时间对原生质体融合率的影响Fig.8 Effect of different fusion time on fusion rate
2.3.4 融合子的筛选 利用经过诱变的初步高产菌株,经过上述融合条件后进行融合子的筛选,经过几轮递推式融合后,得到菌株F4-23,将高产菌株发酵液用高效液相检测,检测结果如图9,细菌素产量为413 mg/L,较原始菌株提高103.48%。经过5次传代培养后,细菌素产量无显著差异(p>0.05)。Zhang等[27]利用基因组重组使突变株nisin产量提高了140%,贾锐等[28]利用基因组重组使突变株地衣芽孢杆菌肽产量提高了70%。菌株L4-23细菌素产量提高较多,可用作植物乳杆菌素的高产菌株。

图9 融合菌株F4-23细菌素产量的HPLC检测图Fig.9 HPLC detection of bacteriocin productionby fusion strain F4-23
2.4 细菌素plantaricin JL-A65对肉丸的防腐保鲜作用
经过诱变与基因组改组,提高了细菌素的产量,之后将细菌素与双乙酸钠复配后添加于肉丸中,研究细菌素对肉制品的防腐保鲜效果。
2.4.1 不同防腐处理对肉丸中菌落总数的影响 由图10中可以看出,在4 ℃储藏条件下,各组间的菌落总数均呈现增加的趋势,菌落总数的判定标准:新鲜肉菌落数为104CFU/g、次鲜肉为104~106CFU/g、变质肉为106CFU/g以上。对照组在第4 d左右菌落数达到4.0 log CFU/g,成为二级鲜肉,在第8 d时菌落总数已经超过6.0 log CFU/g,开始腐败,对照组的保质期约为6 d。L1组在第8 d左右达到6.0 log CFU/g成为腐败肉,保质期保持在6 d左右。L2、L3和L4组在第11 d左右菌落总数达到6.0 log CFU/g,开始腐败,保质期为11 d左右,比对照组延长了5 d。
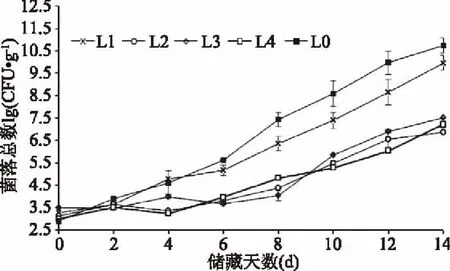
图10 4 ℃储藏条件下不同防腐处理对肉丸中菌落总数的影响Fig.10 Effects of different treatment of total bacterial counts for meatball during storage at 4 ℃注:L0:对照组;L1:0.5 g/kg双乙酸钠+8 mg/kg细菌素;L2:1.0 g/kg双乙酸钠+16 mg/kg细菌素;L3:1.5 g/kg双乙酸钠+24 mg/kg细菌素;L4:2.0 g/kg双乙酸钠+32 mg/kg细菌素。图11~图12同。
2.4.2 不同防腐处理对肉丸中TVB-N的影响 根据图11可以看出,在4 ℃储藏期间各组的TVB-N值均随着储藏时间的延长呈现上升的趋势。挥发性盐基氮的判定标准:一级鲜肉TVB-N值≤15 mg/100 g;次鲜肉15 mg/100 g

图11 4 ℃储藏条件下不同防腐处理对肉丸TVB-N的影响Fig.11 Effects of different treatment for TVB-N values of meatball during storage at 4 ℃
2.4.3 不同防腐处理对肉丸pH的影响 由图12中可以看出,在4 ℃储藏期间各组的pH均呈现上升趋势,对照组及L1组变化幅度较大,而L2、L3和L4组变化相对较小,pH的判定标准为:新鲜肉pH5.8~6.2;次鲜肉pH6.3~6.6;变质肉pH>6.7。在14 d的储藏时期内,对照组在第6 d时,pH接近6.4,达到腐败肉标准,而L1组在第12 d时,pH接近6.4,L2、L3和L4组在第14 d时,pH接近6.4,较对照组保藏期延长至12 d。
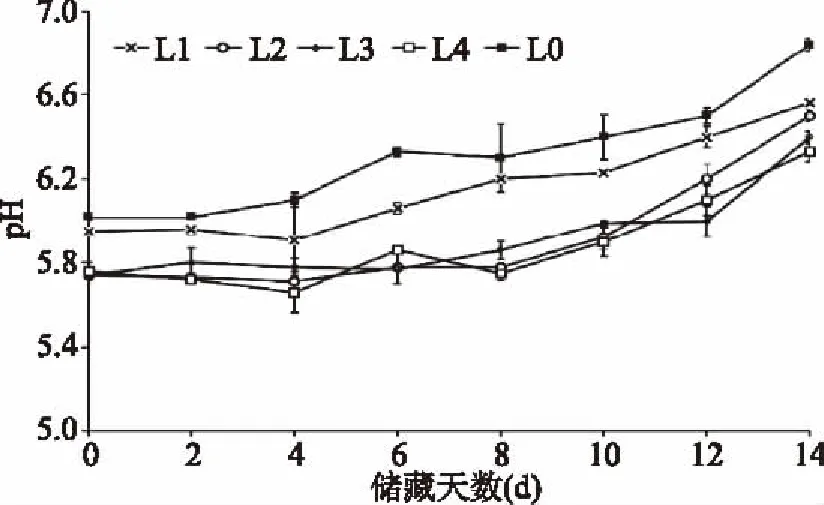
图12 4 ℃储藏条件下不同防腐处理对肉丸pH的影响Fig.12 Effects of different treatment for pH values of meatball during storage at 4 ℃
综合来看,当复配剂的使用量大于1.0 g/kg双乙酸钠+16 mg/kg细菌素时,可以明显地抑制肉制品腐败,使肉丸的保藏期从6 d延长到11 d。这与Zhang等[29]和时威[30]的研究结果相近,Jinlan Zhang将Pentocin 31-1添加到了冷藏猪肉中,使保藏期从6 d延长到了15 d。时威将类细菌素粗提物添加到冷藏猪肉中,使保藏期从7 d延长到15 d。
3 结论
本文采用等离子诱变和甲基硝基亚硝基胍诱变两种方式,筛选得到了A7-10、A8-110、M2-58和M7-111共4株菌,其发酵液的抑菌效果较好。细菌素产量较原始菌株分别提高45.1%、48.9%、46.6%和31.3%。经过4轮递推式融合最终得到一株突变株F4-23,细菌素产量较原始菌株提高103.48%。当复配剂的使用量大于1.0 g/kg双乙酸钠+16 mg/kg细菌素时,可以明显地抑制肉制品腐败,使肉丸的保质期从6 d延长到11 d。实验表明,理化诱变结合基因组改组可以快速筛选到细菌素高产菌株,细菌素对肉丸具有较好的防腐保鲜效果。
——水煮肉丸

