退化和正常窖泥微生物多样性的比较分析
,,,,,,*
(1.湖北文理学院食品科学技术学院,鄂西北传统发酵食品研究所,湖北襄阳 441053)2.湖北古襄阳酒业有限公司,湖北襄阳 441100)
根据生产工艺的差异,白酒可以分为浓香型、酱香型、清香型和米香型四种主体香型,其中浓香型白酒的产量占整个白酒行业的70%左右[1]。浓香型白酒主要采用泥窖固态发酵,窖泥中蕴含着丰富的微生物群系,栖息着大量的乳酸菌、丁酸菌和己酸菌等功能菌,其质量在很大程度上决定了酒的品质[2]。在浓香型白酒酿造过程中,由于窖泥中的营养物质不断被微生物吸收和利用,同时有害物质不断积累,进而导致窖泥出现退化现象,从而影响了白酒的品质。目前,常从色泽、气味、手感及质地等维度对窖泥的质量进行判定,但由于感官指标的滞后性使多数生产或研究人员较难及时预测窖泥的质量[3]。
窖泥微生物群落组成及多样性反映了窖泥质量,且具有对外界环境响应比较迅速的特点[4]。通过采用变性梯度凝胶电泳(Denaturing gradient gel electrophoresis,DGGE)和定量PCR(Quantitative PCR,qPCR)技术,Liang等[5]对四川特别是泸州市成熟及退化窖泥微生物构成进行了解析,结果发现,正常窖泥与退化窖泥的微生物群落结构存在显著差异,证实了通过微生物群落组成预测窖泥质量的可行性。相对于DGGE等指纹图谱技术,高通量测序技术克服了指纹图谱条带信息量低和无法实现样品间平行分析的缺陷[6],具有通量高和拼装结果准确的优点,目前已经在泡菜[7]、腊肠[8]和酸奶[9]等发酵食品中有了广泛的应用。Hu等[10]应用Miseq技术对江苏汤沟浓香型白酒优质、普通和退化窖泥中细菌多样性进行了分析,研究发现随着窖泥质量的提升,Lactobacillus(乳酸杆菌)含量显著减少,而Clostridia(梭菌)和Bacteroidia(拟杆菌)等核心属的含量明显增加。作为国内白酒生产与消费的重要省份,湖北省白酒生产企业近450家,销售收入近800亿元[11],然而目前关于湖北地区浓香型白酒退化和正常窖泥微生物多样性比较分析的研究报道尚少。
本研究从湖北古襄阳酒业正常窖池和废弃窖池中各采集了5份窖泥样品,在提取宏基因组DNA的基础上,使用Miseq高通量测序技术对其细菌多样性进行了解析,同时结合多元统计学方法,对与2类窖泥细菌群落结构差异显著相关的关键细菌类群进行了甄别,通过本项目的实施以期为华中地区窖泥质量预测和窖泥微生物群落结构优化提供理论支撑。
1 材料与方法
1.1 材料与仪器
窖泥 分别采集自湖北古襄阳酒业新旧窖泥车间;E.Z.N.A.®Soil DNA Kit试剂盒 美国OMEGA公司;10×PCR缓冲液、DNA聚合酶和dNTPs Mix 宝生物工程(大连)有限公司;引物338F/806R(其中正向引物前端加入7个核苷酸标签) 由武汉天一辉远生物科技有限公司合成。
vetiri梯度基因扩增仪 美国AB公司;Miseq PE300型高通量测序平台 美国Illumina公司;FluorChem FC3型化学发光凝胶成像系统 美国FluorChem公司;5810R型台式高速冷冻离心机 德国Eppendorf公司;DYY-12型电泳仪 北京六一仪器厂;ND-2000C型微量紫外分光光度计 美国Nano Drop公司;R920型机架式服务器 美国DELL公司。
1.2 实验方法
1.2.1 样品采集及DNA提取 从湖北古襄阳酒业有限公司新旧窖泥车间各选取5个窖池,从窖底取300 g窖泥装入无菌采样袋中低温运送回实验室,采用E.Z.N.A.®Soil DNA Kit试剂盒进行微生物宏基因组DNA提取。旧窖泥车间窖池窖龄均为30年,由于新厂搬迁旧窖池已2年未使用,但均填充酒糟并覆盖窖皮泥进行密封。新窖池窖龄为2年,新旧窖池距离约5 km,且深度均为2.2 m。其中退化窖泥组5个样品分别命名为D1、D2、D3、D4和D5,正常窖泥组5个样品分别命名为N1、N2、N3、N4和N5。
1.2.2 细菌16S rDNA序列PCR扩增及高通量测序 扩增体系为:DNA模板10 ng,10×PCR缓冲液4 μL,2.5 mmol/L dNTPs mix 2 μL,5 U/μL DNA聚合酶0.4 μL,5 μmol/L正向和反向引物各0.8 μL,体系用ddH2O补充至20 μL。扩增条件为:95 ℃ 3 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,35个循环,72 ℃ 10 min。检测合格的PCR产物寄往上海美吉生物医药科技有限公司使用Miseq PE300平台进行高通量测序。
1.2.3 序列质控 将下机序列拼接后依照核苷酸标签(barcode)信息划分到各样品,同时将barcode和引物予以切除进而得到高质量的序列。拼接过程中序列应满足如下要求,否则予以删除:重叠区大于等于10 bp;最大错配比率小于等于0.2;barcode碱基无错配;引物碱基错配数小于等于2 bp。
1.2.4 生物信息学分析 采用QIIME(v1.70)平台[12]进行2类窖泥细菌物种分析和多样性评价。主要的处理流程为:a.采用PyNAST校准并把序列排齐[13];b.采用两步UCLUST法依次按照100%和97%相似性进行无重复的单一序列集和分类操作单元(Operational taxonomic units,OTU)构建[14];c.应用ChimeraSlayer去除含有嵌合体序列的OTU[15];d.从去除嵌合体的OTU中选取代表性序列,使用RDP(Ribosomal database project,Release 11.5)[16]和Greengenes(Release 13.8)[17]数据库进行序列同源性比对,在门、纲、目、科和属水平上对其分类学地位进行明确。若隶属于某一门或属的样品在10个窖泥样品中的平均相对含量大于1.0%,则将其定义为优势门或属[18]。e.从去除嵌合体的OTU中选取代表性序列,使用FastTree软件绘制系统发育进化树[19],并对超1指数(Chao1 index)和香农指数(Shannon index)等α多样性指数进行计算[20]。f.基于UniFrac距离[21]进行主坐标分析(Principal coordinate analysis,PCoA)和非加权组平均法(Unweighted pair-group method with arithmetic means,UPGMA)聚类分析,进而完成不同样品间细菌群落结构的β多样性分析。
1.2.5 核酸登录号 序列数据提交至MG-RAST数据库(http://metagenomics.anl.gov/),登录号为mgp83663。
1.2.6 多元统计学分析 使用Mann-Whiney检验对2类窖泥微生物群落的超1指数、香农指数、优势细菌门和属平均相对含量进行显著性分析;采用多元方差分析(Multivariate analysis of variance,MANOVA)对2类窖泥细菌群落结构差异性进行分析;采用冗余分析(Redundancy analysis,RDA)对与2类窖泥细菌群落结构差异显著相关的关键类群进行甄别;采用欧式距离对2类窖泥细菌群落结构组间差异进行计算。使用Canoco 4.5软件绘制RDA图,使用Matlab 2010b软件绘制热图,使用Mega5.0软件绘制系统发育树,其他图使用Origin 8.6软件绘制。
2 结果与分析
2.1 序列丰富度和多样性分析
在提取窖泥微生物宏基因组DNA的基础上,本研究采用Miseq高通量测序技术对2类窖泥细菌群落结构进行了解析,10个样品共产生280822条高质量序列,平均每个样品28082条。在使用PyNAST将序列对齐时,有840条序列比对失败,因而共有279982条序列进行了OTU的划分。10个窖泥样品16S rDNA V4~V5区序列测序情况及各分类地位数量如表1所示。

表1 样品16S rDNA测序情况及各分类地位数量Table 1 16S rDNA read counts and number of identifiable units at different taxonomical levels
由表1可知,本研究采用两步UCLUST法进行了OTU的划分,根据序列100%相似性聚类分析后,挑选出了100439条代表性序列,根据序列97.0%相似性聚类分析后,得到了14368个OTU,经嵌合体检查后去除了6762个OTU,还剩余7606个OTU,平均每个样品1339个。在OTU划分的基础上,本研究将序列鉴定为26个门、66个纲、108个目、233个科和524 属,其中有0.034%和14.31%的序列不能鉴定到门和属水平。经过序列比对和嵌合体去除后,含有序列数最少的样品有18588条序列,故而在进行α多样性计算时,所有样品测序深度均取18510条序列。经Mann-Whiney检验发现,退化窖泥微生物群落的超1指数和香农指数均显著高于正常窖泥(p<0.05),这说明窖泥退化后其细菌的多样性和丰度均会显著提升。
2.2 基于各分类学地位相对含量的2类窖泥细菌构成研究
在序列丰富度和多样性分析的基础上,本研究进一步基于分类学地位“门”和“属”水平对窖泥细菌构成进行了揭示,2类窖泥中优势细菌门相对含量的比较分析如图1所示。

图1 2类窖泥中优势细菌门相对含量的比较分析Fig.1 Relative abundances of the majorbacterial phyla among 2 types pid mud samples
由图1可知,退化窖泥中平均相对含量大于1.0%的细菌门及其含量分别为:Firmicutes(硬壁菌门,68.70%)、Bacteroidetes(拟杆菌门,13.80%)、Spirochaetes(螺旋体门,4.86%)、Synergistetes(互养菌门,3.70%)、Chloroflexi(绿弯菌门,3.53%)、Proteobacteria(变形菌门,1.84%)和Actinobacteria(放线菌门,1.89%)。正常窖泥中平均相对含量大于1.0%的细菌门及其含量分别为:Firmicutes(硬壁菌门,86.79%)、Proteobacteria(变形菌门,6.28%)、Actinobacteria(放线菌门,4.65%)和Bacteroidetes(拟杆菌门,1.29%)。经Mann-Whiney检验发现,退化窖泥中Spirochaetes(螺旋体门)、Synergistetes(互养菌门)和Chloroflexi(绿弯菌门)相对含量显著高于正常窖泥(p<0.05)。2类窖泥中优势细菌属相对含量的比较分析如图2所示。
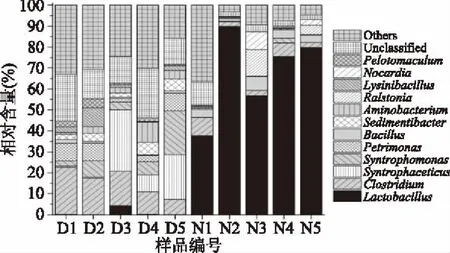
图2 2类窖泥中优势细菌属相对含量的比较分析Fig.2 Relative abundances of the major bacterial genera among 2 types pid mud samples
由图2可知,退化窖泥中平均相对含量大于1.0%的细菌属及其含量分别为:隶属于Firmicutes(硬壁菌门)的Clostridium(梭菌,14.77%)、Syntrophaceticus(12.01%)、Syntrophomonas(互营单胞菌属,8.21%)、Sedimentibacter(沉淀杆菌属,3.93%)、Lysinibacillus(梭形杆菌属,3.11%)、Pelotomaculum(2.05%)和Lactobacillus(乳酸杆菌,1.01%);隶属于Bacteroidetes(拟杆菌门)的Petrimonas(6.01%);隶属于Synergistetes(互养菌门)的Aminobacterium(胺小杆菌属,4.08%)。正常窖泥中平均相对含量大于1.0%的细菌属及其含量分别为:隶属于Firmicutes(硬壁菌门)的Lactobacillus(乳酸杆菌,67.91%)、Clostridium(梭菌,4.49%)和Bacillus(芽孢杆菌,3.80%);隶属于Proteobacteria(变形菌门)的Ralstonia(雷尔氏菌属,3.65%)和隶属于Actinobacteria(放线菌门)的Nocardia(诺卡氏菌属,2.41%)。
经Mann-Whiney检验发现,退化窖泥中Clostridium(梭菌)、Syntrophaceticus、Syntrophomonas(互营单胞菌属)、Petrimonas、Sedimentibacter(沉淀杆菌属)、Aminobacterium(胺小杆菌属)、Lysinibacillus(梭形杆菌属)和Pelotomaculum的相对含量显著高于正常窖泥(p<0.05),而Lactobacillus(乳酸杆菌)、Bacillus(芽孢杆菌)、Ralstonia(雷尔氏菌属)和Nocardia(诺卡氏菌属)呈现出相反的趋势(p<0.05)。
2.3 基于多元统计学分析的2类窖泥细菌群落结构的研究
在完成2类窖泥微生物构成解析的基础上,本研究进一步采用基于OTU水平加权UniFrac距离的PCoA和UPGMA对10个窖泥样品的β多样性进行了揭示,基于分类操作单元加权UniFrac距离的主坐标分析如图3所示。

图3 基于分类操作单元加权UniFrac距离的主坐标分析Fig.3 Principal coordinate analysis of OTUs based on weighted unifrac distance
由图3可知,在以2个权重最高的主成分PC1和PC2作图时,退化窖泥样品分布在一四象限,而正常窖泥分布在二三象限,其中第1和第2主成分分别占全部变量72.22%和8.87%的权重。由此可见,退化窖泥和正常窖泥样品在空间排布上呈现出明显的区分,这说明两者微生物群落结构可能存在较大差异。为了对这一结果进行验证,本研究采用UPGMA对2类窖泥微生物群落结构进行了分析,结果如图4所示。

图4 基于分类操作单元加权UniFrac距离的UPGMA聚类分析Fig.4 UPGMA clustering analysis of OTUs based on weighted unifrac distance
由图4可知,聚类I由退化窖泥样品构成,聚类II由正常窖泥样品构成。由此可见,UPGMA结果与PCoA结果一致,即2类窖泥微生物群落结构可能存在较大的差异。在采用非监督多变量统计学方法进行分析的基础上,本研究选取了PCoA前80%的PC进行了MANOVA,结果发现正常窖泥和退化窖泥微生物群落结构差异极显著(p<0.001)。
由图3亦可知,退化窖泥样品的空间排布较之正常窖泥分散,这说明退化窖泥样品微生物群落结构的组间差异可能要高于正常窖泥,本研究进一步基于欧氏距离对该推论进行了验证,结果如图5所示。
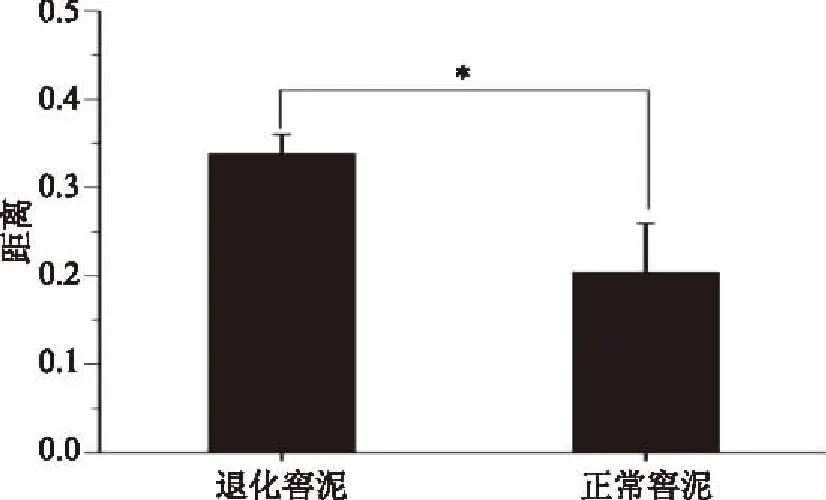
图5 基于欧氏距离的2类窖泥细菌群落结构组间差异分析Fig.5 Differences in the bacterial community structure between 2 types pid mud samples calculated by euclidean distances
2.4 关键细菌类群的甄别
采用基于OTU水平加权UniFrac距离的PCoA和UPGMA分析发现,正常窖泥和退化窖泥微生物群落结构差异极显著(p<0.01),本研究以窖泥分组(正常/退化)为起约束作用的解释变量,以平均相对含量大于0.5% OTU为响应变量,采用RDA对导致2类窖泥微生物群落结构差异显著的关键细菌类群进行了甄别。数据中有35.2%的变异度能够被退化窖泥/正常窖泥分组所解释,而通过蒙特卡罗置换检验发现这一约束因素具有显著性(p<0.05)。RDA双序图如图6所示。

图6 RDA双序图Fig.6 Biplot of the RDA
由图6可知,OTU11613、OTU2965、OTU1586、OTU5725、OTU9805、OTU7629、OTU2455、OTU4543和OTU1402共9个OTU与RDA排序图约束轴上的样本赋值良好相关,由此可见,9个OTU代表了2类窖泥微生物群落结构差异显著相关的关键细菌类群。在RDA排序图中可以看到,隶属于Clostridium(梭菌)的OTU9805和OTU7629、隶属于Syntrophomonas(互营单胞菌属)的OTU2455、隶属于Pelotomaculum的OTU4543和隶属于Synergistaceae(互养菌科)的OTU1402位于图的右侧(即退化窖泥),这说明该5个OTU在退化窖泥中的相对含量可能较高;OTU11613、OTU2965、OTU1586和OTU5725 4个隶属于Lactobacillus(乳酸杆菌)的OTU位于图的左侧(即正常窖泥),这说明该4个OTU在正常窖泥中的相对含量可能较高。9个关键OTU在各样品中相对含量的热图如图7所示。
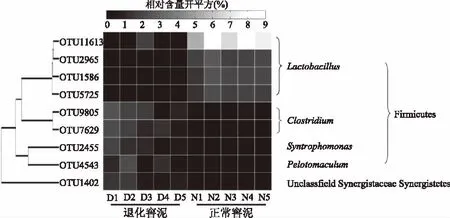
图7 9个关键OTU在各样品中相对含量的热图Fig.7 Relative abundances of the 9 OTUs identified as key variables for the differentiation of microbiota in 2 types pid mud samples注:左侧为系统发育树。
由图7可知,OTU9805、OTU1402、OTU7629、OTU2455和OTU4543在退化窖泥中的平均相对含量分别为2.57%、2.27%、1.36%、1.40%和1.20%,而在正常窖泥中平均相对含量亦均小于0.1%。与此相反,OTU11613在正常窖泥中的平均相对含量显著高于退化窖泥,其在正常窖泥中含量为56.27%,而在退化窖泥中仅为0.70%。此外,OTU2965、OTU1586和OTU5725在正常窖泥中的平均相对含量分别为4.21%、4.09%和3.29%,而在退化窖泥中的含量均小于0.1%。Mann-Whitney检验的结果显示,除均隶属于Lactobacillus(乳酸杆菌)的OTU1586和OTU5725外,其他7个OTU在2类窖泥中的差异具有统计上的显著性(p<0.05)。
3 讨论与结论
窖泥的质量直接决定了浓香型白酒的质量,正常的窖泥为灰褐(黑)色,有较强的酯香味和微弱的硫化氢气味,而退化窖泥为银灰色或白色针状晶体结块,酯香气较弱。虽然通过感官特征可以对窖泥的质量进行评价,但其变化较其中微生物群落组成及物种多样性变化缓慢[11]。香农指数广泛应用于生态系统稳定性的评价[22],窖泥微生物群落的多样性受空间[23]和窖龄[24-25]的影响。本研究发现,退化窖泥细菌群落的香农指数均较之正常窖泥高。随着窖泥的退化,优势细菌微生物群落组成在原有Firmicutes(硬壁菌门)、Proteobacteria(变形菌门)、Actinobacteria(放线菌门)和Bacteroidetes(拟杆菌门)4 个门的基础上,又增加了Spirochaetes(螺旋体门)、Synergistetes(互养菌门)和Chloroflexi(绿弯菌门)3个门,同时优势细菌属也从5个增加到9个。通过对江苏汤沟浓香型白酒优质、普通和退化窖泥中细菌多样性进行对照分析,Hu等[10]发现,正常窖泥细菌群落的香农指数高于退化窖泥而与优质窖泥差异不显著,其研究结论与本研究不同的原因可能在于两个研究中退化窖泥的选择不同,Hu选择的退化窖泥采集自尚在使用中的窖池,而本研究采集的退化窖泥来自已2年未使用的窖池。
作为正常窖泥中的优势菌,本研究发现Lactobacillus(乳酸杆菌)的平均含量高达67.91%。虽然有研究指出乳酸菌含量过高会影响窖泥的品质[11],但其产生的乳酸菌可与乙醇生成乳酸乙酯,同时对杂菌的生长亦有一定的抑制作用[26]。通过采用DGGE技术对泸州老窖窖泥中的乳酸菌多样性进行分析,熊亚等[27]发现耐酸乳杆菌(L.acetotolerans)为窖泥中乳酸菌的优势种群。王葳等[28]亦使用纯培养方法从窖泥中分离出了L.zeae(玉米乳杆菌)、L.pentosus(戊糖乳杆菌)和Pediococcusacidilactici(乳酸片球菌)。通过产生己酸、丁酸和氢[29],梭菌对浓香型白酒香气的形成亦起着重要作用[30],古襄阳酒业为了加快窖泥的熟化通常会向新窖池中加入梭状芽胞杆菌。本研究发现退化窖泥中Clostridium(梭菌)的相对含量反而高于正常窖泥,这可能是由于Miseq高通量测序只能实现微生物属的相对定量,因而在后续研究中进一步使用qPCR对窖泥中梭菌进行绝对定量是极为必要的。
本研究通过对与退化窖泥细菌群落结构差异显著相关的关键细菌类群进行甄别,证实了细菌多样性可以较为科学的判定窖泥质量,进而为后续窖泥质量优化和退化防止提供了一定的理论支撑。由于本研究的退化窖泥样品采集自已两年未使用的窖池,因此在后续研究中,从正在使用的窖池中采集退化窖泥样品,并对其细菌多样性进行揭示,从而进一步检验和完善本研究的结果是极为必要的。

