继发性噬血细胞综合征的18F-FDG PET/CT特征
胥芹,丁浩源,蔡亮,朱艳,黄占文,陈跃
西南医科大学附属医院核医学科,四川泸州 646000;
噬血细胞综合征(hemophagocytic syndrome,HPS)又称为噬血细胞性淋巴组织细胞增多症(hemophagocytic lymphohistiocytosis,HLH),继发于风湿系统疾病时称为巨噬细胞活化综合征(macrophage activation syndrome,MAS),是由多种病因引起的淋巴细胞、单核细胞、巨噬细胞系统过度活化和增生,分泌大量炎性因子形成高度炎症活动状态,从而出现持续发热、进行性血细胞减少、肝脾肿大、肝功能损害、凝血功能异常、神经功能障碍、皮肤病学异常等一系列临床综合征[1]。HPS分为原发性和继发性,患者病情进展快,死亡率较高。早期诊断及继发病因的鉴别对指导治疗尤为重要。PET/CT近年广泛用于肿瘤等疾病的诊疗,但用于诊断 HPS的研究较少,且多为个案报道,部分患者行PET/CT检查时偶然发现异常,但在缺少病理活检时PET/CT显像的意义尚不明确。既往研究[2-5]总结了继发HPS的显像特点、PET参数的预后意义,但病例数均较少,其价值需进一步研究。本研究回顾性分析35例继发性HPS的PET/CT表现,探讨其应用价值,提高对本病的认识水平。
1 资料与方法
1.1 研究对象 收集2013年2月-2017年10月西南医科大学附属医院收治的确诊为继发性HPS并行PET/CT检查的35例患者,均符合国际组织细胞协会2004年修订的HPS诊断标准[6],其中男21例,女14例;年龄15~65岁,中位年龄48岁。35例患者主要临床表现为发热、铁蛋白升高及脾大,其次为噬血现象、血细胞减少、高三酰甘油、低纤维蛋白原、肝功能损害,32例患者单独或合并感染,以及凝血功能异常而出现多部位不同程度的出血,2例合并弥散性血管内凝血(表1)。所有患者均进行随访。
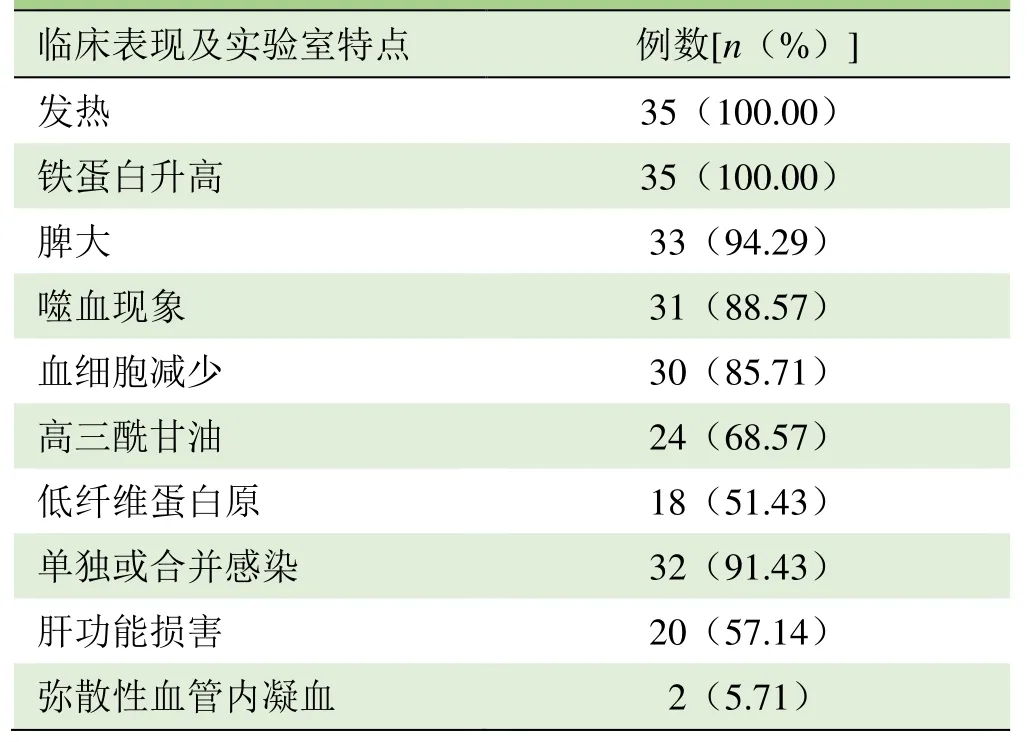
表1 35例HPS患者的临床及实验室特点
1.2 仪器与方法 显像剂18F由我院采用 Siemens eclipse HP/RD回旋加速器生产,并通过北京派特公司FDG-N型自动合成模块制备18F-FDG,放化纯度>95%。全身显像采用Philips GEMINI TF/16 PET/CT仪。患者检查前空腹6 h以上,控制血糖<11.1 mmol/L,经手臂静脉注射18F-FDG 3.70~5.55 MBq/kg,患者在安静、适宜温度下休息45~60 min,排空膀胱后进行CT扫描,扫描参数:管电压120 kV,管电流100 mAs,层厚5 mm。然后行PET三维采集,采集6~7个床位,2.5 min/床位,应用CT数据进行衰减校正,PET图像采用迭代重建,生成横断面、冠状面、矢状面断层图像以及三维投影图像。
1.3 图像分析 由2名具有5年以上影像诊断经验的医师对CT、PET及融合图像进行独立分析,意见不一致时由科室讨论决定。利用感兴趣区(ROI)测量病变部位的最大标准化摄取值(SUVmax)。测量脾脏、肝脏、增大淋巴结的SUVmax,选定下胸椎到腰椎(T10~L4)的SUVmax。同时在纵隔(升主动脉)勾画ROI,计算脾脏/纵隔、骨髓/纵隔的SUVmax比值。以SUVmax>2.5判断为阳性,当SUVmax<2.5时,则以肝脏作为参照标准,高于肝脏视为阳性。
1.4 统计学方法 采用SPSS 19.0软件,计量资料进行正态性检验,符合正态分布的计量资料以表示,两组SUVmax差异比较采用成组资料t检验,各实验室指标与脾脏、骨髓的18F-FDG摄取的相关性采用Spearman相关分析,P<0.05表示差异有统计学意义。
2 结果
2.1 PET/CT对继发性 HPS良恶性病变的鉴别诊断35例患者中,2例经随访病因未明,其中1例死亡,1例失访;19例HPS继发于血液系统恶性病变,17例为淋巴瘤相关HPS,T细胞相关11例,B细胞相关3例,未分类4例,1例为侵袭性NK细胞白血病/淋巴瘤,另1例经随访诊断为多发性骨髓瘤。14例HPS继发于感染,1例患系统性红斑狼疮,另1例经随访最终诊断为成人Still病。23例患者检出感染(13例EB病毒阳性,单独或合并结核、乙型肝炎、真菌、细菌等),其中12例为单纯感染,其他合并原发疾病发生。PET/CT对肿瘤相关性 HPS的诊断敏感度为89.47%,特异度为85.71%,准确度为87.88%,阳性预测值为89.47%,阴性预测值为85.71%,见表2。

表2 18F-FDG PET/CT对肿瘤相关性HPS的诊断效能(例)
2.2 PET/CT表现 HPS在18F-FDG PET/CT图像上主要表现为脾大,脾脏及骨髓糖代谢增高,淋巴结增大伴糖代谢增高,常同时合并肺炎及多浆膜腔积液等非典型表现。恶性病变组与非恶性病变组的 PET/CT表现比较见图1、2,HPS患者不同病因的影像学特征见表3。4例患者行2次PET/CT检查,2例病情缓解后原高代谢灶代谢减低,1例患者原增大淋巴结糖代谢减低,但出现新发病灶,治疗后脾脏糖代谢减低,病情稍缓解,发病后19个月因脑出血死亡(图3)。另1例病情加重,复查骨髓及脾脏代谢均较前增高,肺部实性病变范围扩大,最终放弃治疗,78 d后死亡。
2.3 不同组别SUV比较及相关性分析 恶性病变组与非恶性病变组脾脏、骨髓平均SUVmax及增大淋巴结SUVmax比较,差异有统计学意义(P<0.05),见表4。相关性分析结果显示,中性粒细胞计数与脾脏SUVmax(r=0.497,P<0.05)及脾脏 SUVmax/纵隔SUVmax比值(r=0.512,P<0.05)均呈中度正相关,血红蛋白与脾脏SUVmax(r=-0.490,P<0.05)及脾脏SUVmax/纵隔SUVmax比值(r=-0.512,P<0.05)均呈中度负相关,中性粒细胞、白细胞、红细胞、血小板、乳酸脱氢酶、C-反应蛋白、谷丙转氨酶、三酰甘油、纤维蛋白原、铁蛋白与骨髓SUVmax及骨髓 SUVmax/纵隔 SUVmax比值均无相关性(r=-0.381~0.575,P>0.05)。
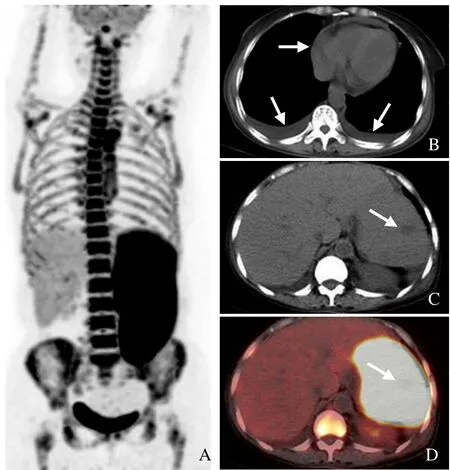
图1 女,62岁,B细胞淋巴瘤相关HPS。PET/CT全身最大密度投影图示肝、脾增大,脾脏及骨髓弥漫性18F-FDG摄取增高(A);同机CT示胸腔及心包积液(箭,B);断层融合显像示脾内斑片状低密度影(箭),脾脏及骨髓显像剂浓聚,SUVmax分别为11、8.5(C、D)。纵隔内气管旁淋巴结增大伴显像剂浓聚(未显示)
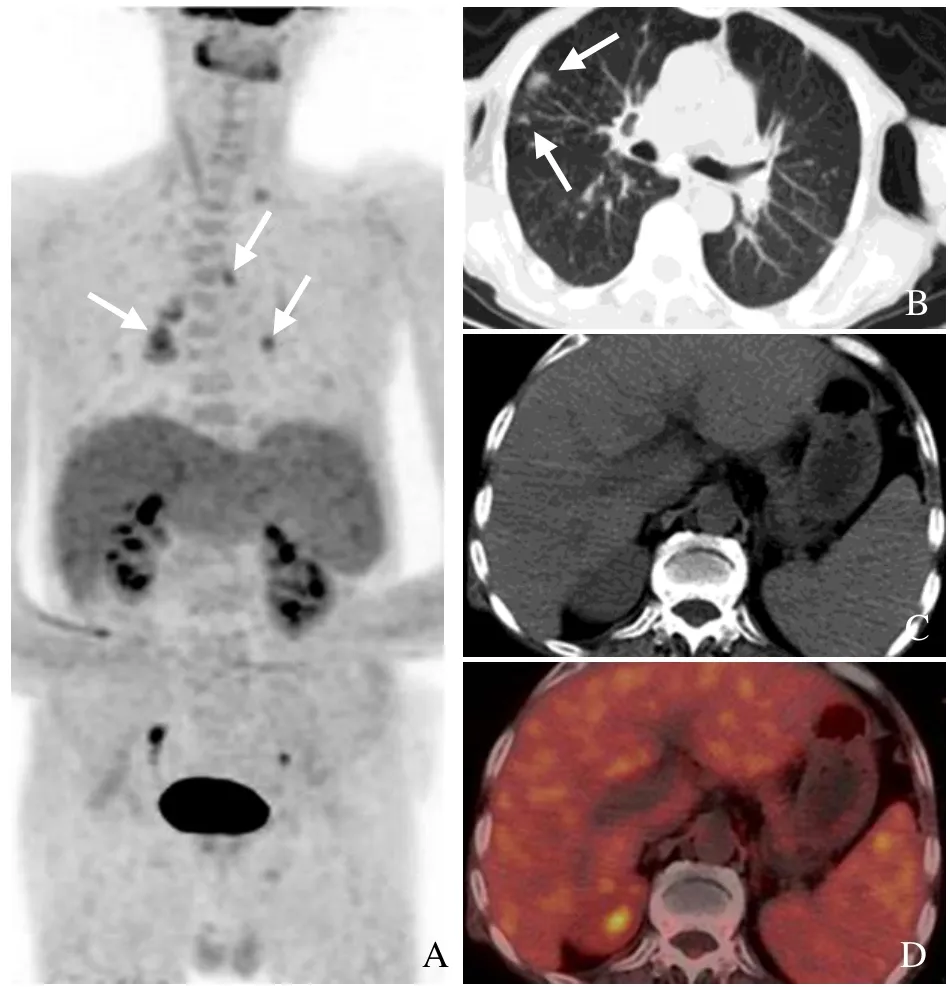
图2 男,62岁,EB病毒相关HPS,合并尘肺伴多发感染,PET/CT全身最大密度投影图示肝、脾增大,18F-FDG均摄取增高,纵隔及双侧肺门淋巴结显示、增大,18F-FDG摄取增高(箭,A);同机CT示肺内多发斑片及结节影(箭,B);断层融合显像示肝、脾显像剂浓聚,SUVmax分别为3.3、3.0,实质密度未见异常(C、D)。胸腔及心包积液(未显示)
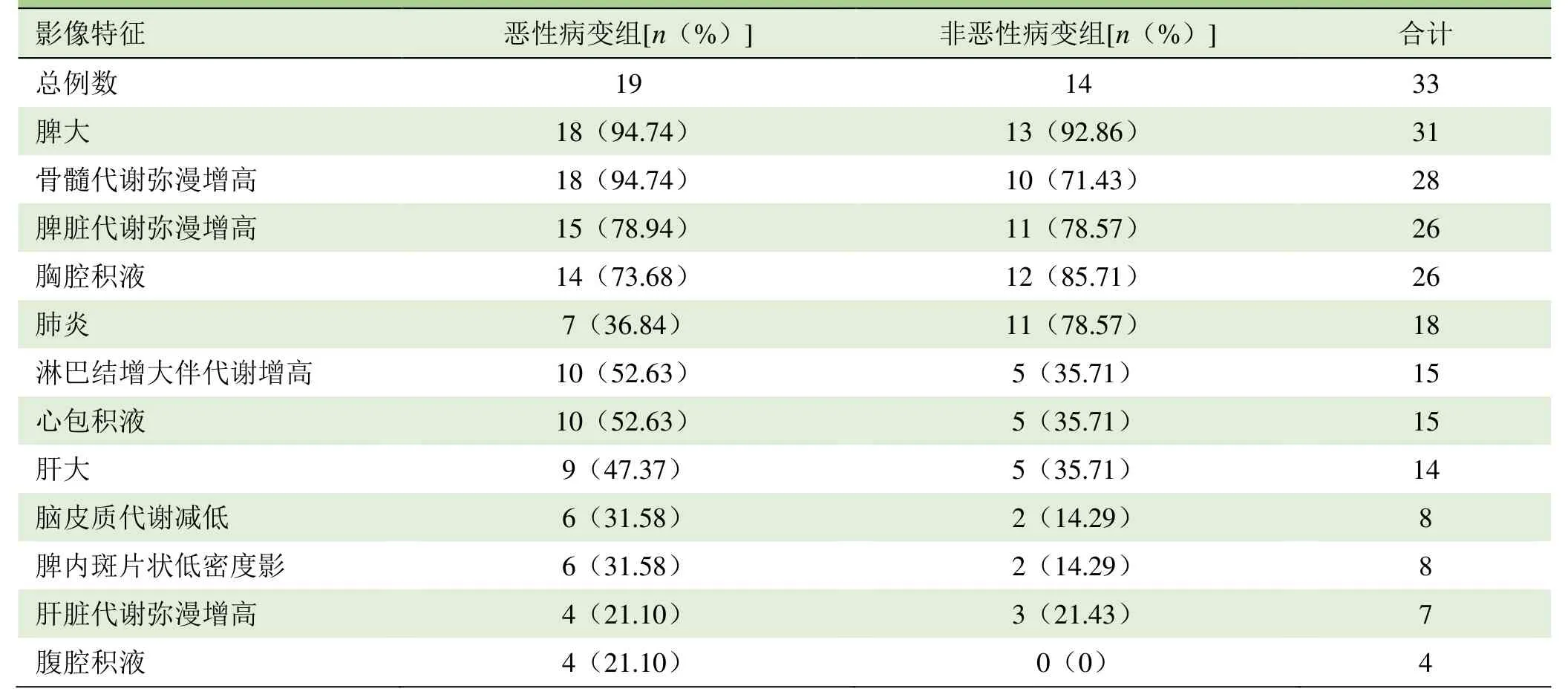
表3 HPS患者不同病因的影像特征
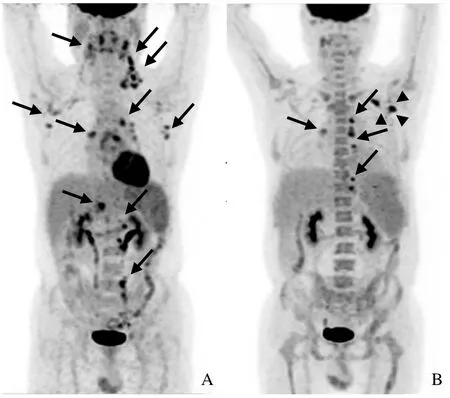
图3 男,60岁,T细胞淋巴瘤相关HPS。双侧咽旁、双侧颌下、椎旁间隙、左侧锁骨上窝、左侧锁骨下窝、双侧腋窝、纵隔、双侧肺门、右侧心膈角、肝门、胰周、脾门、腹膜后及腹主动脉旁淋巴结显示、增大(箭),18F-FDG摄取增高,SUVmax为7.0,脾大,糖代谢增高,SUVmax为3.8(A);治疗后多处淋巴结显示、增大(箭),18F-FDG摄取增高,SUVmax为6.3,病灶较前次显像明显减少,左侧内乳区为新发病灶(箭头),脾大,糖代谢较前减低,骨髓糖代谢增高(B)。患者治疗后病情好转,但反复,后因脑出血死亡
3 讨论
HLH是高炎症状态引发多器官系统受累的临床综合征,分为原发性及继发性,任何年龄均可发病。原发性 HPS是常染色体隐性遗传病,基因检测有助于诊断,继发病因多样,常见病因包括严重感染、肿瘤、自身免疫性疾病,继发者以成人多见,且主要继发于感染(以EB病毒、巨细胞病毒、疱疹病毒等最常见)[7]及肿瘤[8]。最初命名为组织细胞性髓性网状细胞增生症的HPS由Scott于1939年首次报道,HPS病情较凶险,近年逐渐受到关注,不同病因所致HPS的预后不同,恶性肿瘤患者预后最差,免疫相关性HPS预后相对较好[9]。

表4 恶性病变组与非恶性病变组SUVmax比较(x ±s)
近年PET/CT在肿瘤诊断及疗效评估方面的价值得到肯定,并逐渐应用于不明原因发热、感染、免疫性疾病等方面[10-12],但其用于HPS的报道较少,Suga等[13]报道PET/CT有助于骨髓活检的定位,尤其是多次穿刺仍不能找到病因的患者。单纯的CT不易发现淋巴瘤肝脏或脾脏的浸润情况,但结合 PET能明显提高诊断敏感度和特异度[14]。血液系统恶性疾病是导致继发性HPS的重要病因之一。继发性HPS的治疗,除对继发性HPS所致高度炎症的控制、诱导缓解外,为防止复发,寻找原发病因及原发病治疗至关重要[15]。本研究中恶性肿瘤所致 HPS比例相对较高,可能是由于进行PET/CT检查的患者主要是为了排除肿瘤因素,造成一定样本上的选择偏倚。2例表现为脾脏、骨髓摄取明显增高及多发淋巴结肿大,其中1例伴脾脏斑片状低密度影,PET/CT均倾向于淋巴瘤。随访发现,1例患者最终诊断为成人Still病,其为排除性诊断,其表现与HPS类似,当两者同时发生时,应注意鉴别[16-17]。另1例诊断为EB感染相关性HPS,并出现继发骨髓纤维化,造成PET/CT假阳性结果。但PET/CT对于恶性肿瘤所致HPS的诊断敏感度及特异度仍然较高,与Kim等[2]的研究结果一致。在PET/CT表现上,恶性病变组和非恶性病变组有较多相似之处,但肿瘤相关组多伴有淋巴结肿大,且常表现为全身多处、多发的淋巴结增大,显像剂的摄取程度高于非恶性病变组,可能与非恶性病变组多为反应性淋巴结增生有关。对PET/CT上伴有明显显像剂摄取的淋巴结进行活检,可以指导临床更准确、及时地进行病因诊断,而恶性病变组平均SUVmax显著高于非恶性病变组,淋巴瘤的骨髓及脾脏浸润能促使较高程度的显像剂摄取,本研究中诊断为淋巴瘤的11例患者骨髓活检证实有骨髓浸润,一定程度上有助于鉴别。
在制订的诊断标准中,尽管病理活检不是HPS必须的诊断要求,但是通过活检发现噬血细胞能增加诊断的信心,尤其是对单独化疗后不能缓解的患者,可以提供有用的证据进行更多有效的治疗。除骨髓外,噬血细胞也可以存在于脾脏、淋巴结,甚至脑脊液中,Kim 等[18]报道患者因不明原因发热及血细胞进行性减少入院,PET/CT检查发现脾脏糖代谢异常增高,行脾切除后活检发现大量的噬血细胞,最终确诊,及时给予诱导缓解治疗,患者病情好转。早期诊断并及时控制炎症因子风暴可以改善患者的预后[8]。本研究中30例患者均在骨髓中证实存在噬血现象,另1例行脾切后发现噬血现象。因此,PET/CT可以提示噬血细胞浸润,有助于早期诊断,而骨髓活检阴性并不能排除HPS的可能。
除符合诊断要求的临床表现及实验室特点外,全身PET/CT还可以发现不同部位的病变。本研究显示,27例患者合并浆膜腔积液,可能与肝功能损害蛋白减少或感染性渗出有关,肺炎也较多见,在感染相关HPS中尤为显著,实验室检查未发现明确的病原时,影像学改变可以提供更多抗感染、抗炎治疗的依据。6例患者脑糖代谢明显减低,既往研究显示HPS可以使中枢神经系统受累,出现意识障碍、头痛、癫痫等症状,CT上可表现为单个或多个低密度灶,MRI可出现脑皮质局灶性信号异常,弥漫性的白质信号异常及脑膜强化,累及小脑,但在丘脑、基底神经节和脑干中的损伤少见[19-20]。中枢受累患者预后更差,部分可遗留神经系统后遗症。
多种因素可以影响骨髓及脾脏的糖代谢,既往研究显示脾脏、骨髓的18F-FDG摄取与中性粒细胞、白细胞计数及C-反应蛋白呈不同程度正相关,并提出骨髓摄取增高可能与粒细胞祖细胞调控及内源性造血生长因子刺激有关[21-22]。脾脏是机体免疫器官之一,Pak等[23]通过进行PET/CT当日采血对比分析多种细胞因子与脾脏摄取的关系,发现脾脏18F-FDG摄取与机体炎症反应及免疫反应有关,巨噬细胞数量及活性均可使脾脏的糖代谢增高,18F-FDG在脾脏及骨髓的摄取可以反映炎症反应的程度。Yang等[3]对34例淋巴瘤相关 HPS与骨髓摄取关系的研究证实,骨髓的摄取可以一定程度上反映细胞因子风暴的水平。骨髓及脾脏与血红蛋白水平之间的关系尚存在争议,其负相关关系可能是贫血导致的骨髓增生活跃及髓外造血。与本研究结果类似,但仅14例患者收集到C-反应蛋白值,样本量过少,有待进一步研究。本研究采用骨髓和脾脏SUVmax/纵隔SUVmax比值,结果发现脾脏SUVmax/纵隔SUVmax比值的相关程度较单独的脾脏 SUVmax稍高。Inoue等[24]报道计算病变SUVmax与肝脏的比值可以减小个体差异,但当肝脏本身有病变时则不宜使用,HPS患者常伴有肝脏18FFDG摄取,部分淋巴瘤可浸润肝脏,因此本研究采用纵隔血池作为参考。但未观察到骨髓与实验室指标的相关性,可能与病例的选择有关。
HPS死亡率高,随着对本病的不断认识及积极治疗,Bergsten等[8]报道在HLH-2004诊断及治疗方案应用后,患者的5年生存率从HLH-94方案的54%提高到61%,在异基因造血干细胞移植前死亡率从27%下降到19%,但该研究仅纳入<18岁的患者。Schram等[9]的多中心研究纳入68例患者,年龄18~77岁,中位随访时间4个月,死亡率达69%,其中恶性肿瘤患者的预后最差。黄莉等[25]报道HPS的死亡率为50%~80%。本组患者中位随访时间4个月(2~49.6个月),存活率仅为28.5%,多数患者因经济或病情等原因放弃治疗。Zheng等[4]对43例患者的预后进行多因素分析,发现治疗方案、纤维蛋白原、脾脏纵隔率(SP/M)是影响生存的独立预后因素。丁重阳等[5]认为PET参数(脾脏及骨髓的18F-FDG摄取增高)是影响B淋巴瘤相关HPS预后的不良因素。也有研究[2,26]显示脾脏及骨髓的18F-FDG摄取越高,生存期越短,最佳截断值因病例不同各异。因此,PET/CT相关参数可以评估 HPS患者的疗效及预后,但相关研究的样本量较少,且多为回顾性研究,其准确性尚需大样本临床研究进一步证实。
总之,继发性HPS的病因多样,病程进展快,死亡率较高,早期诊断及治疗至关重要。PET/CT有助于HPS的诊断及原发病因的鉴别,18F-FDG摄取程度可以反映炎症及噬血程度,发现其他部位的合并症,同时指导活检部位,增加患者治疗的信心,PET相关参数可以在一定程度上提示预后,进行疗效监测。在进行图像判读时,应紧密结合患者的病史及用药情况,减少误判。本研究样本量较少,PET/CT在继发性噬血细胞中的应用价值还需更大样本、多中心及前瞻性研究进一步证实。

