抗CD52单克隆抗体HPLC-肽图分析方法的建立
乔玉玲 黄铮 秦海艳 宋兰兰 陈继军 安晨 叶星 毛晓燕
(1. 兰州生物制品研究所有限责任公司第四研究室 甘肃省疫苗工程技术研究中心,兰州 730046;2. 上海泰因生物技术有限公司,上海 201499)
人类CD52属于短链GH锚定糖蛋白家族,定位于人1号染色体(1p36.1)[1],它广泛分布于人淋巴细胞、单核细胞等造血细胞上,其直接的生物学功能至今尚未明确,但是多组实验室及临床数据显示对其进行人工干预及调控,可以治疗和预防多种与淋巴细胞有关的疾病[2-4]。目前,全球上市药品中,针对CD52抗原的主要是赛诺菲(Sano fi)旗下健赞(Genzyme)的单抗药物Lemtrada(Alemtuzumab)。2013年9月,欧盟委员会(EC)批准其用于活动性复发缓解型多发性硬化症(RRMS)成人患者的治疗。2014年11月FDA亦以相同的适应症批准其在美国上市[5-7]。
由兰州生物制品研究所有限责任公司研制的抗人-CD52单克隆抗体是一种特异性中和人CD52的重组人源化IgG1治疗性单克隆抗体。与小分子及化学药物相比,单克隆抗体类药物因为其生产的特殊性、自身结构的复杂性以及众多的翻译后糖基化修饰,需要对每批制品的抗体氨基酸序列进行鉴定。而抗体的互补决定区(Complementarity determining region,CDR)是每一个单克隆抗体所特有的氨基酸序列,也是抗体药物与抗原产生特异性亲和力的来源,所以,采用适当的方法对抗体的CDR区肽段进行鉴别是对抗体生产的一种有效质控方法。美国药典药物处方集、《中国药典》2015版三部中“人用重组DNA蛋白制品总论”及“人用重组单克隆抗体产品总论”中均要求在制品的理化特性分析中应尽可能地测定目标产品的氨基酸序列,并与基因推断的理论氨基酸序列进行比较[8-10]。HPLC-肽图法原理是基于蛋白质经盐酸胍变性、DTT打断二硫键、烷基化封闭、使用蛋白酶消化成小分子肽段的混合物,再经HPLC反向C18色谱柱分离后,应用质谱分析各个肽段的氨基酸序列。理论上每个不同蛋白消化后有不同的肽段,这些肽段的质量(分子量)就是这个蛋白的肽指纹图谱。
本论文探讨了在抗人-CD52单克隆抗体生产质控的过程中,使用胰蛋白酶在合适的条件下水解单抗,经HPLC反向C18色谱柱分离后,在液质联用鉴别CDR区特征峰的基础上,建立HPLC-肽图法。用该方法对抗人CD52单抗进行了肽图分析,并对该方法按照《中国药典》四部(2015年版)通则9101—药品质量标准分析方法验证指导原则进行了专属性、精密度、耐用性验证。
1 材料与方法
1.1 材料
重组抗人CD52单克隆抗体(兰州生物制品研究所有限责任公司第四研究室提供),三氟乙酸、乙腈、冰乙酸购自TEDIA公司;甲醇、二硫苏糖醇、尿素购自Sigma公司;盐酸胍购自Solarbio公司;十二水和磷酸氢二钠、二水和磷酸二氢钠购自国药试剂;碘乙酸钠购自BBI Lifescience公司;胰蛋白酶Trypsin购自Promega公司;10K超滤离心管、0.45 μm滤膜购自Millipore公司;Eclipse XDB-C18 4.6×250 mm 5 μm(Aglient)、进样瓶购自Agilent公司;液相色谱仪1260购自Agilent公司;Triple-TOF 5600+质谱仪购自AB Sciex公司。
1.2 方法
1.2.1 酶切样品制备 取300 μg重组抗人CD52单克隆抗体于6 mol/L盐酸胍变性缓冲液中,加入1 μmol/L DTT,56℃反应 30 min。 加 入 20 μmol/L IAM,37℃避光水浴反应1 h。使用10K超滤浓缩管脱盐置换至1.5 mol/L尿素缓冲液后,加入Trypsin 3μg,37℃水浴酶切18 h。酶切反应结束后加入20 μL 50%乙酸溶液终止反应。
1.2.2 反相-HPLC检测酶解产物 采用液相系统HPLC1260进行分离。A液为0.1%TFA水溶液,B液为0.1%TFA乙腈溶液。色谱柱以A液平衡,A、B液梯度变化分离酶解产物。供试品酶解产物由自动进样器上样,上样体积100 μL。紫外检测波长214nm,柱温30℃。
1.2.3 质谱条件 供试品酶解产物经高效液相色谱脱盐及分离后进入Triple-TOF 5600+质谱仪(AB Sciex)进行质谱检测分析。分析时长:135 min;检测方式:正离子;TOF MS+扫描范围:350-1 500 Da;Product Ion+扫描范围:100-1 500 Da;质谱分辨率:40 000;Exceeds:150 Cps。
1.2.4 数据分析 所得质谱原始数据 通过BioPharmaView V1.5(AB Sciex)进行软件分析,选择供试品理论序列为数据库,然后进行数据库匹配检索,分析参数如下:Enzyme,Trypsin;Fixed modification:Carbamidomethyl(C);Modification:Oxidation(M),Deamidated(NQ),Protein terminal lys-loss,Gln->pyoGlu;M/Z tolerance:±20 ppm。
1.2.5 验证 用样品处理专属性验证样品。辅料制剂溶液、样品溶液、贝伐珠单抗溶液按照1.2.1至1.2.2方法进行制备,0.1%TFA水溶液作为空白对照,各进样 100.0 μL。
精密度验证-仪器重复性样品。按照1.2.1至1.2.2方法对同一批号样品进行制备,连续重复进样6针,进样体积为100.0 μL。比较6次进样中目的峰片段的峰面积和保留时间,及其标准偏差(SD)和相对标准偏差%(RSD%)。
精密度验证-样品重复性样品。1.2.1至1.2.2方法对同一批号样品平行制备6份样品,每份进样量为100.0 μL。比较6份平行样品进样中目的峰片段的峰面积和保留时间,及其SD和RSD%。
精密度验证-中间精密度样品。由同一人员在不同实验日期对同一批号样品按照1.2.1至1.2.2方法进行处理,由不同实验员在同天对同一批号样品按照1.2.1至1.2.2方法处理。每针进样量为100.0 μL,集合3次试验数据,分别计算目的峰片段的保留时间和峰面积平均百分比,分别计算其SD和RSD%。
耐用性验证。考察柱温变化2、不同胰蛋白酶量(使用同一批次,酶量分别为1.5 μg、3 μg、6 μg)、不同酶切条件(35℃、37℃、39℃)、不同酶切时间(16 h、18 h、20 h),酶切之后不同保存温度不同保存时间(4℃1 d、2 d、3 d;-25℃1 d、2 d、3 d)。样品制备同1.2.1至1.1.2。分别计算原条件与各考察因素下的目的峰片段峰面积和保留时间的相对标准偏差。
2 结果
2.1 抗CD52单抗的CDR鉴别
抗CD52单抗为人源化IgG1单抗,由trypsin酶解单抗肽段得到的二级质谱数据经过MASCOT数据搜索引擎获得的氨基酸序列。其中轻链的覆盖率为96%,重链的覆盖率为 95%。将三批原液批号为DS201603001、DS201605002、DS201605003与 参 比品(批号RBP201508001)的肽图结果重叠后如图1所示。CDR特征肽段如表1所示。
参照2015版中国药典要求,结合质谱鉴定,确定在现有的前处理条件下该方法有较好的专属性,可以对重组人源化抗CD52单克隆抗体进行鉴定,并能够鉴定出CDR区的特征肽段。
从质谱结果推断出部分特征肽段的保留时间,结合上述图谱可以看出,连续生产的3批原液在Trypsin酶解后在液相图谱上表现一致,且与参比品一致。3批原液CDR区的保留时间偏差均≤0.2min。因为重链CDR1与轻链CDR1在HPLC色谱图上丰度较低,故选择重链CDR3及其他3个高丰度标志性峰作为监测点,其保留时间分别为:49.2±0.2,54.1±0.2,66.5±0.2。
2.2 HPLC-肽图检测方法验证结果
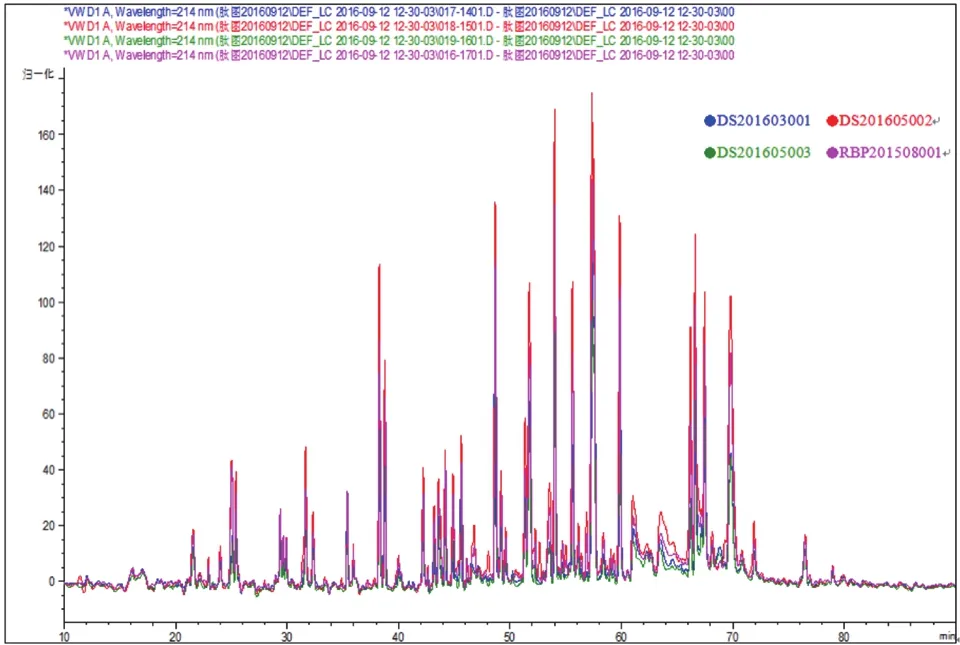
图1 CD52单抗提取离子流色谱

表1 CD52单抗CDR对应肽段及离子化信息
2.2.1 专属性结果 辅料制剂图谱(红色)与样品RBP201508001(紫色)用以评估辅料制剂是否对样品测定造成干扰,流动相A(深蓝色)与贝伐珠单抗(绿色)、纳武单抗(浅蓝色)进一步验证此方法的专属性。图2显示样品溶液在出峰位置均无干扰峰。
2.2.2 精密度验证结果 精密度-仪器重复性结果:连续6次进样的肽图数据(表2)显示,目的峰峰面积的RSD%为2.4%-5.5%。且保留时间的RSD%为0.1%-0.2%,小于5%的可接受标准。该结果表明仪器的重复性良好,偏差属于接受范围内。
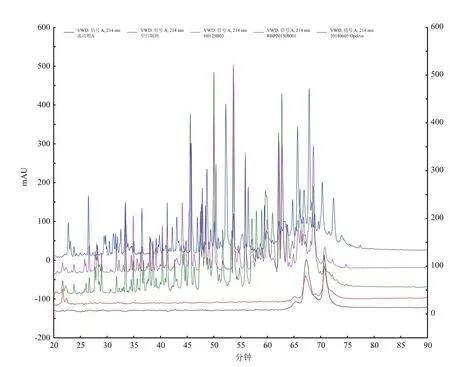
图2 专属性色谱图
精密度-样品重复性结果:6份平行样品的肽图结果(表3)显示,目标峰的峰面积RSD%在1.7%-3.8%之间。目标峰的保留时间RSD%在0.1%-0.2%,小于5%的可接受标准。
精密度-中间精密度结果:两分析人员3次实验所得数据(表4)显示,目的峰峰面积的RSD%在4.8%-7.6%之间。目的峰保留时间的RSD%在0%-0.2%之间,小于5%的可接受标准。由此中间精密度在可接受范围内。
2.2.3 耐用性验证结果 不同酶量(1.5 μg、3 μg、6μg)、不同酶切温度(35℃,37℃和39℃)和不同酶切时间(16 h,18 h,20 h)、酶切后4℃及-25℃分别保存24 h、48 h、72 h后考察目标峰保留时间RSD%均小于5%的可接受标准。所有考察条件下发现3 μg胰蛋白酶、37℃和18 h的酶切条件是最合适样品处理条件。72 h内,酶切后样品4℃及-25℃保存条件下,目标峰保留时间RSD%无明显差异。综上,各考察条件下目的峰的出峰时间与原条件相比,在±1 min范围内且对各目的峰保留时间影响较小,因此该方法耐用性良好。结果见表5至表9。
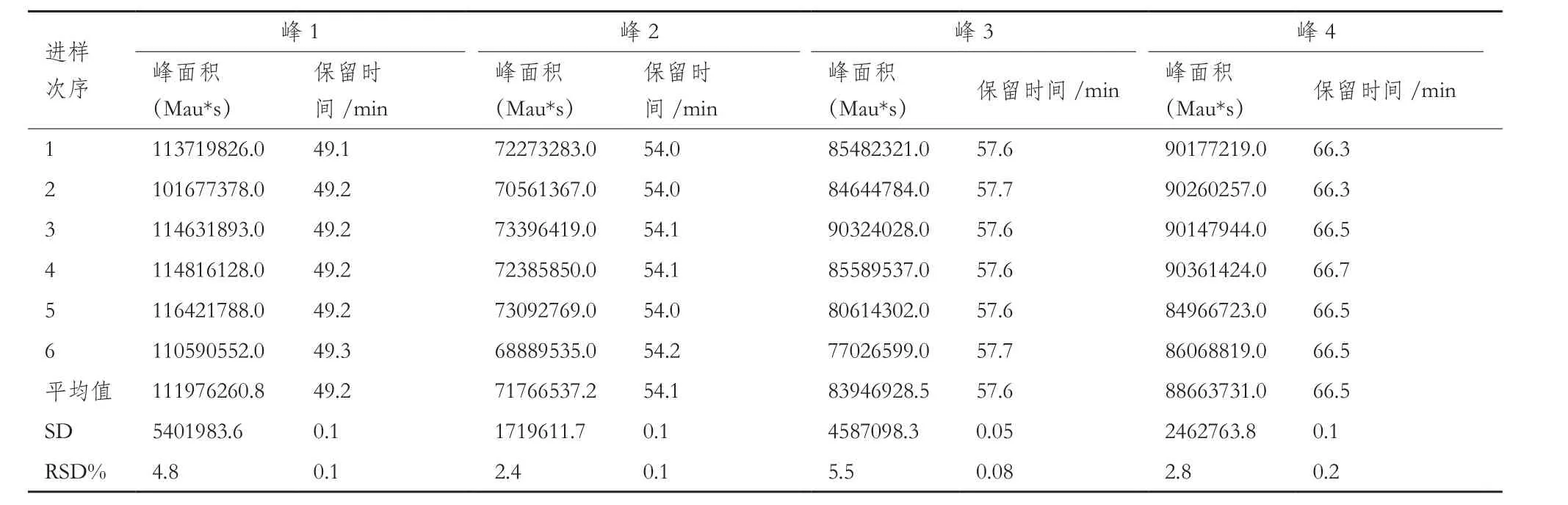
表2 仪器重复性结果
3 讨论
本研究旨在建立基于质谱检测结果的HPLC-肽图法,用于抗CD52单抗的鉴别实验。抗体经胰蛋白酶酶解后,使用HPLC反相C18色谱柱对样品进行分离后质谱检测,在方法建立过程中,我们分别使用 Eclipse XDB-C184.6×150 mm 5 μm、4.6×250 mm 5 μm(Aglient)色谱柱对样品进行分析,经比较发现,4.6×250 mm 5 μm色谱柱对本单抗制品分离效果更好,能有效的对CDR特征峰进行分离,效费比更高。
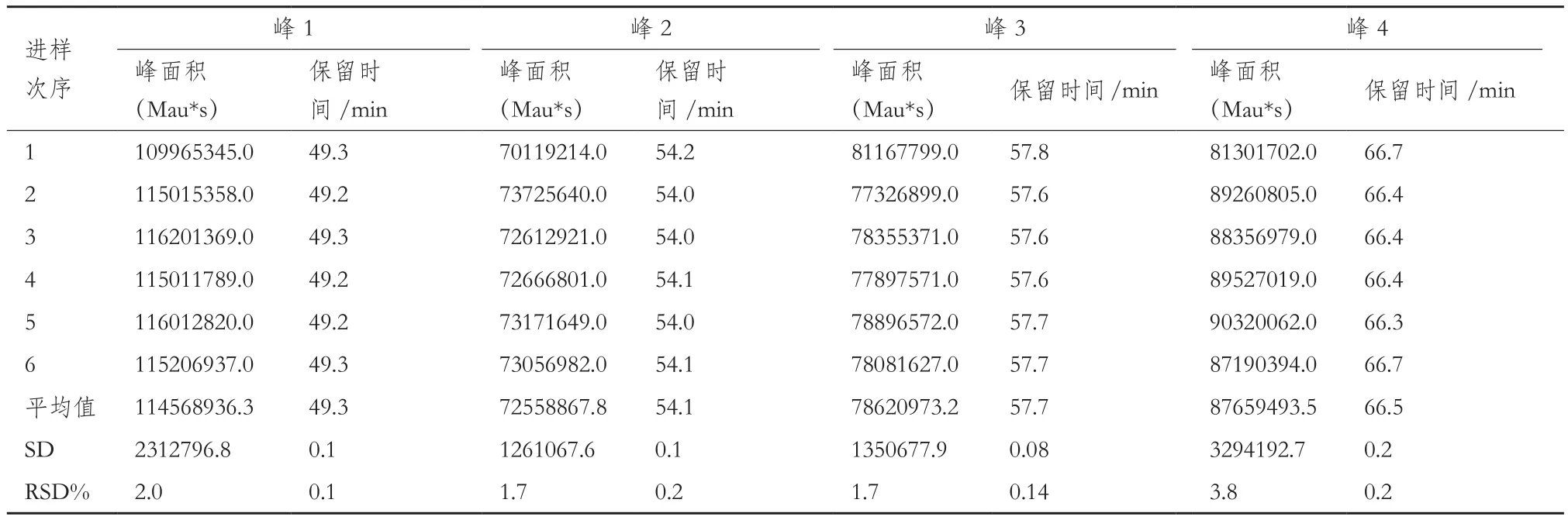
表3 样品重复性结果

表4 中间精密度结果
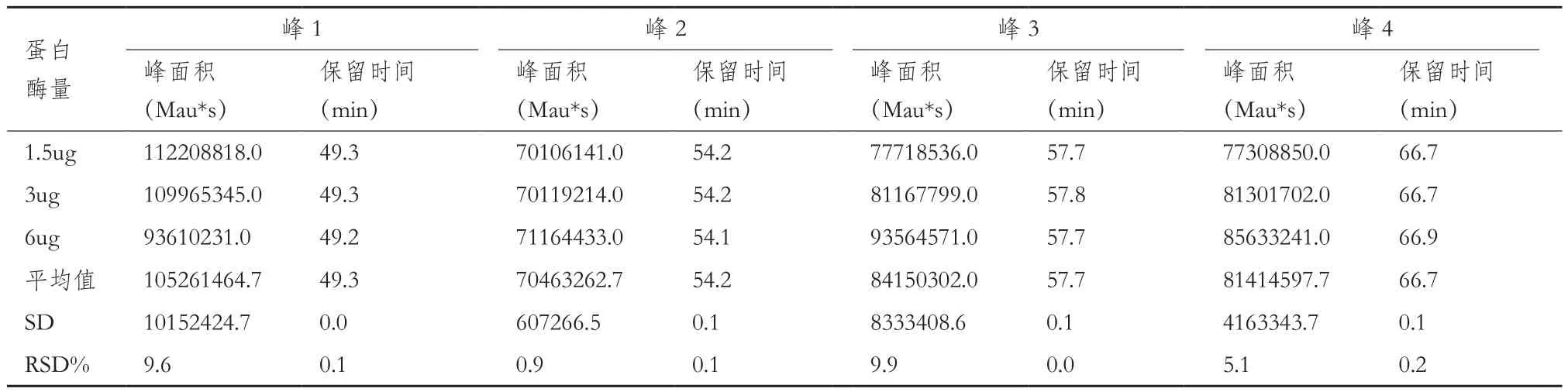
表5 不同胰蛋白酶量的测定结果
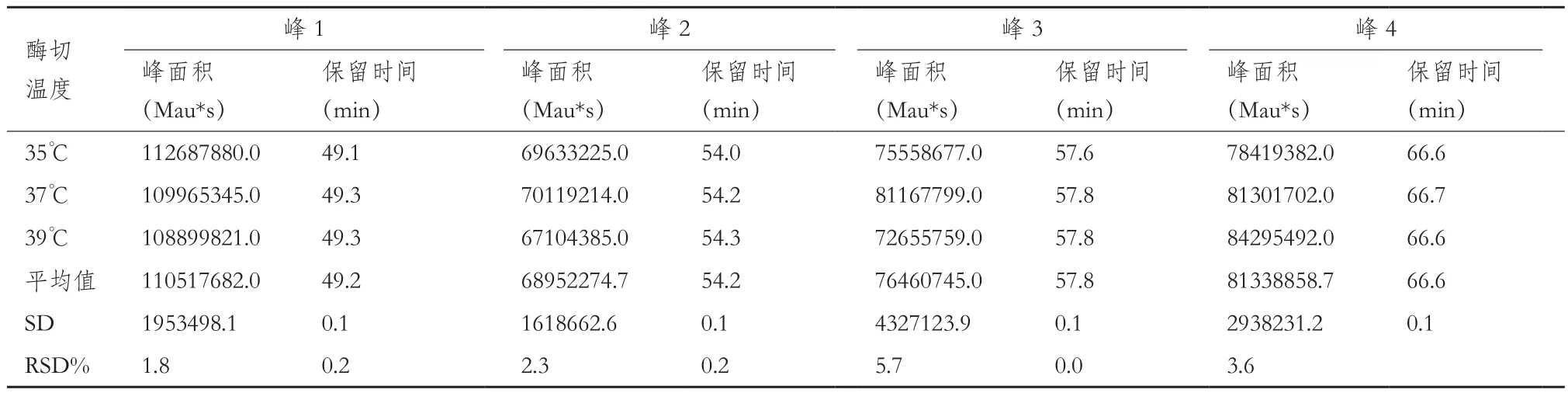
表6 不同酶切反应温度的测定结果
在前期的试验中,我们还对不同的内切酶进行了验证,分别选取了胰蛋白酶、糖苷酶、糜蛋白酶对抗CD52单抗进行酶切分析,结果显示胰蛋白酶对特征CDR区的酶切效果最好,得到了3个CDR区的特征峰,分别表征重链的CDR1、CDR3及轻链的CDR1。但是,仍不能对抗体全部的6个CDR区进行全覆盖。传统检测方法中使用液质联用的技术对抗体氨基酸序列进行分析,但是既耗时耗力且不利于抗体生产过程中的常规检测。所以我们选择在HPLC色谱中丰度较高的重链CDR3特征峰及其他3个高丰度且特异性良好的特征峰作为判断标准[11-13],建立了HPLC-肽图法。经验证该方法专属性好,辅料成分、异种抗体及样品处理中所用的试剂对检测结果均无干扰,且其色谱峰积分面积小于样品总峰面积的1%;精密度良好,保留时间的RSD%均小于5%;耐用性良好,各考察条件下目的峰保留时间RSD%均在5%的可接受范围内。
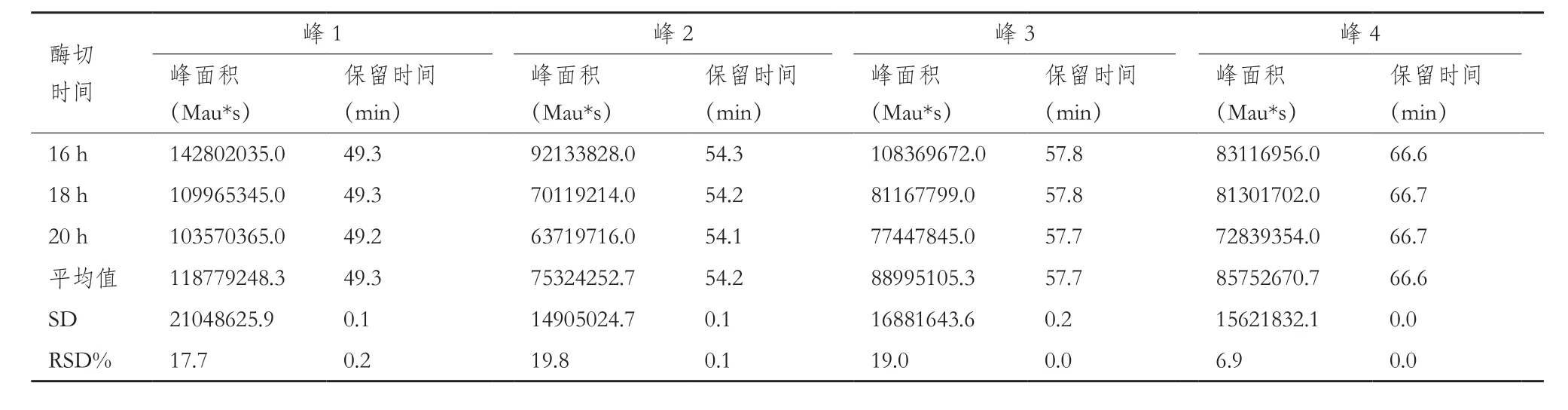
表7 不同酶切反应时间的测定结果
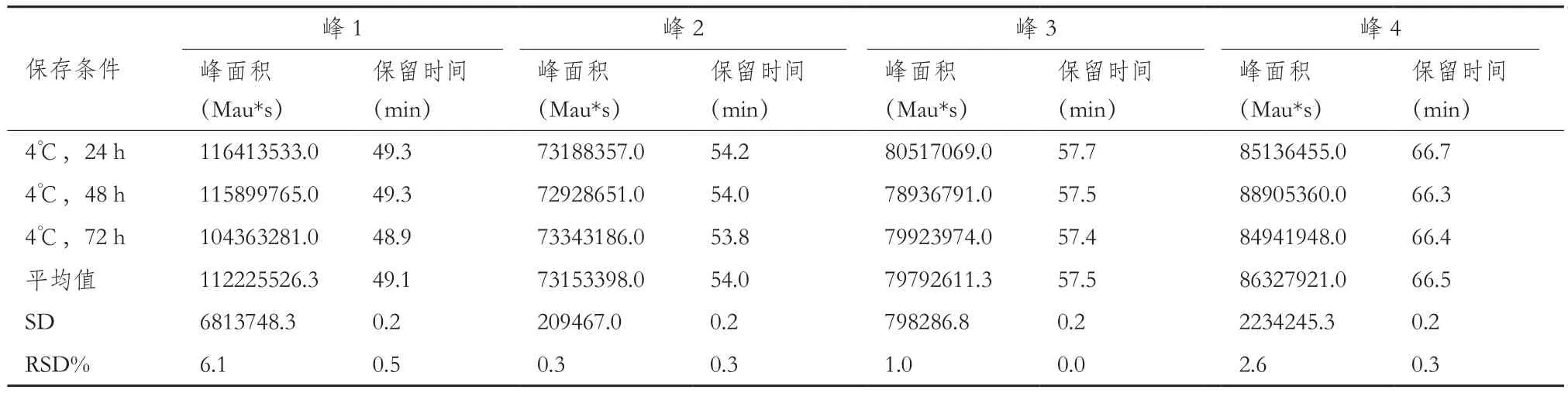
表8 酶切后4℃保存条件下的测定结果
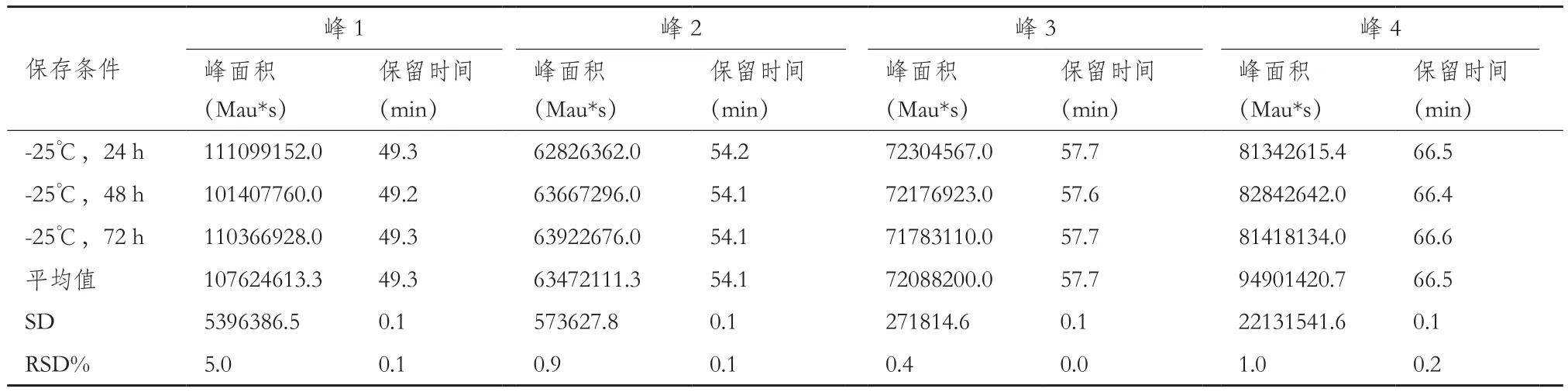
表9 酶切后-25℃保存条件下的测定结果
后期,我们将尝试使用上述3种内切酶混合的方式对抗体进行酶切处理,期望在HPLC-肽图的结果上所有6个CDR区的氨基酸序列与对应的特征峰覆盖率达到100%。
4 结论
本研究建立了HPLC-肽图法用于抗CD52单抗生产中的鉴别试验。该方法经验证具有良好的专属性、精密度及耐用性,酶解后样品能保证一定的稳定性,与传统的质谱法相比,此方法不需要解谱及繁琐的数据处理,仅需比对特征峰的保留时间及峰面积,简化了实验操作。可用于单抗的日常质量控制及批检验放行中。

