气道压力对气道重塑相关因子表达的影响及糖皮质激素的干预作用*
刘兰香,余 倩,吴晓娟,王 静,李敏超(重庆医科大学附属第二医院呼吸与危重症医学科,重庆400010)
慢性阻塞性肺病(COPD)是以持续气流受限为特征的常见呼吸系统疾病。气道重塑是导致气流受限的重要病理学改变,也是COPD患者病情无法缓解的原因之一,其发生涉及多种炎症因子,如:转化生长因子β1(TGF-β1)、白细胞介素⁃13(IL⁃13)、粒细胞⁃巨噬细胞集落刺激因子(GM⁃CSF)等[1]。既往动物研究已经证明,TGF-β1、IL⁃13,GM⁃CSF 等炎症因子的基因表达及调控均涉及 Ca2+的参与[2⁃4]。
瞬时感受器电位C(TRPC)通道,有7种亚型,即TRPC1~TRPC7[5],其中 TRPC1 在肺泡巨噬细胞、气道平滑肌细胞等均有表达,是一类可被机械压力激活的跨膜通道蛋白,其被激活后可导致胞内第二信使Ca2+浓度变化[6⁃8]。COPD患者由于气道重塑、支气管管腔内黏液增多、支气管平滑肌痉挛等多种因素,使小气道内存在持续异常增高的气道内压力。而小气道内高压环境可激活胞膜TRPC1通道进而诱导Ca2+入胞。气道重塑相关因子 TGF-β1、IL⁃13、GM⁃CSF 的表达与 Ca2+密切相关,而气道内压力可作用TRPC1通路,导致Ca2+内流。因此,临床推测上述细胞因子的表达与气道内压力密切相关。已有体外实验表明,糖皮质激素的使用可减轻气道炎性细胞浸润、气管管壁增厚,减少胶原沉积、血管生成,从而抑制气道重塑[9⁃10]。本研究依据有创机械通气时不同的平均气道压(Pmean)水平,将受试者分为不同压力水平组,观察不同水平压力作用后各组气道内分泌物(ETAs)的气道重塑相关因子表达水平,探讨气道内压力与气道重塑相关因子表达水平之间的关系,并明确糖皮质激素在此环节中所起的作用。

表1 2组一般资料比较
1 资料与方法
1.1 资料
1.1.1 一般资料 选取2016年6月至2017年8月本院呼吸与危重症医学科及重症监护室行有创机械通气大于或等于3 d的COPD患者30例(COPD组),按通气期间气道内或全身是否使用糖皮质激素治疗进一步分为激素治疗组(n=13)和非激素治疗组(n=17),同时选取无气道慢性炎症疾病患者13例作为对照组。纳入标准:(1)根据中华医学会2013诊断指南诊断为COPD的患者;(2)患者未合并肺部肿瘤、肺结核或免疫功能缺陷等,对照组未合并肺部感染,均未气道内及全身使用激素。COPD组和对照组年龄、性别、吸烟史等比较,差异均无统计学意义(P>0.05)。见表1。根据每小时护理记录中Pmean值得到3 d通气时间的Pmean平均值,进一步根据Pmean平均值将患者分为高压力组4例(>15 mm Hg,1 mm Hg=0.133 kPa),中压力组 4例(10~15 mm Hg)和低压力组 5例(<10 mm Hg)。所有患者及家属均被告知研究项目内容并签字同意参与本研究,研究经本院伦理委员会批准后执行。
1.1.2 主要试剂 TGF-β1、IL⁃13、GM⁃CSF 酶联免疫吸附测定法(ELISA)试剂盒购自上海安迪生物公司。
1.2 方法 患者完善术前相关检查后,在纤维支气管镜引导下经鼻或口行气管插管,并用封闭式吸痰管行气道内分泌物吸取,抽取痰液作为标本,在4℃条件下1000 r/min离心20 min,取上清液用于检测。所有受试者分别于机械通气24 h内及第3天行ETAs吸取,收集前后2次ETAs。采用ELISA检测ETAs上清液TGF-β1、IL⁃13、GM⁃CSF 水平,操作严格按试剂说明书步骤进行。
1.3 统计学处理 采用SPSS20.0软件进行数据分析,计量资料以表示,组间比较采用t检验,相关性分析采用Pearson直线相关法,P<0.05为差异有统计学意义。
2 结 果
2.1 压力刺激前后气道重塑因子表达水平比较 激素治疗组、非激素治疗组 24 h 内 TGF-β1、IL⁃13、GM⁃CSF水平均高于对照组,差异均有统计学意义(P<0.05)。高、中、低压力组间 24 h 内 TGF-β1、IL⁃13、GM⁃CSF 水平比较,差异均无统计学意义(P>0.05)。对照组第3天GM⁃CSF 水平及非激素治疗组第 3 天 TGF-β1、IL⁃13、GM⁃CSF水平显著高于24 h内,差异均有统计学意义(P<0.05)。在对照组中,低、高压力组第 3 天 TGF-β1 水平及中、高压力组第3天IL⁃13水平显著高于24 h内,差异均有统计学意义(P<0.05);高压力组第 3天 TGF-β1、IL⁃13、GM⁃CSF 水平显著高于中、低压力组,差异均有统计学意义(P<0.05)。激素治疗组第 3 天 TGF-β1、IL⁃13、GM⁃CSF水平显著低于24 h内,差异均有统计学意义(P<0.05)。在非激素治疗组中,中、高压力组GM⁃CSF水平变化幅度明显高于对照组,差异均有统计学意义(P<0.05)。见表 2、3。
2.2 相关性分析 非激素治疗组TGF-β1、IL⁃13、GM⁃CSF水平变化幅度与压力呈正相关(r=0.44、0.49、0.52,P<0.05)。
3 讨 论
COPD是呼吸系统中以持续气流受限为特征的疾病,其主要的病理特点为气道重塑。气道重塑主要指气道壁的结构变化,是慢性炎症反复刺激引起炎症细胞和结构细胞相互作用的结果。TGF-β1、IL⁃13、GM⁃CSF在此过程中起重要作用,其表达与胞内Ca2+内流密切相关[2⁃4]。TGF-β1 是一种多效应性细胞因子,可被气道上皮细胞、成纤维细胞、嗜酸性粒细胞和巨噬细胞合成,是公认的致气道重塑的炎症介质[11⁃12]。TGF-β1 主要涉及调节细胞的增殖和分化,参与组织损伤修复,此外还可刺激细胞外基质(ECM)的合成和沉积,使成纤维细胞增殖并发展为肌成纤维细胞,使平滑肌细胞表型可由收缩型向合成型转变;而ECM过度合成则使ECM及纤维产生增加,加重气道纤维化[13]。以上作用共同参与了气道重塑。IL⁃13主要由活化T细胞、肥大细胞、嗜碱粒细胞和单核细胞产生,其过度表达可使黏液腺化生,黏液分泌增多,加重大小气道管壁及周围炎性反应,通过气道壁结构重建等多种机制参与COPD的发生、发展[14]。GM⁃CSF在慢性支气管炎患者的上皮中表达[15],可直接损伤肺组织结构,同时促进炎症细胞,如中性粒细胞、巨噬细胞等炎症细胞的趋化、黏附、聚集、激活及脱颗粒作用。由于反复的慢性炎症的损伤及不全性的修复导致肺泡壁的持续破坏、纤维化及中小气道壁的进行性增厚、管腔进行性狭窄及弹性进行性减弱,最终导致进行性气流阻力增加,从而参与气道重塑[16⁃17]。COPD患者由于多种因素的相互作用,使小气道内的气道内压力持续异常增高。因此,持续异常的气道高压贯穿于慢性阻塞性肺疾病始终,与疾病的病情进展密切相关。TRPC家族包括7种亚型(TRPC1~TRPC7),TRPC可以被人体多种内分泌激素、炎症因子、钙池的衰竭和牵张刺激等激活[18],而TRPC1为主要的牵拉激活的钙通道,在细胞膜感受压力的过程中发挥重要作用,可介导胞外Ca2+入胞;而TGF-β1、GM⁃CSF、IL⁃13等炎症因子的表达与 Ca2+内流有关,故推测气道内压可促进气道重塑因子生成。本研究中,对照组予以机械通气治疗后第3天TGF-β1、IL⁃13、GM⁃CSF水平较24 h内水平呈现升高趋势。本研究团队前期研究也发现,健康人气道重塑相关因子在气道高压力水平干预下呈升高趋势[19]。由于TRP通道可能在气道保护机制中发挥重要作用,对健康人来说,压力刺激后激活TRPC1导致气道重塑因子生成系机体的保护性反应,因此推测机体可以通过一系列负反馈机制使气道微环境达到一个生理性的平衡,但具体机制尚有待进一步明确。本研究中,在非激素治疗组中3种因子的变化水平更为明显,可能与COPD患者在慢性炎性反应中TRPC1的表达显著增加有关。TRPC1的高水平表达使气道对压力的升高处于高敏状态,气道压一旦高于生理压力,气道重塑相关因子即呈爆发式释放,导致病理性结果。提示气道内高压可能通过改变气道重塑相关因子的表达,参与气道重塑。在对照组及非激素治疗组中,高压力组气道重塑相关因子的表达水平及升高幅度均较中、低气压组高,非激素治疗组TGF-β1、IL⁃13、GM⁃CSF水平变化幅度与压力呈正相关,因此推测随着气道内压力增高,可能使活化的TRPC1通道增多,Ca2+内流增加,从而介导 TGF-β1、GM⁃CSF、IL⁃13 水平表达升高。本实验间接证实COPD患者本身存在的气道内持续高压力可以上调气道重塑相关因子的合成,气道内高压力加重气道重塑,而气道重塑是形成慢性气道炎性疾病气道内高压原因之一,二者间形成恶性循环,导致疾病的发展及恶化。现已经证实糖皮质激素的使用能够逆转已建立的炎症和气道高反应性,并通过减少基质沉积和黏液产生来改善气道重塑[20]。本研究结果显示,激素治疗组在激素干预后,各个压力组中气道重塑相关因子表达水平均下降,差异均有统计学意义(P<0.05)。前期实验表明,糖皮质激素可在一定程度上通过下调TRPC1表达干预气道重塑演变[21]。
表2 压力刺激前后气道重塑因子表达水平(±s,pg/L)
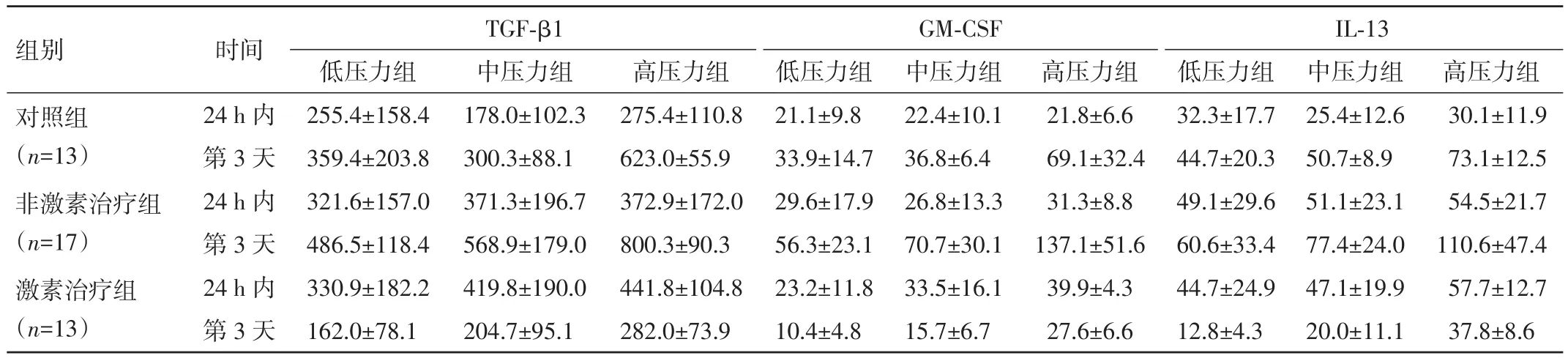
表2 压力刺激前后气道重塑因子表达水平(±s,pg/L)
组别对照组(n=13)非激素治疗组(n=17)激素治疗组(n=13)时间24 h内第3天24 h内第3天24 h内第3天TGF-β1 GM-CSF IL-13高压力组30.1±11.973.1±12.554.5±21.7110.6±47.457.7±12.737.8±8.6中压力组178.0±102.3300.3±88.1371.3±196.7568.9±179.0419.8±190.0204.7±95.1高压力组275.4±110.8623.0±55.9372.9±172.0800.3±90.3441.8±104.8282.0±73.9低压力组21.1±9.833.9±14.729.6±17.956.3±23.123.2±11.810.4±4.8中压力组22.4±10.136.8±6.426.8±13.370.7±30.133.5±16.115.7±6.7高压力组21.8±6.669.1±32.431.3±8.8137.1±51.639.9±4.327.6±6.6低压力组32.3±17.744.7±20.349.1±29.660.6±33.444.7±24.912.8±4.3中压力组25.4±12.650.7±8.951.1±23.177.4±24.047.1±19.920.0±11.1低压力组255.4±158.4359.4±203.8321.6±157.0486.5±118.4330.9±182.2162.0±78.1
表3 对照组及非激素治疗组压力刺激前后TGF-β1、GM-CSF、IL-13变化幅度(±s,pg/L)
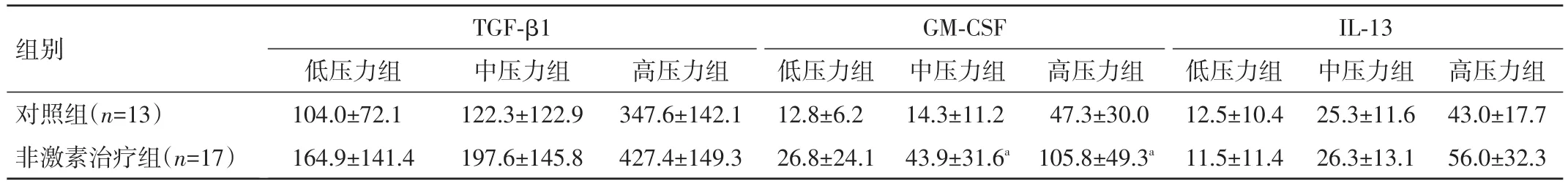
表3 对照组及非激素治疗组压力刺激前后TGF-β1、GM-CSF、IL-13变化幅度(±s,pg/L)
注:与对照组比较,aP<0.05
组别对照组(n=13)非激素治疗组(n=17)TGF-β1 GM-CSF IL-13高压力组43.0±17.756.0±32.3低压力组104.0±72.1164.9±141.4中压力组122.3±122.9197.6±145.8高压力组347.6±142.1427.4±149.3低压力组12.8±6.226.8±24.1中压力组14.3±11.243.9±31.6a高压力组47.3±30.0105.8±49.3a低压力组12.5±10.411.5±11.4中压力组25.3±11.626.3±13.1
综上所述,COPD患者持续的气道高压力环境会影响气道重塑相关因子的合成,参与气道重塑过程,且糖皮质激素降低了气道压力对气道重塑因子水平的影响,据此可进一步通过抑制或阻断信号通路来治疗及防止COPD发生和发展。

