杨梅素联合围脂滴蛋白对脂肪细胞脂解的影响*
张少华,王君实,董维鹏,燕炯
(山西医科大学公共卫生学院 营养与食品卫生学教研室,山西 太原 030001)
脂代谢紊乱和脂质合成分解障碍可致肥胖症的发生[1]。脂滴已被证实是一种在脂代谢中起重要作用的细胞器,主要成分是三酰甘油(triglyceride,TG)和胆固醇酯,脂滴表面有多种功能蛋白[2]。围脂滴蛋白(perilipin 1, PLIN1)作为PAT家族蛋白的一员,主要定位于脂滴表面,在脂肪分解代谢起屏障保护作用的一种可磷酸化蛋白[3-5]。短发卡RNA(small hairpin RNA, sh-RNA) 是 RNA干 扰(RNA interference, RNAi)技术的一种,可有效地降解同源序列的mRNA,进而抑制靶基因的表达[6]。本课题组前期已成功构建PLIN1基因的sh-RNA高效干扰载体,并已成功验证其可有效促进脂肪细胞的脂解作用[7]。
黄酮类化合物广泛存在于蔬菜水果中,具有强抗氧化性、抗肿瘤、调节血脂等生物学活性[8]。杨梅素(myricetin, Myric)作为黄酮类植物化学物中比较有代表性的的一种,可以通过降低PLIN1表达、磷酸化激素敏感性脂肪酶(hormone sensitive lipase, HSL),进而加速脂肪分解,降低TG和胆固醇[9-10]。
本研究拟通过Myric与PLIN1基因sh-RNA高效干扰载体联合干预,观察其对3T3-L1脂肪细胞脂解效率的影响,并探讨其可能机制,为今后肥胖症的防治提供新思路。
1 材料与方法
1.1 材料和试剂
3T3-L1前脂肪细胞系(小鼠胚胎成纤维细胞)由山西医科大学第一医院内分泌科惠赠,胎牛血清、DMEM/F12细胞培养基、胰蛋白酶溶液(100 ml)及青链霉素混合液(×100)购自武汉Boster生物工程有限公司,TG检测试剂盒(美国Amresco公司),甘油检测试剂盒(南京建成生物工程研究所),Myric(上海阿拉丁试剂有限公司),Lipofectamine ® LTX & Plus Reagent(美国Invitrogen公司),PLIN1A抗体、HSL抗体、ATGL抗体和β-Actin抗体购自英国Abcom公司。
1.2 仪器和设备
Eon型微孔板分光光度计(美国Bio-Tek公司),DM3000B型倒置荧光显微镜(德国Leica公司),JY92-Ⅱ型超声细胞粉碎仪(宁波新芝器械研究所),DYCZ-40D型电泳仪(北京六一仪器厂),Neofuge 23R型低温高速离心机(上海Heal Force公司)。
1.3 实验方法
1.3.1 细胞的复苏﹑培养及诱导分化 从液氮中取出3T3-L1前脂肪细胞,用含10%胎牛血清的DMEM/F12培养基培养,细胞长满时转移到6孔板中。
采用经典“鸡尾酒”方法对3T3-L1前脂肪细胞进行诱导分化为成熟的脂肪细胞[11]。在细胞融合到80%左右时,将完全培养基换成诱导分化培养基Ⅰ,2 d后换为诱导分化培养基Ⅱ继续培养2 d,随后更换为基础培养基,每2天换液1次,诱导分化为成熟脂肪细胞成功后进行后续操作。
1.3.2 Myric干预条件的筛选 在3T3-L1前脂肪细胞诱导分化为成熟脂肪细胞第8天后换成含Myric的培养基,分为6组:100、50、10、5、1及0 μmol/L,每组分别干预48和72 h,检测TG和甘油含量。
1.3.3 联合干预 诱导分化为成熟的脂肪细胞后,Myric联合sh-RNA重组干扰载体进行干预实验,共分4组:联合干预组(Myric+sh-RNA)、转染组(sh-RNA)、Myric组(Myric)和空白组。
根据本课题组前期优化后的细胞转染条件,以质量体积比为1∶2的方式将质粒与脂质体转染进脂肪细胞。转染5 h后,对联合组和Myric组换成含有Myric的完全培养基继续培养72 h;对转染组和空白组换成正常的完全培养基继续培养72 h。
1.3.4 脂肪细胞油红O染色 联合干预完成后,每孔加入1 ml 4%多聚甲醛溶液,室温下静置2 h。用移液管吸掉,加入油红O工作液(现配现用)。1 h后,去离子水冲洗2遍,镜下观察并拍照。
1.3.5 细胞中TG及甘油含量检测 Myric干预后,将细胞消化转移至1.5 ml EP管中,冰水浴条件下进行超声破碎,TG试剂盒检测,于酶标仪上546 nm波长处测定TG含量。甘油测定时需将细胞裂解液放于70℃水浴10 min,灭活脂肪酶,甘油试剂盒检测,于酶标仪550 nm处测定其吸光度,用蛋白浓度对测定值进行校正。
1.3.6 Western blot检测细胞中PLIN1A﹑HSL和ATGL蛋白表达 提取各组蛋白,测定并调平浓度。制备凝胶,每孔中加50 μg待测样品,样品两端的孔中加入5 μl Marker。80 V跑浓缩胶,120 V跑分离胶,220 mA恒定电流进行湿式转膜法转膜。转膜结束后,封闭2 h。用封闭液对一抗进行稀释,4℃过夜。二抗孵育时37℃摇床70 min。取出条带,加入ECL发光工作液,合上暗盒暗室曝光。Image J软件对目的蛋白条带进行分析并测定灰度值,以β-actin条带灰度值进行校正。
1.4 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Myric不同浓度、不同干预时间对TG含量的影响
不同浓度Myric干预48和72 h后的TG含量比较,差异有统计学意义(F=10.823和125.113,均P=0.000)。随着Myric干预浓度的提高,细胞内TG含量逐渐降低,干预浓度达到100 μmol/L时,细胞内TG含量为最小值。100 μmol/L时48和72 h比较,差异有统计学意义(P<0.05)。见表1。
表1 不同剂量的Myric及不同干预时间对TG含量的影响[mmol/(g·protein),±s]

表1 不同剂量的Myric及不同干预时间对TG含量的影响[mmol/(g·protein),±s]
注:1)与同时间其他浓度比较,P <0.05;2)与同浓度48 h比较,P <0.05
TG 48 h 72 h 0 μmol/L 0.1 730±0.0 099 0.1 867±0.0 034 1 μmol/L 0.1 712±0.0 110 0.1 857±0.0 046 5 μmol/L 0.1 607±0.0 033 0.1 623±0.0 058 10 μmol/L 0.1 580±0.0 041 0.1 555±0.0 033 50 μmol/L 0.1 470±0.0 060 0.1 406±0.0 017 100 μmol/L 0.1 393±0.0 0301) 0.1 259±0.0 0371)2)F值 10.823 125.113 P值 0.000 0.000组别
2.2 Myric不同剂量、不同干预时间对甘油含量的影响
不同浓度Myric干预48和72 h后的甘油含量比较,差异有统计学意义(F=107.296和99.920,均P=0.000)。Myric干预后,细胞中甘油含量随着干预浓度的提高而逐渐升高,尤其当干预浓度为100 μmol/L时,甘油含量最高。100 μmol/L Myric干预48与72 h比较,差异有统计学意义(P<0.05)。见表2。
2.3 Myric与sh-RNA联合作用对TG和甘油含量的影响
4组TG和甘油含量比较,差异有统计学意义(F=384.875和102.557,均P=0.000)。其中Myric+sh-RNA组细胞内TG含量最低,甘油含量最高(P<0.05);与空白组比较,sh-RNA组和Myric组细胞内TG含量下降,甘油含量上升(P<0.05)。见表3。
2.4 Myric与sh-RNA联合作用对脂滴形态及分布的影响
显微镜下观察:空白组脂滴密度极大,油红O染色颜色深,大脂滴数量多;sh-RNA和Myric组脂滴呈戒环样结构围绕细胞核,与空白组比较,脂滴密度相对减小,染色颜色变浅,大脂滴数量减少;联合干预组镜下脂滴数量进一步减少,颜色进一步变浅,无大脂滴存在。见图1。
表2 不同剂量Myric及不同干预时间对甘油含量的影响[mmol/(g·protein),±s]

表2 不同剂量Myric及不同干预时间对甘油含量的影响[mmol/(g·protein),±s]
注:1)与同时间其他浓度比较,P <0.05;2)与同浓度48 h比较,P <0.05
甘油48 h 72 h 0 μmol/L 0.0 374±0.0 041 0.0 414±0.0 084 1 μmol/L 0.0 376±0.0 069 0.0 438±0.0 058 5 μmol/L 0.0 419±0.0 061 0.0 498±0.0 069 10 μmol/L 0.0 548±0.0 067 0.0 837±0.0 0762)50 μmol/L 0.0 947±0.0 075 0.1 220±0.0 1112)100 μmol/L 0.1 326±0.0 0721) 0.1 737±0.0 1321)2)F值 107.296 99.920 P值 0.000 0.000组别
表3 Myric与sh-RNA联合干预对TG和甘油含量的影响[mmol/(g·protein),±s]

表3 Myric与sh-RNA联合干预对TG和甘油含量的影响[mmol/(g·protein),±s]
注:1)与空白组比较,P <0.05;2)与sh-RNA组比较,P <0.05;3)与 Myric组比较,P <0.05
组别 TG 甘油Myric+sh-RNA 0.0 873±0.0 0481)2) 0.2 194±0.0 1121)2)sh-RNA 0.1 471±0.0 0461)3) 0.1 190±0.0 0591)Myric 0.1 305±0.0 0361) 0.1 724±0.0 1011)空白组 0.1 885±0.0 016 0.0 431±0.0 051 F值 384.875 102.557 P值 0.000 0.000
2.5 Myric与sh-RNA联合作用对PLIN1A蛋白表达的影响
各组PLIN1A蛋白表达含量比较,差异有统计学意义(F=46.010,P=0.000)。Myric+sh-RNA 组PLIN1A蛋白表达含量较其他3组降低(P<0.05);与空白组比较,sh-RNA组与Myric组PLIN1A蛋白表达量下降(P<0.05)。见图2。
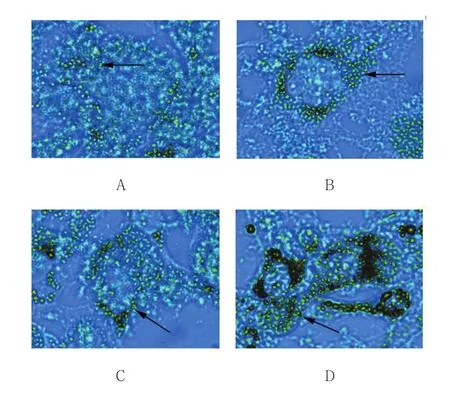
图1 脂滴油红O染色结果 (×400)
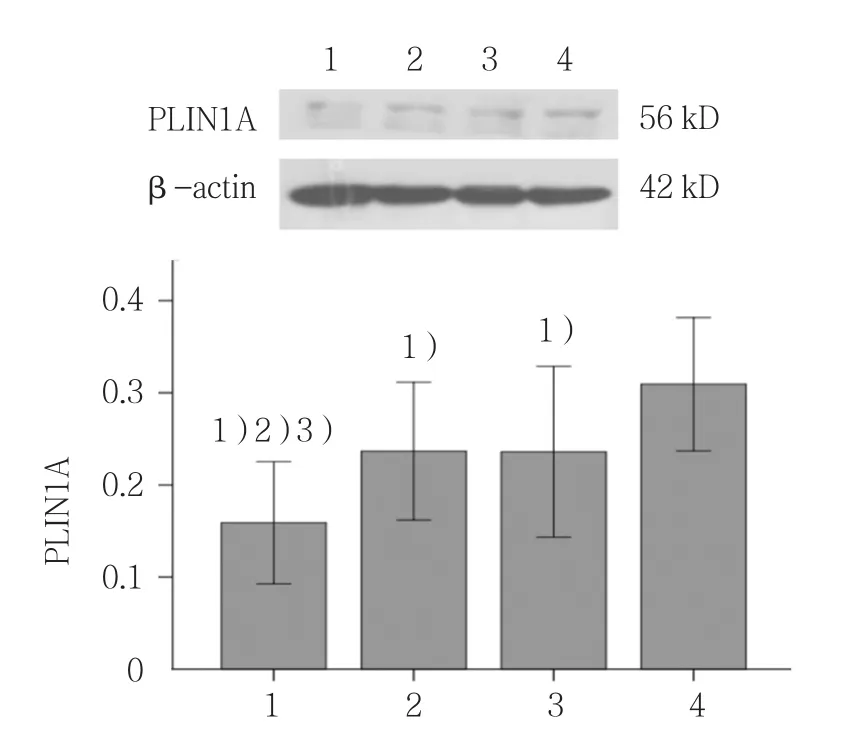
图2 Myric与sh-RNA联合作用对PLIN1A蛋白表达的影响
2.6 Myric与sh-RNA联合作用对脂解酶HSL和ATGL蛋白表达的影响
各组HSL和ATGL蛋白表达含量比较,差异有统计学意义(F=78.222和80.831,均P=0.000)。与其他3组比较,联合干预组HSL和ATGL蛋白表达量上升(P<0.05);与空白组比较,sh-RNA组与Myric组HSL和ATGL蛋白表达量升高(P<0.05)。见图3、4。
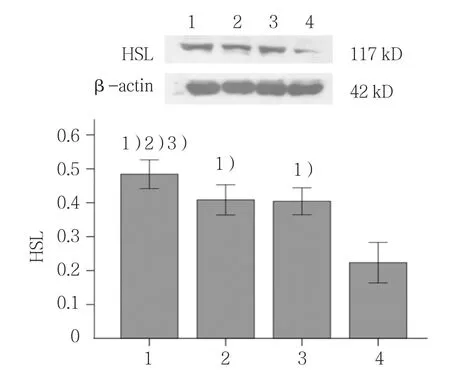
图3 Myric与sh-RNA联合作用对HSL蛋白表达的影响

图4 Myric与sh-RNA联合作用对ATGL蛋白表达的影响
3 讨论
3T3-L1前脂肪细胞是从小鼠分离出的具有特定分化潜能的细胞系,其本身不具有脂肪细胞的特性,但能被诱导分化为成熟的脂肪细胞,常被作为理想的脂代谢、细胞分化模型[12-13]。脂滴是TG在脂肪细胞中主要的储存形式。TG的分解代谢主要在ATGL和HSL的作用下进行[14-15]。
在脂肪细胞中,PLIN1蛋白锚定于脂滴表面产生支持屏障作用,将TG与脂肪水解酶隔断,保护其不被分解。研究发现,当下调PLIN1时,其屏障作用减弱,脂肪水解酶活性增强,脂解速率加快,脂滴变小,细胞内TG含量降低[16]。
Myric干预条件的筛选实验结果显示,随着Myric干预浓度的升高以及干预时间的延长,细胞内TG含量逐渐降低,甘油含量逐渐升高。通过细胞毒性实验发现当Myric干预浓度大于100 μmol/L,干预时间72 h时,细胞存活率低于80%;当干预浓度为100 μmol/L,干预时间超过72 h时,细胞存活率同样低于80%,均存在一定细胞毒性。因此,结合文献查阅结果,最终确定Myric最佳干预浓度和干预时间分别为100 μmol/L和72 h,这与QIAN WANG等[9]的研究结果相一致。
本研究结果显示,Myric+sh-RNA联合干预组较其他3组细胞内TG含量降低,甘油含量则升高,几乎观察不到大脂滴的存在,脂滴数量也减少。而联合干预组较单独干预组PLIN1A蛋白表达量更低,HSL和ATGL蛋白表达量更高。因此本实验认为,Myric与下调PLIN1基因联合作用比它们各自单独干预更能有效地促进脂肪分解,杨梅素和sh-PLIN1干扰载体引起的脂解加快可能是通过降低PLIN1A蛋白表达,上调脂肪酶HSL、ATGL的表达实现的。

