膀胱癌中巨噬细胞浸润与膀胱癌化疗耐药的研究
康川疆,周艳,姜睿
(1.西南医科大学附属医院 泌尿外科,四川 泸州 646000;2.四川省遂宁市第三人民医院 儿科,四川 遂宁 629000)
膀胱癌是泌尿系统常见肿瘤之一,因其发病率高、术后复发率高以及致死率高等特点导致膀胱癌治疗颇为困难[1]。膀胱癌微环境在肿瘤进展和治疗中发挥重要功能[2],肿瘤相关巨噬细胞(tumor associated macrophages, TAMs)是肿瘤微环境的重要组成部分,相对于癌旁组织,肿瘤组织中肿瘤相关巨噬细胞明显增加,被激活为M2型巨噬细胞后释放大量细胞因子,促进膀胱癌的进展[3]。
趋化因子生长调节基因5[chemokine(C-X-C motif)ligand 5, CXCL5]属于趋化因子CXC中ELR趋化因子的一员,最新研究发现CXCL5具有促进肿瘤增殖、血管形成、粒细胞趋化及促进炎症反应等功能[4-5],本研究旨在探究膀胱癌通过分泌CXCL5招募巨噬细胞以及巨噬细胞对膀胱癌化疗耐药性的影响,为膀胱癌治疗提供新的诊疗思路。
1 材料与方法
1.1 材料
人正常膀胱上皮细胞SV-HUC-1、人膀胱癌细胞系T24、253J及人急性单核细胞白血病细胞系THP-1细胞购自中国科学院昆明细胞库,DMEM培养基和RMPI-1640培养基购于美国Life Technologies公司,胎牛血清购于杭州四季青生物工程材料有限公司,佛波酯(phorbol 12-myristste 13-acetate, PMA)、IL-4购自美国Sigma-Aldrich公司,Transwell小室购自美国Coming公司,Fibronectin购自美国Life Technologies公司,RNA提取试剂盒购自上海飞捷生物技术有限公司,RNA反转试剂盒及PCR kit购自日本TaKaRa公司,CXCL5敲减shRNA慢病毒购自上海吉凯基因化学技术有限公司,CXCL5多克隆抗体购自美国Santa Cruz公司,PARP/cleaved-PARP购自美国Cell Signaling Technology (CST)公司。
1.2 细胞培养及shRNA慢病毒转染
膀胱癌细胞T24、253J使用含10%胎牛血清DMEM培养基培养,人正常膀胱上皮细胞SV-HUC-1和急性单核细胞白血病细胞系THP-1细胞使用含10%胎牛血清RMPI 1640培养基培养,培养基内加入100 μg/ml青霉素和链霉素(Sigma, USA),置于37℃、5%二氧化碳CO2培养箱,每2~3天对细胞换液处理,贴壁细胞每4~5天通过胰酶消化进行传代处理,THP-1细胞离心重悬进行传代处理。每次实验前使用160 nmol/L PMA细胞培养24 h,诱导THP-1细胞分化成巨噬细胞。shRNA慢病毒预实验感染确定T24细胞MOI值为5、253J细胞MOI值为10。调整细胞密度将T24、253J细胞接种于6孔板中,转染前用DMEM培养液清洗细胞,使用Complete Mdeium稀释polybrene至终浓度50 μg/ml,细胞加入5 μg/ml的polybrene和相应体积病毒转染T24、253J细胞48 h后,使用2~3 μg/ml嘌呤霉素进行细胞筛选2~3周,荧光显微镜下检测荧光蛋白表达,实时荧光定量PCR和Western blot检测CXCL5的mRNA和蛋白表达。
1.3 人正常膀胱上皮细胞和膀胱癌细胞条件培养基提取
人正常膀胱上皮细胞和膀胱癌细胞正常培养,胰酶消化离心后重悬,调整细胞数量为2.0×106个/皿接种于10 cm皿中,待细胞贴壁后更换无血清培养基,将10 cm皿置于37℃、5% CO2培养箱培养48 h,吸取细胞上清液离心去除细胞碎屑,吸取离心后上清液置入-20℃冰箱冷冻保存备用。
1.4 THP-1源性巨噬细胞条件培养基提取
THP-1细胞离心重悬,细胞计数并按2.0×106个/皿接种于10 cm皿中,PMA诱导培养24 h,更换新的培养基,再加入20 ng/ml的IL-4继续培养24 h,更换无血清培养基,置于37℃、5% CO2培养箱培养48 h,吸取细胞上清液离心去除细胞碎屑,吸取离心后上清液置入-20℃冰箱冷冻保存备用。
1.5 四甲基偶氮唑蓝(MTT)法检测膀胱癌细胞增殖能力变化
膀胱癌细胞正常培养,待细胞生长至70%~80%消化进行细胞计数,调整细胞密度为3.0×105个/ml,按照每孔200 μl接种于96孔板中,待细胞贴壁后实验组按照1∶1比例加入巨噬细胞条件培养基共培养36 h,加入浓度为2.0 μmol/L多柔比星,每种处理设置5个复孔,将96孔板置于37℃、5% CO2培养箱培养24 h,吸去上清液,每孔加入含有10% MTT的培养基培养4 h,吸去上清液加入150 μl DMSO/孔,置于微量振荡器匀速振荡10 min,对照组未加入巨噬细胞条件培养基。应用酶联免疫检测仪在490 nm处检测光密度(OD)值,做出细胞生长曲线。
1.6 THP-1细胞招募实验
取5μm Transwell小室,倒置放置于10 cm皿中,小室下室膜上滴加20 μl Fibronectin并均匀铺满,放置于37℃、5% CO2培养箱中4~6 h备用。THP-1正常培养,离心后使用无血清培养基重悬,细胞计数并调整细胞密度为2.5×105个/ml,取出已包被Fibronectin的小室取出置于24孔板中,小室下室加入1∶1稀释的无血清条件培养基,上室加入200 μl的THP-1细胞悬液,将24孔板置于37℃、5% CO2培养箱培养36 h,棉签擦拭小室上室细胞,使用4%多聚甲醛固定20 min,PBS清洗加入结晶紫染色20 min,再次使用PBS清洗小室并使用棉签擦拭上室残留细胞,显微镜随机选取5个视野拍照,实验重复3次。
1.7 实时荧光定量PCR检测相关mRNA表达
使用胰酶消化并传代细胞接种于6孔板中,待细胞密度至60%~70%时按照飞捷RNAfast 200试剂说明书操作提取RNA,cDNA模板通过RNA逆转录获得,逆转录体系参照TaKaRa Prime ScriptTMRT Master Mix试剂说明书。CXCL5的mRNA表达检测使用TaKaRa SYBR @ PrimixEx TaqTMⅡ反应体系,引物序列:正向5'-GACGGTGGAAACAAGGAAAA-3',反向5'-GCTTAAGCGGCAAACATAGG-3'。使用β-actin作为内参,正向5'-CATGTACGTTGCTATCCAGGC-3',反向5'-CTCCTTAATGTCACGCACGAT-3'。mRNA的表达水平采用2-△△Ct计算方法进行分析。T24和253J两种细胞系未加入CXCL5敲减shRNA慢病毒作为对照。
1.8 Western blot检测相关蛋白表达
使用胰酶消化并传代细胞接种于6孔板中,待细胞密度至60%~70%时加入细胞裂解液提取蛋白,使用BCA法测定所提取蛋白浓度。取30μg蛋白使用SDS-PAGE凝胶进行分离并转膜处理,PVDF膜使用5%脱脂牛奶常温封闭1 h,加入目的抗体CXCL5、PARP/cleaved-PARP、β-actin,放置在4℃冰箱摇床慢摇过夜孵育。使用TBST洗膜液洗膜10 min×3次,加入二抗孵育,并置于常温摇床1 h,TBST洗膜液洗膜10 min×3次,使用ECL显影液进行显影。目的蛋白表达量通过与内参蛋白β-actin标准化后得到相对比值。
1.9 统计学方法
数据分析采用SPSS 18.0统计软件,计量数据以均数±标准差(±s)表示,对计量资料组间比较采用多因素方差分析及LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 膀胱癌细胞与正常膀胱上皮细胞招募THP-1细胞
SV-HUC-1组招募THP-1细胞数(85.400±5.528),膀胱癌细胞T24和253J组招募THP-1细胞数分别为(288.200±6.028)和(348.600±8.583),与正常膀胱上皮细胞比较,差异有统计学意义(t=42.950和44.650,均P=0.000),显示膀胱癌细胞相对正常膀胱上皮细胞招募更多的THP-1细胞。
2.2 膀胱癌细胞与正常膀胱上皮细胞CXCL5表达水平
T24组与253J组膀胱癌细胞CXCL5的mRNA表达水平分别为(5.871±0.345)、(6.238±0.472),与正常膀胱上皮细胞(1.000±0.413)比较,差异有统计学意义(t=15.680和14.470,均P=0.000),CXCL5在膀胱癌细胞中表达升高。见图1。

图1 SV-HUC-1、253J、T24细胞CXCL5蛋白表达情况
2.3 膀胱癌细胞CXCL5敲减对THP-1细胞浸润的影响
敲减膀胱癌细胞CXCL5表达见图2。膀胱癌细胞系T24敲低组招募THP-1细胞数,与对照组比较,差异有统计学意义(P<0.05)。253J细胞敲低组招募THP-1细胞数,与对照组比较,差异有统计学意义(P<0.05),显示CXCL5敲减抑制膀胱癌细胞对THP-1细胞招募能力。见表1。
2.4 THP-1源性巨噬细胞对膀胱癌对多柔比星抵抗性的影响
膀胱癌细胞系T24共培养组细胞存活率,与对照组比较,差异有统计学意义(P<0.05)。253J共培养组细胞存活率,与对照组比较,差异有统计学意义(P<0.05),THP-1源性巨噬细胞共培养可以增强膀胱癌细胞对多柔比星的抵抗性。见表2。
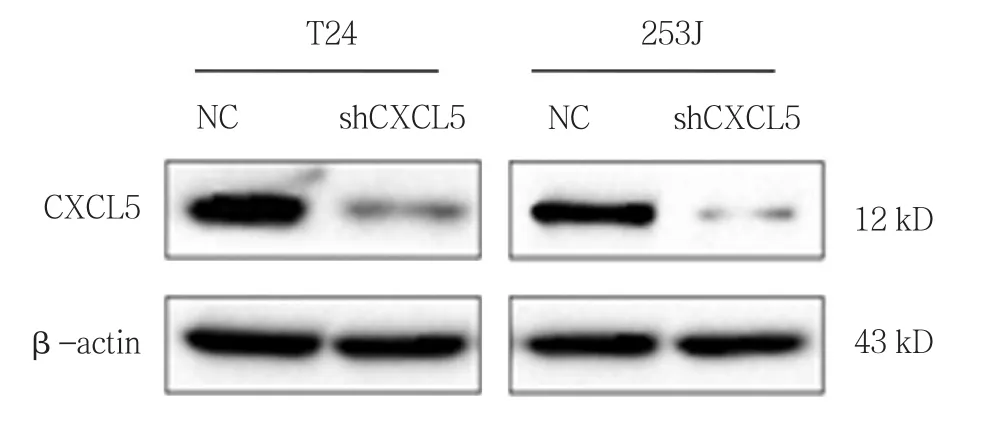
图2 T24、253J细胞CXCL5敲减后CXCL5蛋白水平
表1 膀胱癌细胞CXCL5敲减后招募巨噬细胞比较(±s)

表1 膀胱癌细胞CXCL5敲减后招募巨噬细胞比较(±s)
组别 招募细胞数 t值 P值T24细胞系对照组 87.200±2.588 10.390 0.000 CXCL5敲低组 33.400±8.583 253J细胞系对照组 65.600±3.209 19.160 0.000 CXCL5敲低组 24.200±1.924
表2 THP-1源性巨噬细胞影响膀胱癌对多柔比星的抵抗性 (±s)

表2 THP-1源性巨噬细胞影响膀胱癌对多柔比星的抵抗性 (±s)
组别 细胞存活率/% t值 P值T24细胞系对照组 100.000±9.424 3.450 0.008共培养组 118.953±7.872 253J细胞系对照组 100.000±6.236 2.750 0.030共培养组 109.534±4.616
3 讨论
肿瘤微环境是肿瘤发生、发展过程中重要机制,TAMs在肿瘤进展中发挥重要功能,既往报道发现TAMs在肾癌[6]、肝癌[7]、肺癌等[8]多种恶性肿瘤疾病中浸润增加,本研究发现在膀胱癌中,膀胱癌细胞招募TAMs能力高于正常膀胱上皮细胞,TAMs很可能在膀胱癌恶性进展中起到关键作用。
CXCL5是CXC族趋化因子成员[9],趋化因子主要作用是作为化学引诱物介导细胞特异性迁移,吸引相关炎症细胞的组织浸润。研究发现CXCL5在前列腺癌[10]、乳腺癌[11]、胰腺恶性肿瘤[12]和肾癌[13]中高表达,而有关CXCL5在膀胱癌中对TAMs招募作用尚未报道。本研究通过实验发现膀胱癌细胞CXCL5表达高于正常膀胱上皮细胞,且CXCL5敲减能抑制膀胱癌细胞对THP-1细胞招募能力,说明CXCL5在膀胱癌细胞对THP-1细胞招募过程中发挥重要功能。
TAMs促进肿瘤的生长、侵袭和转移,同时TAMs高浸润增强多种恶性肿瘤如乳腺癌或胃癌患者对化疗药物耐药及引起预后不良[14-16],因此笔者想要探讨肿瘤相关巨噬细胞对膀胱癌细胞化疗耐药产生的影响,发现共培养后加入多柔比星相对多柔比星对照组化疗药物对膀胱癌细胞杀伤作用明显下降,说明肿瘤相关巨噬细胞可以促进膀胱癌细胞对多柔比星的化疗耐药性。
综上所述,膀胱癌细胞通过分泌过多的CXCL5招募巨噬细胞,同时招募的肿瘤相关巨噬细胞能够反向性作用于膀胱癌细胞,增强膀胱癌的化疗耐药性,对膀胱癌的治疗提供了新的思路。

