质量效应及热历史对硝酸铵热分解特性的影响研究
曹雄, 张云, 曹卫国, 张玉龙, 戴鹏, 薛晨露, 谭迎新
(1.中北大学 环境与安全工程学院, 山西 太原 030051; 2. 中国电建集团铁路建设有限公司, 北京 100044)
0 引言
随着现代工业技术的不断发展,硝酸铵的使用范围越来越广泛,无论是作为农作物的化学肥料,还是在爆炸品行业都有广泛应用,促进了生产力的巨大发展。然而,作为危险化学品中的一类(根据《关于危险货物运输的建议书试验和标准手册》硝酸铵在不同条件下可能被划为5.1类或者1.1类危化品),硝酸铵在生产使用过程中会发生大量爆炸安全事故。如2015年天津港8·12爆炸事故[1],是由于硝化棉自燃导致附近堆放的硝酸铵等危险化学品爆炸,造成了大量人员伤亡和财产损失。硝酸铵在室温条件下是一种比较稳定的化学品,对摩擦、撞击等机械刺激都不敏感。但是随着硝酸铵所处环境温度、湿度的变化,硝酸铵经过一系列复杂的物理化学变化过程,会生成一些敏感的自由基,导致燃烧爆炸现象的发生。最严重的硝酸铵爆炸事故是1947年美国德克萨斯城港湾爆炸,此次爆炸事故造成570多人丧生。因此,国内外研究人员对硝酸铵的危险性进行了大量研究[2-9],例如Tan等[4,10]、谭柳等[5]通过绝热加速量热(ARC)、差示扫描量热(DSC)以及克南试验对硝酸铵及其掺杂物的热安全性进行了研究,发现氯化钾等惰性盐的加入可以提高硝酸铵的热稳定性,并从机理层面进行了详细描述。文献[11-12]通过自制的爆炸罐对硝酸铵及其复合肥的热稳定进行了研究,结果发现在有其他杂质如有机物存在的条件下,硝酸铵的热稳定性下降,起始分解温度降低。Wu等[13]通过ARC和改进的通风管实验对不同质量下的硝酸铵乳胶基质进行了实验研究,结果发现在大质量条件下,硝酸铵乳胶基质的热积累效应更加明显,爆炸危险性进一步增大。杨庭等[14]在国内首次提出了用热历史方法对危化品的热安全性进行研究,即在样品加热到一定程度后降温至室温,然后重复加热至完全分解来考察危险化学品的热危险性,结果发现部分危险化学品具有自催化效应,热历史的存在增加了危险化学品的不稳定性。Wang等[15]在此基础上对典型含能材料的热分解特性及热安全性进行了系统分析,得出了类似的结论。此外,文献[16-20]也对硝酸铵的稳定性进行了大量研究。现有的研究使人们对硝酸铵的危险性有了一定的认识,但对硝酸铵热分解特性的研究系统性还存在一定的不足,因此,本文拟通过不同质量以及热历史对硝酸铵热分解特性的影响进行系统研究,以期对现有的关于硝酸铵热分解特性的研究进行一定的补充。
1 实验材料与仪器
1.1 实验材料
实验材料:硝酸铵,纯度99%以上,水的质量分数为0.2%,3次灼烧后残渣质量分数均低于0.6%. 实验开始前过0.25 mm筛,取筛下物进行实验。
1.2 DSC实验
DSC仪[11]现已被广泛应用在不同化学品的分解特性及热安全性测试方面。DSC实验主要是通过样品的分解温度来对物质的稳定性进行研究,并通过测试数据对样品的热分解过程进行分析。在本文中,采用德国耐驰公司生产的DSC仪对硝酸铵的热分解特性进行小质量样品量方面的研究。实验开始前,将样品放到密闭的高压不锈钢坩埚中,坩埚耐压15 MPa,密闭体系能够避免实验过程中的质量损失。从室温开始采用一定的升温速率对样品进行升温,直至样品分解完全为止,在升温过程中采用氮气气氛进行测试,氮气流速为40 mL/min,由于含能材料在升温过程中有爆炸的可能,因此实验样品量控制在1 mg以下。
1.3 微热量热实验
由于DSC仪测试硝酸铵热分解过程时的样品量过低,外界影响因素较多,考虑到质量效应对硝酸铵热分解过程的影响,采用法国塞特拉姆公司生产的C600仪对硝酸铵的热分解特性进行中质量样品量方面的研究,即微热量热实验研究。微热量热实验的原理是根据热流方程,将温差换算成热量差来作为信号输出。C600仪采用3D传感器,由热电偶构成空间阵列传感器,可全方位环绕样品,3D传感器不仅在表观灵敏度方面具有数量级的优势,更可以在保证量热效率的前提下增大样品量。实验开始前,采用三氧化二铝作为参比物质,将样品和参比物质分别放到密闭不锈钢坩埚中,从室温开始采用一定的升温速率对样品进行升温,直至样品分解完全为止,同样由于含能材料在升温过程中有爆炸的可能,实验样品质量控制在1 g以下。微热量热实验温度范围为0~600 ℃,实验装置示意图如图1所示。
1.4 烤燃实验
烤燃(CO)实验在CO烘箱中进行,实验装置由箱体、加热器、样品区域、温度控制仪、热电偶、数据采集系统及其他附属部分组成,如图2所示。升温速率最低可以控制在3 ℃/h,实验过程中硝酸铵放在内径为32 mm的玻璃管中,并放置到烘箱中部的样品区域。最后设定升温程序,本文中的升温程序为线性升温,升温速率为1 ℃/min. 利用热电偶实时记录样品温度和烘箱温度的变化。由于本实验装置没有高精度的仪器,样品质量控制在150 g左右,将装置放置到抗爆房间进行实验,通过远程操作控制实验过程。
2 实验结果与讨论
2.1 质量效应对硝酸铵热分解特性的影响
图3~图5分别为硝酸铵在升温速率为1 ℃/min时DSC实验、微热量热实验和CO实验结果图,图中To为硝酸铵初始分解温度,Tp为硝酸铵最高分解温度。由图3和图4可以看出:在30 ℃至170 ℃之间,硝酸铵共有4个吸热峰,在40 ℃、90 ℃和130 ℃的3个吸热峰是由硝酸铵晶型变化所引起的,即硝酸铵由斜方晶系转变为单斜晶系(IV→III),再由单斜晶系转变成为三角晶系(III→II),最后由三角晶系转变为立方晶系(II→I);当温度升高至165 ℃时,硝酸铵开始熔化,形成熔融状态[21];图3和图4中硝酸铵的前4个吸热峰所处的温度是一致的,说明通过DSC实验和微热量热实验方法来测试硝酸铵热分解是准确可行的。图5是硝酸铵CO实验结果,由于整个实验药量大,实验仪器没有DSC实验和微热量热实验的仪器精密,不具有热流采集功能,因此在CO实验中未观测到硝酸铵的前4个吸热峰;当进一步升高温度时,硝酸铵开始分解,放出大量的热。从自由基变化的角度来讲,硝酸铵热分解过程中经历了链式反应,当温度升高一定程度后,硝酸铵热分解就离不开自由基反应,反应机理如化学反应方程式(1)式~(4)式所示。
(1)
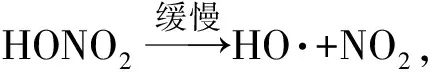
(2)
HO·+NH3→H2O+NH2,
(3)
NH2·+NO2·→NH2NO2→N2O+H2O.
(4)
在放热过程中,由于实验过程中受到样品量的影响,硝酸铵初始分解温度To和最高分解温度Tp会有所不同,根据图3~图5的实验结果,得出不同实验条件下的硝酸铵分解温度如表1所示。

表1 不同实验条件下的硝酸铵热分解特性实验结果
需要特别说明的是,在DSC实验和CO实验中,对硝酸铵初始分解温度的确定最常用的有两种方式:一种方式是取分解峰上升阶段斜率最大的切线与水平基线的交点;另一种方式是取分解峰刚偏离基线的温度点。本文硝酸铵初始分解温度按照第2种方式来进行采集,在CO实验中,硝酸铵分解温度是通过升温速率计算出来的烘箱理论温度来表述的,在实际分解过程中,样品本身温度会逐渐高于烘箱的理论温度,在分解放热过程中,样品温度会瞬间达到一个极大值(650 ℃)。
通过表1可以看出:硝酸铵DSC实验、微热量热实验和CO实验的样品质量之比约为1∶1 000∶150 000,随着硝酸铵质量的增大,热积累效应更加明显,导致硝酸铵的2个分解温度To分别为225 ℃、215 ℃和199 ℃,Tp分别为302 ℃、281 ℃和211 ℃,即温度均随着样品质量的增加而逐渐降低,而在现实生产及存储过程中,硝酸铵往往存放量较大,容易形成热积累,导致危险性进一步增大。
与现有的研究成果相比[22-24],本文研究样品质量对硝酸铵热分解温度的影响时,选择的是具有相同升温速率的实验,排除了升温速率对其分解温度的影响。除此之外,2.2节还研究了热历史对硝酸铵热分解温度的影响,通过质量效应和热历史两个角度对硝酸铵热分解特性进行系统分析。
2.2 热历史对硝酸铵热分解特性的影响
热历史实验的具体测试过程如下:1)对硝酸铵进行动态DSC实验和微热量热实验,动态过程的升温速率为1 ℃/min,得到第1条实验曲线(见图3和图4)。从这条实验曲线图中得到To和Tp等数据,实验过程记为1 ℃/min-1. 2)重新装样,进行第2轮实验,在升温速率相同和样品质量基本相同的条件下,升温至第1组实验中To和Tp之间的某一个回归温度Tb,然后停止升温过程,通过自然冷却的手段将样品降温至初始分解温度以下。3)将降温后的样品重新进行步骤1,得到第2条完整的实验曲线,实验过程记为1 ℃ /min-2,同时得到To和Tp等数据。4)实验条件允许情况下,选择不同的回归温度Tb,继续重复以上步骤,实验过程记为1 ℃/min-3和1 ℃/min-4等,对比经过不同的热历史对硝酸铵热分解特性的影响,具体如图6所示。热历史对硝酸铵热分析实验结果的影响如表2所示。
通过图6和表2可以看出,在DSC实验过程中,当Tb分别为270 ℃和260 ℃时,硝酸铵的To和Tp分别在223 ℃和287 ℃. 由于DSC实验的药量太小,看不出明显的变化,温度差异在实验误差允许范围内,但是对比图3未经过热历史的硝酸铵分解曲线可以看出,热历史对硝酸铵导致硝酸铵分解峰有向低温方向偏移的趋势。通过文献[15]可知,不同条件下得到的热历史曲线To和Tp均低于未经过热历史的实验曲线,且随着Tb的升高,热历史曲线得到的To和Tp进一步降低,则可以认定此种样品具有自催化效应。由于实验误差的存在,通过DSC热历史实验还不能完全确定硝酸铵热分解过程是否具有自催化反应特性。为了进一步说明在热历史的实验中,Tb选择对硝酸铵热分解特性的影响,微热量热实验中选取质量较大的硝酸铵样品对其进行多次热历史实验,实验结果如图7和表2所示。

实验升温速率样品质量Tb/℃To/℃Tp/℃1℃/min-10.98mg225302DSC1℃/min-21.00mg2702232871℃/min-30.99mg2602232881℃/min-10.99g215281微热量热1℃/min-20.98g2702092121℃/min-31.01g2602122151℃/min-40.97g250214217
通过图7和表2可以看出:在微热量热实验过程中,当Tb分别为250 ℃、260 ℃和270 ℃时,硝酸铵的To和Tp逐渐降低,且随着Tb的增大,分解峰向低温方向的偏移越严重;当Tb为270 ℃时,硝酸铵微热量热实验曲线的To和Tp分别为209 ℃和212 ℃,明显低于未经过热历史实验的硝酸铵温度,这意味着热历史降低了硝酸铵热分解的安全性,危险程度进一步增大。这与自催化反应机理一致,可以从化学反应的机理来解释[14-15]:在热历史实验过程中,硝酸铵部分分解生产了一定量的中间产物,降温后这些中间产物并没有消失,这些物质将对硝酸铵再次加热的热分解过程产生催化作用,根据中断回归法的判定依据,硝酸铵热分解反应可以归类为是自催化反应。
3 结论
1)在DSC实验、微热量热实验和CO实验中,样品用量逐渐加大,硝酸铵质量之比约为1∶1 000∶150 000,在升温速率为1 ℃/min条件下,硝酸铵的To和Tp分别从225 ℃和302 ℃降低至199 ℃和211 ℃,随着硝酸铵质量的增大,反应过程的热积累效应增大,导致分解温度逐渐降低。
2)经过热历史实验后,硝酸铵的To和Tp逐渐降低,且随着Tb增大,分解峰向低温方向的偏移越严重,这意味着热历史降低了硝酸铵热分解的安全性,危险程度进一步增大。
3)在热历史实验过程中,硝酸铵分解产生了一定量的中间产物,这些中间产物将对硝酸铵的热分解产生催化作用,导致硝酸铵分解温度降低。在实际生产及存储过程中,硝酸铵往往存放量较大,应避免出现过热情况,防止其产生热历史,进一步降低硝酸铵燃爆的可能性。

