基于iTRAQ技术分析五倍子作用白念珠菌后的差异蛋白表达
张晓龙, 李立平, 鲁仁义, 阎 澜*, 姜远英*
1.中国人民解放军海军军医大学药学院新药研究中心, 上海 200433;2.同济大学医学院, 上海 200092
中药五倍子(Galla Chinensis)是由五倍子蚜虫寄生在漆树科盐肤木属(Rhus)植物上形成的虫瘿,具有敛肺降火、涩肠止泻、敛汗止血、收湿敛疮等功效。五倍子具有多种生物活性,包括收敛、抗菌、杀精子、抗肿瘤等作用,尤其在抗菌领域具有良好的应用前景[1]。研究表明,五倍子不仅对大肠埃希菌、金黄色葡萄球菌、链球菌、绿脓杆菌等细菌具有明显的抑制或杀灭作用,对新生隐球菌、白念珠菌等真菌也有较强的抑制能力[2]。本课题组前期研究结果(数据未发表)表明,五倍子醇提物对白念珠菌的最小抑菌浓度(minimum inhibitory concentration,MIC)可达4 μg/mL,即五倍子具有较强的体外抗真菌活性,但其抗真菌的靶蛋白及作用机制并不明确,阻碍了对其抗真菌作用的深入研究。
蛋白质组学的出现为药物作用靶点的探索与研究提供了一个良好的平台,研究人员可以通过对整体蛋白质的大规模分析找出表达和功能发生改变的蛋白质,从而挖掘药物发挥作用的关键分子。iTRAQ是一种体外同种同位素标记的相对与绝对定量技术[3]。该技术可同时比较多达8种样品之间的蛋白表达量差异,具有高通量、高灵敏度、分离能力强、结果可靠等特点,在天然产物抗菌、抗肿瘤分子机制等方面的研究中得到广泛应用[4]。因此,本研究采用基于iTRAQ的蛋白质组学技术研究经五倍子处理的白念珠菌的差异表达蛋白,并利用生物信息学工具对差异蛋白进行细胞组件、分子功能和生物过程以及参与的信号通路的分析,以期探明五倍子抗白念珠菌可能的靶蛋白及分子机制。
1 材料与方法
1.1 材料与试剂
白念珠菌标准菌株(SC5314)由美国华盛顿乔治敦大学William A. Fonzi教授馈赠。
中药五倍子购自上海雷允上大药店;EDTA、DTT、PMSF、leupeptin、pepstatin、antipain等购于美国Sigma公司;BCA蛋白浓度测定试剂盒、SDS电泳液、考马斯亮蓝染色液均购于上海碧云天生物技术有限公司;PAGE凝胶制备试剂盒购于上海雅酶生物科技有限公司;iTRAQ试剂盒购于美国AB SCIEX公司。
1.2 培养基
YPD固体培养基:葡萄糖20 g、蛋白胨20 g、酵母浸膏10 g,混匀溶于900 mL三蒸水中,再加入琼脂18 g,定容至1 000 mL,121℃高压蒸汽灭菌20 min,于超净台倒入平皿,凝固后置于4℃保存备用。YPD液体培养基不加琼脂,其他成分同YPD固体培养基,灭菌后备用。
1.3 仪器与设备
DL-1000B智能超声波清洗器(上海之信仪器有限公司);HZ-2111K-B型恒温培养箱(太仓实验设备厂);Precellys 24 Dual生物样品均质器(法国Bertin公司);TripleTOFTM5600质谱仪、Eksigentnano LC-UltraTMsystem(美国AB SCIEX公司)。
1.4 实验方法
1.4.1中药提取 参考吴晶等[5]的方法。将50 g五倍子研磨成粉末,过20目筛,置于1 L圆底磨口烧瓶中,加入250 mL 75%乙醇,于50℃水浴中浸泡24 h,然后室温下超声30 min,过滤,所得滤渣重复上述操作,合并2次滤液。将滤液于50℃水浴中减压浓缩至干重得提取物,称重后用75%乙醇定容为200 mg/mL的生药提取液,于4℃保存。
1.4.2菌株培养与总蛋白提取 先将冻存的白念珠菌SC5314菌液接种至YPD固体培养基,30℃培养48 h进行活化,再将活化的白念珠菌SC5314单克隆接种在1 mL YPD液体培养基中,并加入五倍子提取液使其终浓度为4 μg/mL(对照组加入等体积的75%乙醇),于30℃、200 r/min振荡培养约16 h。将菌液于室温5 000 r/min离心3min,收集菌体并用灭菌PBS溶液洗涤3次,然后分别收集五倍子组和对照组的菌体各40 mg,置于冰浴中,利用生物样品均质器彻底研磨,于4℃、13 000 r/min高速离心10 min,取上清液即为白念珠菌总蛋白溶液,BCA法测定蛋白质浓度,于-80℃保存。
1.4.3SDS-PAGE电泳 取五倍子组和对照组的白念珠菌总蛋白溶液20 μL置于冰板上,加入4 μL 5×上样缓冲液,95℃水浴10 min使蛋白质变性。随后进行SDS-PAGE电泳(80 V、30 min;120 V、1 h),考马斯亮蓝染色。
1.4.4蛋白质酶解和iTRAQ试剂标记 分别取含100 μg白念珠菌总蛋白的五倍子组和对照组蛋白溶液各2份,按照iTRAQ试剂盒说明书操作,每份加入4 μL TCEP溶液,60℃孵育1 h,然后加入2 μL MMTS溶液,室温避光孵育20 min。随后将蛋白溶液转移至超滤管,13 000 r/min离心20 min,向超滤管中加入100 μL洗脱缓冲液洗涤,重复洗涤3次。然后加入50 μL胰蛋白酶,37℃孵育过夜。次日13 000 r/min离心20 min后向超滤管中加入50 μL洗脱缓冲液,再次离心20 min,所得即为肽段溶液。分别用113号、114号标签标记五倍子组蛋白酶解产物,用115号、116号标签标记对照组蛋白酶解产物,室温反应2 h,将标记好的肽段混合在一起,真空冷冻离心干燥备用。
1.4.5液相分级——高pH反相分级 将干燥的混合样品用100 μL流动相A(20 mmol/L甲酸胺,pH 10)复溶,然后对样品进行梯度洗脱。色谱柱为:流动相A:20 mmol/L甲酸铵,pH 10;流动相B:20% 20 mmol/L甲酸胺,80% 乙腈,pH 10。梯度条件为:0~5 min,5% B;5~30 min,5%升至15% B;30~45 min,15%升至38% B;45~46 min,38%升至90% B;46~54.5 min,90% B;54.5~55 min,90%降至5% B;55~65 min,5% B;流速为0.8 mL/min。从第5分钟开始,收集每分钟的流分(真空冷冻离心干燥),采集相应的色谱图,并依据各流分色谱图复杂程度进行组合,再用50 μL 2%乙腈、0.1%甲酸复溶各组分,混合后合并为10个组分。
1.4.6Nano LC-ESI-MS/MS分析 使用AB SCIEX TripleTOFTM5600质谱仪和Eksigentnano LC-UltraTMsystem进行分析。Trap柱:ChromXP C18(350 μm×0.5 mm,3 μm,120A),流速3 μL/min,上样时间15 min;分析柱:C18反相色谱柱(0.075×150 mm,3 μm,120A)。流动相A:0.1%甲酸;流动相B:98% 乙腈、2%超纯水、0.1%甲酸,流速为300 nL/min。洗脱梯度:0~0.1 min,5%升至10% B;0.1~60 min,10%升至28% B;60~75 min,28%升至50% B;75~75.5 min,50%升至80% B;75.5~80 min,80% B;80~80.5 min,80%降至5% B;80.5~90 min,5% B。主要参数:ESI正离子模式,MS1采集范围350~1250 m/z,扫描时间0.25 s。选择性的采集m/z范围内强度>40且带电荷数+2~+5母粒子进行打碎,二级质谱采集范围100~1 500 m/z。按上述LC-MS条件分别对10个组分进行数据采集,每个组分重复走2针。
1.4.7蛋白质定性及定量分析 使用ProteinPilot 4.5软件(AB SCIEX)进行蛋白质的定性鉴别及定量分析,该软件主要使用Paragon算法(4.5.0.0.1654)作为搜索引擎。将蛋白质数据库导入软件中,使用ProGroup算法对蛋白质进行定性鉴别,使用Paragon算法对蛋白质进行定量分析。搜索的参数设置为:MS/MS容忍度为0.1 Da;Sample Type:iTRAQ 8plex;Cys. Alkylation:MMTS;Digestion:Trypsin;Instrument:TripleTOFTM5600 system;I Special Factors:None; Species:Mus;ID Focus:Biological modifica-tions;Search Effort:Thorough;FDR Analysis:Yes;User Modified Parameter Files:No。在错误发现率(false discovery rate,FDR)<1%的基础上,将鉴别到至少含有2条唯一的肽段,且置信度>99%的蛋白质视为可信蛋白。
1.4.8差异蛋白及生物信息学分析 在获取iTRAQ实验蛋白定性及定量数据后,进行差异蛋白分析。差异蛋白选取标准为:①unused值>2;②统计检验P<0.05;③蛋白丰度差异倍数>1.3或<0.77。获取4个标记的全部差异表达蛋白后,对五倍子醇提取物处理前后白念珠菌SC5314的差异蛋白进行统计,得到差异蛋白谱。使用DAVID(https://david.ncifcrf.gov/)生物信息学分析工具对所得差异蛋白进行基于GO(gene ontology)的细胞组件、分子功能和生物过程富集分析,同时,对差异蛋白进行KEGG生物学通路富集分析。
1.5 统计学分析
本研究实验数据以平均数±标准差表示,组间比较采用t检验,以P<0. 05为有统计学意义。
2 结果与分析
2.1 白念珠菌总蛋白的提取及质控
为了提高实验的准确性,首先要高质量的提取蛋白质。本研究分别定量提取了五倍子组和对照组40 mg白念珠菌菌体的总蛋白,并以蛋白浓度稳定、SDS-PAGE电泳蛋白条带清晰且均匀为质控标准,确保用于iTRAQ实验的蛋白质符合要求。BCA法测得五倍子处理组总蛋白浓度为10.46 mg/mL,对照组总蛋白浓度为10.23 mg/mL。SDS-PAGE电泳如图1所示,2组蛋白条带清晰、均匀,无明显差异。表明2组样品蛋白提取差异较小,定量一致。
2.2 总蛋白的质谱定量分析和鉴定
本研究采用ProteinPilot 4.5软件和白念珠菌蛋白数据库进行蛋白质的定性鉴别及定量分析,2组样品iTRAQ实验共检出3 721种蛋白质。根据蛋白丰度差异倍数>1.3或<0.77、特异性肽段≥2、P<0.05的标准,鉴定得到差异表达蛋白104种,其中表达上调蛋白57种,表达下调蛋白47种,差异蛋白详细信息见表1。
图1 白念珠菌总蛋白SDS-PAGEFig.1 SDS-PAGE of total protein extracted from Candida albicans.M:蛋白分子量标准;1:对照组;2:五倍子处理组。
2.3 差异蛋白的GO富集分析
GO(gene ontology)是一个国际标准化的基因本体功能分类体系工具,用来全面描述生物体中基因和蛋白质的属性。GO共有3个大类,分别描述构成的细胞组件(cell component,CC)、基因或蛋白质的分子功能(molecular function,MF)以及参与的生物过程(biological processes,BP)[6]。
从GO富集分析结果中筛选出具有显著性富集的条目,结果如图2所示。104种差异蛋白所在的细胞组件主要位于菌丝细胞壁(10种)、细胞表面(12种)、酵母态细胞壁(8种)、质膜(15种)和细胞质(17种)等。差异蛋白参与的分子功能主 要与结合功能有关,包括吡哆醛磷酸结合(8种)、金属离子结合(16种)、4铁4硫团簇结合(5种)、血红素结合(6种)和NAD结合(5种)等。参与的生物学过程主要包括三羧酸循环(6种)、过氧化氢分解代谢(5种)、蛋氨酸生物合成(4种)、磷酸戊糖途径(4种)、糖异生(6种)和细胞氧化还原稳态(5种)等。
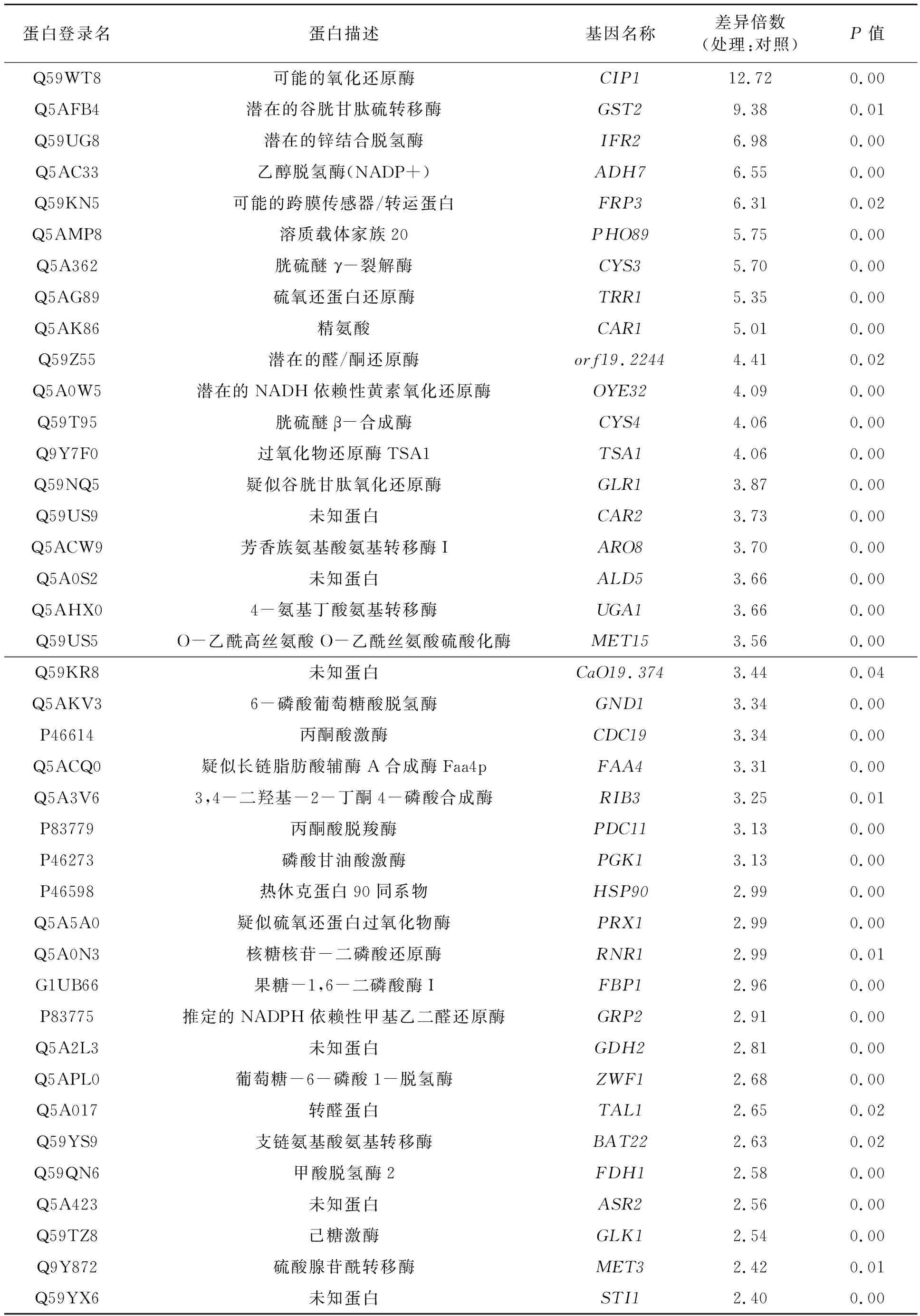
表1 五倍子组与对照组差异表达蛋白Table 1 Differentially expressed proteins between Galla Chinensis treatment group and control group.

图2 五倍子组与对照组差异蛋白GO富集分析Fig.2 Gene ontology analysis of differentially expressed proteins between Galla Chinensis group and control group.A:细胞组件;B:分子功能;C:生物过程
在细胞组件这一大类中,绝大多数差异蛋白参与到不同形态(酵母态和菌丝态)菌细胞的表面或膜构成组件中,可见,菌体在五倍子作用下,其细胞表面或膜成分可能受到影响或被破坏,如MET6、PET9、ATP5和NUC2等蛋白质为细胞表面毒力因子或膜组成部分,其表达量显著下降,会影响细胞表面或膜结构,以及菌与环境或宿主的相互作用。在分子功能中,差异蛋白主要集中于对各种离子或分子的结合能力,如对金属离子、铁硫簇、NAD及血红素等的结合,其次是酶活性能力,如氧化还原酶活性。富集于各种结合能力的33种蛋白质中,有19种的表达均显著下降;富集于NAD(P)H的氧化还原酶活性的差异蛋白也是显著下调的。这说明在五倍子作用下,菌体内的氧化还原酶以及分子或离子结合蛋白的活性发生了显著变化。在生物过程中,代谢过程、氧化反应和能量生成中有较多差异蛋白富集,显示五倍子确实改变了菌细胞代谢和能量产生过程。此外,以MET6为代表的部分差异蛋白参与白念珠菌与宿主的相互作用和宿主防御反应的共生诱导过程,这进一步说明五倍子已经影响到了白念珠菌与宿主的关系。
2.4 差异蛋白的生物学通路富集分析
KEGG(Kyoto encyclopedia of genes and genome)是一个用于查询代谢通路、酶促通路、酶或编码酶的基因以及生物化学物质的在线数据库,其整合了基因组、化学和系统功能等信息[7]。KEGG通路数据库包含了相应生物通路中分子相互作用网络以及具体某个生物所特有的变化形式,从而确定蛋白质参与的最主要的信号转导通路和生化代谢通路。在生物体内,不同蛋白质相互协调、相互调控表现为生物学行为,基于通路的分析更有助于了解基因或蛋白质的生物学功能[8]。
将五倍子作用白念珠菌后差异表达的104种蛋白质进行KEGG通路分析,结果表明,这些蛋白质富集于18条KEGG通路,主要包括代谢途径、生物合成抗生素、次生代谢物的生物合成、碳代谢和氨基酸的生物合成等。如图3所示,在这些差异蛋白富集的通路中,最集中的是不同物质的代谢通路,如碳、丙酮酸、硒代化合物及各种氨基酸等,其次为一些物质的合成路径,如次生代谢物、抗生素和糖等。值得注意的是,富集于氧化磷酸化途径的14个差异蛋白的表达量均显著下调。其中9个蛋白质呈现极显著差异(P<0.01),由此可知菌体的氧化磷酸化途径由于五倍子的作用而受到明显抑制,而其他一系列生物过程,如能量代谢、物质生成及各种离子或分子结合过程等也发生显著变化,进而造成菌细胞结构和功能的变化。

图3 五倍子组与对照组差异蛋白KEGG通路分析Fig.3 KEGG pathway analysis of differentially expressed proteins between Galla Chinensis group and control group.
3 讨论
近年来,深部真菌感染的发病率和死亡率日益增加,临床上常用的抗真菌药物面临着种类少、耐药性强、副作用多的窘境[9, 10]。中药是中华民族的瑰宝,具有历史悠久、毒副作用小、不易产生耐药性等优点,挖掘中药宝库一直是相关领域的研究热点。
本研究采用了基于iTRAQ的定量蛋白质组学技术,研究中药五倍子醇提物处理白念珠菌后差异蛋白质组学的变化。在体外培养条件下,共鉴定到104种差异表达蛋白。其中,上调比例最显著的为CIP1蛋白,五倍子处理后其表达量为对照组的12.72倍。CIP1是可能的氧化还原酶,有研究表明其在白念珠菌建立对镉处理产生的应激反应中起关键作用[11],且CIP1还可通过抗性途径参与白念珠菌氧化应激反应[12]。
此外,通过对差异蛋白的GO富集分析发现大部分蛋白质参与到生物过程中的氧化还原反应、过氧化氢分解代谢及能量代谢过程,在分子功能中也参与氧化还原活性。KEGG信号通路富集分析发现的18条相关通路主要集中在代谢通路和氧化还原通路,且氧化磷酸化途径相关蛋白表达均下调。
近几年关于五倍子研究的文献报道,主要集中于其防龋、消炎、抗菌和抗病毒等方面的作用[2,13~15]。付雪艳等[16]在考察不同产地(云南、浙江、陕西、河北、湖南)的五倍子的体外抗菌作用时,发现不同产地的五倍子,其作用也不同,如云南产五倍子醇提物对一些病原细菌(如大肠杆菌、绿脓杆菌及金黄色葡萄球菌等)的抑菌作用最强,而浙江、陕西产的五倍子醇提物则对白念球菌的抑菌作用强。代敏等[15]则进一步探讨研究了五倍子醇提物不同有效部位的体外抗细菌、真菌的活性,并发现五倍子的乙酸乙酯部位具有较强的抗细菌、真菌的活性。最新研究表明,五倍子还具有潜在的抗肿瘤作用[17]。
国内对于五倍子的研究主要局限于其各种提取物(如水、醇和乙酸乙酯等)的抗病原微生物活性作用,而其具体分子机制的研究鲜有报道。本研究首次采用组学方法(iTRAQ蛋白质组学技术)结合质谱技术(LC-MS/MS)鉴定了五倍子提取液作用下白念珠菌的差异表达蛋白,并利用生物信息学方法对差异蛋白的定位、分子功能及参与的生物学过程进行了系统分析,以期从分子水平阐述五倍子发挥抗白念珠菌活性的作用机理。本研究结果显示,五倍子可能通过抑制白念珠菌的氧化磷酸化,影响菌的能量代谢和物质生成,从而造成细胞结构与功能改变,起到发挥抗白念珠菌作用,但其具体分子靶点和作用机制仍需进一步深入探索和验证。

