铅胁迫下金发草和狗牙根耐受性的对比
于 飞,马海天才,钟沃秀,陈舒雨,谢程程,李 西
(1.四川农业大学风景园林学院,四川 成都 611130; 2.成都农业科技职业学院,四川 成都 611130)
随着我国工业化和城市化进程的加快,重金属污染问题日益严重,部分重金属致使土壤污染,严重破坏生态系统的正常功能。铅(Pb)是重金属污染中最广泛的污染源之一,Pb进入土壤后通过食物链进入人体,对人类健康造成极大影响并能够影响儿童的智力发育。传统的铅污染治理方法见效快,但治理成本高且会造成二次污染,很难从根本上解决问题。植物修复技术具有成本低、易实施、对环境破坏小、无二次污染、大面积推广等优势,并具有经济和景观价值,因此具有广阔的应用前景[1-4]。其中草本植物更具有生长速度快、生物量大、再生能力强和易于种植等特点,可以迅速覆盖和绿化受到污染的区域,因此筛选Pb耐受性强的草本植物对受到铅污染区域的生态恢复具有重要的生态价值[5]。
本研究所选的植物材料金发草(Pogonatherumpaniceum)是禾本科黍亚科金发草属的一种草本植物,主要生长于山坡、草地、溪旁,在我国西南地区多生于岩石缝隙中,根系发达,耐干旱瘠薄。繁殖能力强,植株呈金黄色,秋冬季变红,具有较高的观赏价值,国外称为“微型竹”,可用于庭院栽培[6]。狗牙根(Cynodondactylon),禾本科狗牙根属,暖季型草坪草中应用最广泛、研究最深入的草种。植株低矮、繁殖力强、抗旱、耐践踏、色泽好,是优良的固土护坡草种[7-8]。
金发草和狗牙根都具有适应性强、耐瘠薄等优点,是应用于道路、边坡绿化的优良植物材料。目前对金发草和狗牙根主要在水分、温度、践踏胁迫和盐胁迫等方面[9-16]成果颇丰,对重金属胁迫的研究相对较少,尤其是金发草的重金属胁迫方面的研究鲜有报道。本研究旨在通过研究不同浓度Pb污染土壤对金发草和狗牙根生长及生理特性的影响,分析比较两种草的Pb耐受能力,筛选出Pb耐受性强的草本植物,为城市的植物生态修复提供一定的理论依据。
1 材料与方法
1.1 试验材料与处理
金发草幼苗和狗牙根幼苗于2016年7月分别采集于绵阳市安州区罗浮山茶坪河和成都市温江区公平镇科锦路,栽植于四川农业大学成都校区园林植物实验基地。Pb胁迫试验试剂为分析纯试剂Pb(NO3)2。
2016年7月将幼苗种于圆形塑料花盆中(内直径24 cm,高20 cm),每盆选取45株长势一致的幼苗,栽培基质为混合土(园土与营养土的质量为2∶1),用800倍多菌灵消毒,人工除去杂草,每盆土称重5 kg。混合土pH 6.58,有机质含量39.17 g·kg-1,碱解氮含量58 mg·kg-1,有效磷含量53 mg·kg-1,速效钾含量122 mg·kg-1,全铅含量45.32 mg·kg-1。待幼苗正常生长2个月后,进行Pb胁迫试验。
盆栽控制试验土壤Pb处理浓度分为6个浓度梯度(CK、P1、P2、P3、P4和P5),分别对应Pb2+浓度为0、250、500、1 000、2 000和4 000 mg·kg-1,每个浓度处理3个重复。铅以Pb2+水溶液形式加入,分3次均匀地浇灌在盆土中,每两次间隔时间为2 d,渗出液反复回收浇灌,直到Pb2+与土壤均匀混合,对照组浇入等量的超纯水。并且用NH4NO3溶液平衡对照与各处理的氮素营养,同样将渗到托盘中的溶液倒回盆中。分别于10、20、30、40和50 d上午9:00取植物叶片进行各项生理指标测定,并在处理50 d后,测定两种草地上部和根系样品的重金属Pb含量。
1.2 测定指标与方法
1.2.1生物量测定 处理50 d后,拍照记录植株形态,对花盆中所有植株分为地上部和根系两部分进行生物量的测定。地上部采用刈割法,取地上部材料和所有根系后,均用超纯水冲洗3遍,在烘箱内105 ℃下杀青30 min,然后80 ℃恒温烘干至恒重,并用电子天平称量[14]。
1.2.2生理指标测定 叶绿素含量测定采用95%无水乙醇浸提法;质膜透性测定采用相对电导率法(REC);丙二醛(MDA)和可溶性糖含量测定采用硫代巴比妥酸显色法;可溶性蛋白含量测定采用考马斯亮蓝法;超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)法;过氧化物酶(POD)活性测定采用愈创木酚法;过氧化氢酶(CAT)活性测定采用紫外分光光度计法[17-20]。叶片光合指标参数使用美国产便携式光合仪Li-6400XT测定,仪器设定光合有效辐射1 000 μmol·(m2·s)-1,空气流速300 μmol·s-1,大气CO2浓度400 μmol·mol-1,叶室温度25 ℃,相对湿度为60%。重金属Pb含量测定是将两种草地上部和根系样品粉碎,采用混合酸(硝酸∶高氯酸=5∶1)消解,过滤定容后采用上海精密科学仪器有限公司产AA320N原子吸收分光光度计测定地上部分及根系的Pb含量。
1.3 数据处理
采用Microsoft Office Excel 2007进行各个指标的试验数据记录,SPSS 22.0软件进行单因素方差分析(One-way ANOVA),用平均值和标准差表示测定结果,新复极差法(Duncan’s)对数据进行多重比较,各指标显著性水平设定为α=0.05。采用Origin 8.0软件制作图表。
2 结果与分析
2.1 Pb胁迫对金发草和狗牙根叶片生长形态的影响
观察植物形态发现,不同Pb处理下两种草的生长情况有明显的差异。Pb处理对金发草叶片的形态有较大影响,随着Pb浓度的增加,叶片的外观发生了显著变化,颜色逐渐变浅,发黄枯萎(图1)。当Pb2+浓度≤1 000 mg·kg-1时,叶片呈现正常的深绿色;Pb2+浓度为1 000~2 000 mg·kg-1时,叶片颜色逐渐变浅,呈绿色,叶尖和叶基开始泛黄,出现萎缩卷曲;Pb2+浓度为2 000~4 000 mg·kg-1时,叶片泛黄、卷曲枯萎严重,出现明显的受铅毒害特征。观察狗牙根的叶片形态特征,Pb处理对叶片外形无显著影响,但是叶片颜色逐渐变浅(图1)。当Pb2+浓度≤1 000 mg·kg-1时,叶片颜色几乎无显著变化,均呈现正常的深绿色;Pb2+浓度在1 000~4 000 mg·kg-1时,叶片颜色逐渐失绿、泛黄,叶片出现卷曲,从叶基部开始逐渐失绿,但是并未出现严重的叶片伤害特征。
2.2 Pb胁迫对金发草和狗牙根生物量的影响
随着Pb胁迫浓度的升高,两种植物的根系干重和地上部干重均在逐渐下降(表1)。金发草根系干重比对照分别下降34.37%、46.31%、54.66%、67.57%和82.52%,狗牙根根系干重比对照分别下降20.61%、36.35%、55.34%、60.69%和70.99%,二者比较金发草的根系干重较狗牙根下降幅度更大。金发草Pb2+胁迫浓度为500和1 000 mg·kg-1时根系干重差异不显著(P>0.05),所有处理浓度下根系生物量较对照均显著下降(P<0.05)。狗牙根分别在Pb2+浓度为1 000和2 000 mg·kg-1时根系干重差异不显著(P>0.05),所有处理浓度下根系生物量同对照相比,均呈显著下降趋势(P<0.05)。
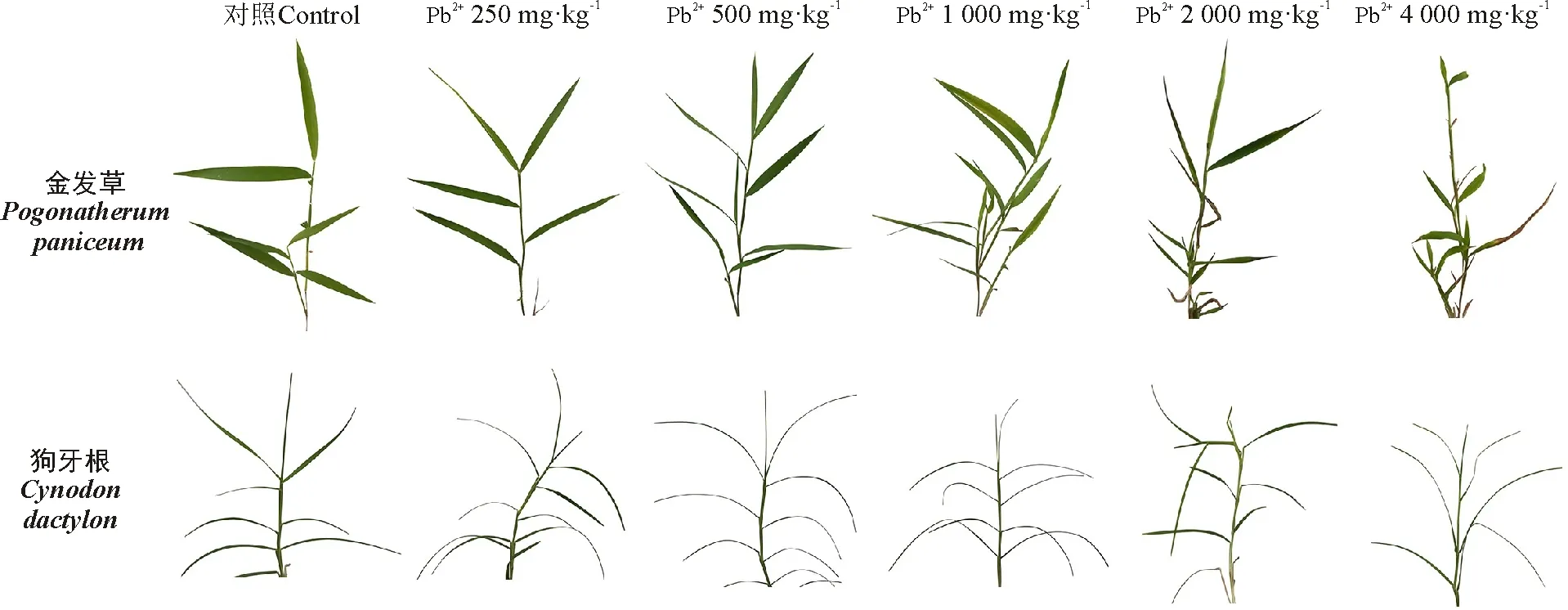
图1 不同浓度Pb2+处理50 d时对金发草和狗牙根叶片形态的影响Fig. 1 Effect of Pb2+ stress on the leaf morphology of Pogonatherum paniceum and Cynodon dactylon in 50 d
金发草和狗牙根地上部干重随Pb2+浓度的增加也逐渐减少。Pb2+浓度4 000 mg·kg-1时,金发草和狗牙根地上部干重比对照分别下降了66.82%、50.09%,狗牙根地上部干重下降幅度同样小于金发草,且同对照差异显著(P<0.05)。同地上部干重毒害情况相比较,可看出Pb胁迫对根系的毒害程度高于地上部,根系是重要的受害器官。
2.3 Pb胁迫对叶绿素含量的影响
随着Pb2+浓度的增大,金发草Chl a和Chl a+b均呈显著下降的趋势,且各个浓度处理间差异显著(P<0.05)。Chl b在Pb2+浓度≤500 mg·kg-1时,较对照差异不显著(P>0.05),Pb2+浓度>500 mg·kg-1时,较对照差异显著(P<0.05)。Pb2+浓度为4 000 mg·kg-1时,Chl a、Chl b和Chl a+b含量最低,较对照分别下降了70.89%、66.00%和70.08%。各浓度下的Chl a/b均显著低于对照(P<0.05)(表2)。

表1 不同浓度Pb处理50 d时对金发草和狗牙根根部干重和地上部干重的影响Table 1 Effect of Pb stress on the root and parts above ground weight of two herbs in 50 d
同列不同小写字母表示不同浓度Pb处理间存在显著差异(P<0.05)。下表同。
Different lowercase letters within the same column indicate significant differences among different Pb2+concentration(P<0.05); similarly for the following tables.
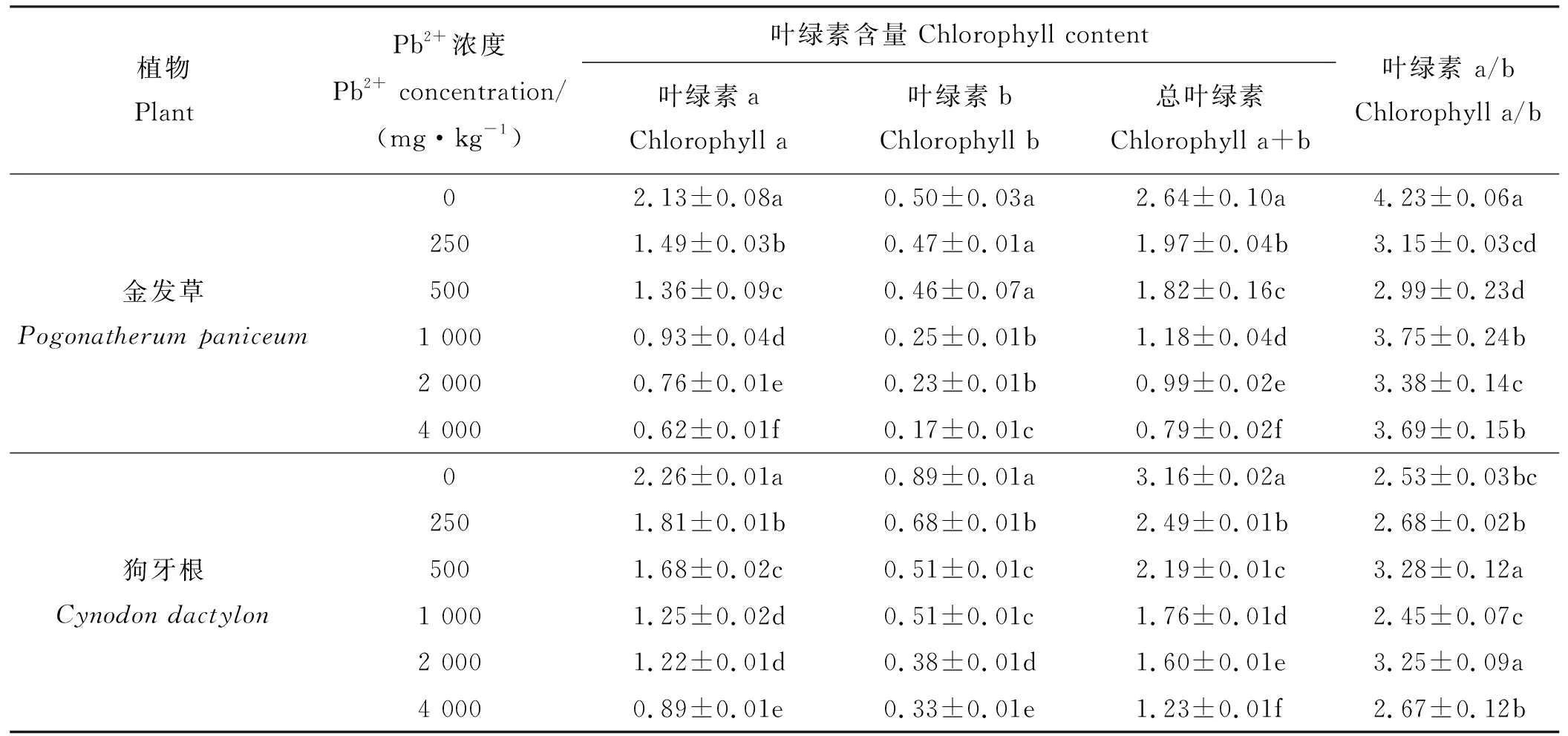
表2 不同浓度Pb处理30 d时对金发草和狗牙根叶片叶绿素含量的影响Table 2 Effect of Pb stress on chlorophyll contents in leaf of two herbs in 30 d
狗牙根的Chl a、Chl b和Chl a+b含量随Pb浓度的增大而降低。与对照相比,Chl a、Chl b和Chl a+b含量均显著低于对照(P<0.05)。Pb2+浓度为4 000 mg·kg-1时,Chla、Chlb和Chla+b含量较对照分别下降了60.62%、62.92%和61.08%,下降幅度均小于金发草(表2)。
2.4 Pb胁迫对质膜透性和丙二醛含量的影响
Pb胁迫处理30 d内,随着Pb胁迫浓度的增加金发草叶片相对电导率(REC)呈上升趋势,说明叶片细胞膜受到了Pb2+的毒害,但在浓度为≤250 mg·kg-1时,叶片REC与对照相比无显著差异(P>0.05)。在30、40、50 d时,4 000 mg·kg-1Pb浓度下,叶片REC上升幅度极大,50 d时达到了最大值,与同期的对照相比上升了197.93%。Pb胁迫处理20~50 d内,随着Pb2+浓度胁迫的增加狗牙根叶片REC呈上升趋势。在50 d时与同期的对照相比上升了249.72%,上升幅度大于金发草(图2)。
处理10~40 d时,金发草MDA含量随着Pb2+浓度的增大先升高后降低。Pb胁迫10~30 d且Pb2+浓度≥250 mg·kg-1时,MDA含量与对照差异显著(P<0.05)。处理40~50 d时,MDA含量较10、20和30 d处理出现下降。狗牙根处理10~40 d时,MDA含量随着Pb2+浓度的增大先升高后降低。处理50 d且Pb2+浓度为250、500、1 000、2 000 mg·kg-1时,与对照相比分别增加19.44%、47.22%、52.78%、66.67%,但与处理20~40 d相比MDA含量总体下降(图3)。

图2 不同浓度Pb处理对金发草和狗牙根叶片相对电导率的影响Fig. 2 Effect of different concentrations of Pb treatment on leaf REC of two herbs
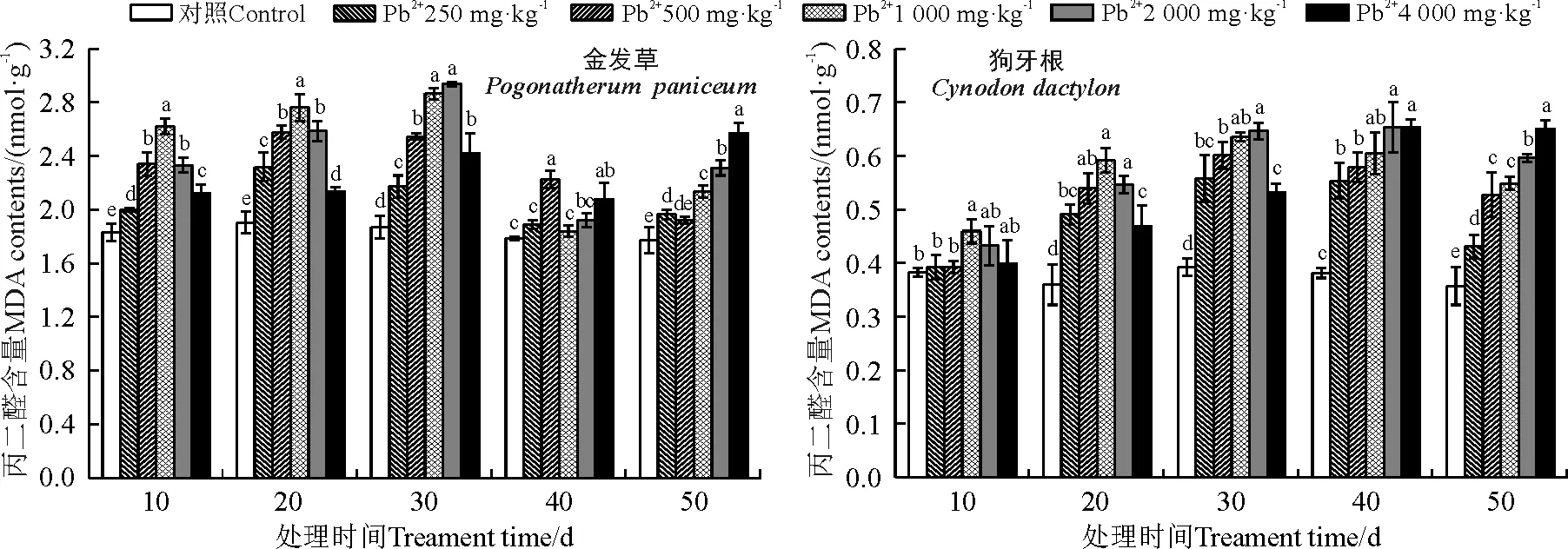
图3 不同浓度Pb处理对金发草和狗牙根丙二醛含量的影响Fig. 3 Effect of different concentrations of Pb treatment on MDA contents of two herbs
2.5 Pb胁迫对渗透调节物质含量的影响
处理10 ~20 d时,金发草可溶性糖含量随胁迫浓度的增加呈先升后降的趋势。处理30 d且Pb2+浓度为4 000 mg·kg-1时达到最大值,同对照相比增加了74.06%,差异显著(P<0.05)。处理40~50 d,浓度为1 000、2 000和4 000 mg·kg-1时含量出现下降,处理50 d,2 000 mg·kg-1浓度时可溶性糖含量最低,但仍较对照增长了27.44%,且差异显著(P<0.05)。狗牙根可溶性糖含量整体波动较大,处理30 d且Pb2+浓度为4 000 mg·kg-1时达到最大值,同对照相比显著增加了94.46%(P<0.05)。说明Pb胁迫对植株的毒害作用随着时间的延长不断增强。处理40~50 d时狗牙根可溶性糖含量呈现先升后降的趋势,但总体较30 d时下降。4 000 mg·kg-1浓度时,处理50 d较30 d下降30.10%(图4)。
处理10~30 d时,金发草可溶性蛋白含量在各处理浓度下均不同程度的升高,40 d时含量较30 d出现下降后50 d时又出现上升趋势,这样的原因可能是因为金发草可溶性蛋白遭到破坏后,经过一定的周期时间又产生新的可溶性蛋白来提高自身耐Pb性。处理10~40 d时狗牙根可溶性蛋白含量随胁迫浓度的增大而持续上升,处理40 d,2 000 mg·kg-1时达到最大值,同对照相比显著增加了28.43%(P<0.05)。50 d时各个胁迫浓度处理的可溶性蛋白含量较40 d时均有所下降,1 000 mg·kg-1时达到最大值,同对照相比增加了21.21%(图5)。
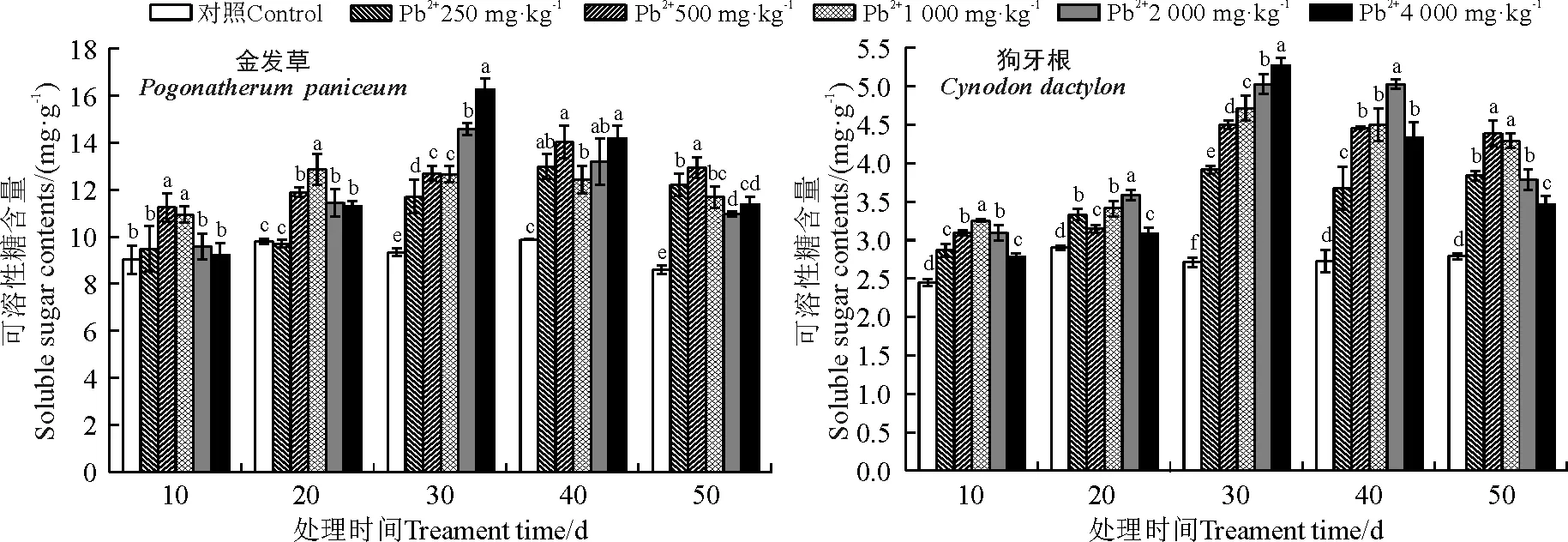
图4 不同浓度Pb处理对金发草和狗牙根可溶性糖含量影响Fig. 4 Effect of different concentrations of Pb treatment on soluble sugar contents of two herbs
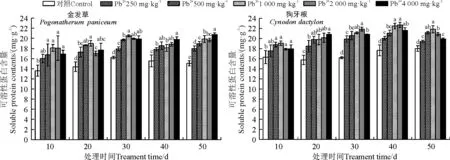
图5 不同浓度Pb处理对金发草和狗牙根可溶性蛋白含量影响Fig. 5 Effect of different concentrations of Pb treatment on soluble proteincontents of two herbs
2.6 Pb胁迫对两种草叶片酶活性的影响
2.6.1对SOD的影响 随着Pb2+胁迫时间的延长,两种草的SOD活性均呈现先升高后下降的趋势,且同时期相比活性随着Pb2+浓度增加始终显著高于对照。处理30 d,Pb2+浓度为4 000 mg·kg-1时,金发草SOD活性达到最大值,较对照上升了139.28%,30 d之后缓慢下降,但各浓度梯度始终均与对照差异显著(P<0.05),处理50 d,4 000 mg·kg-1时,SOD活性较30 d的最大值下降了18.95%。狗牙根SOD活性在30 d时,随处理浓度升高急剧上升,与对照差异显著(P<0.05),4 000 mg·kg-1浓度时,SOD活性较对照上升了194.00%。处理40~50 d时各浓度处理出现下降,在50 d,4 000 mg·kg-1浓度时,SOD活性较30 d最大值下降了20.53%(图6)。
2.6.2对POD的影响 随着Pb2+浓度升高和胁迫时间的延长金发草POD活性总体呈现持续升高的趋势,处理50 d且Pb2+浓度为4 000 mg·kg-1时达到最大值,比同期对照增加了304.97%,处理10 d,Pb2+浓度为250 mg·kg-1处理与对照差异不显著(P>0.05),这说明在低浓度下金发草POD活性能够维持一个稳定的范围。狗牙根与金发草趋势有所不同,处理10~40 d且Pb2+浓度≤2 000 mg·kg-1时,POD活性持续上升。处理40 d,Pb2+浓度为2 000 mg·kg-1时狗牙根POD活性达到最大值,同对照相比增加了259.41%。处理50 d时,500、1 000、2 000和4 000 mg·kg-1均较处理40 d时下降了6.49%、3.77%、8.60%和3.24%,仍远高于同期对照(P<0.05)(图7)。
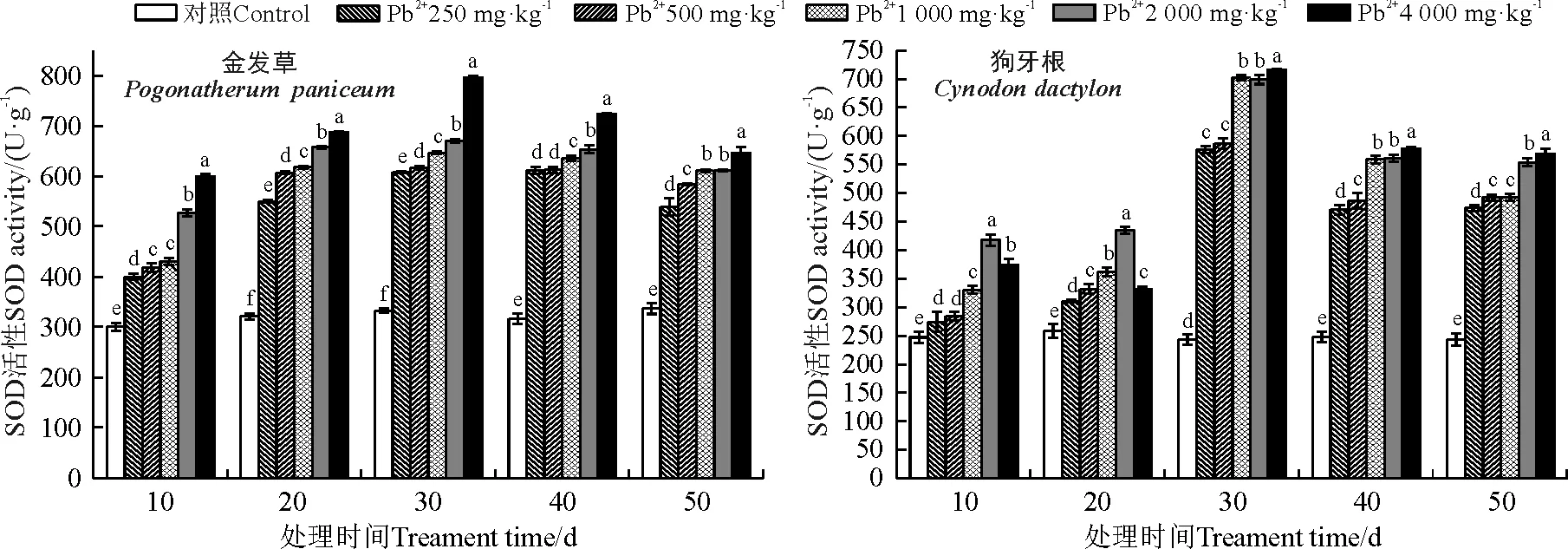
图6 不同浓度Pb处理对金发草和狗牙根SOD活性的影响Fig. 6 Effect of different concentrations of Pb on the SOD activity of two herbs
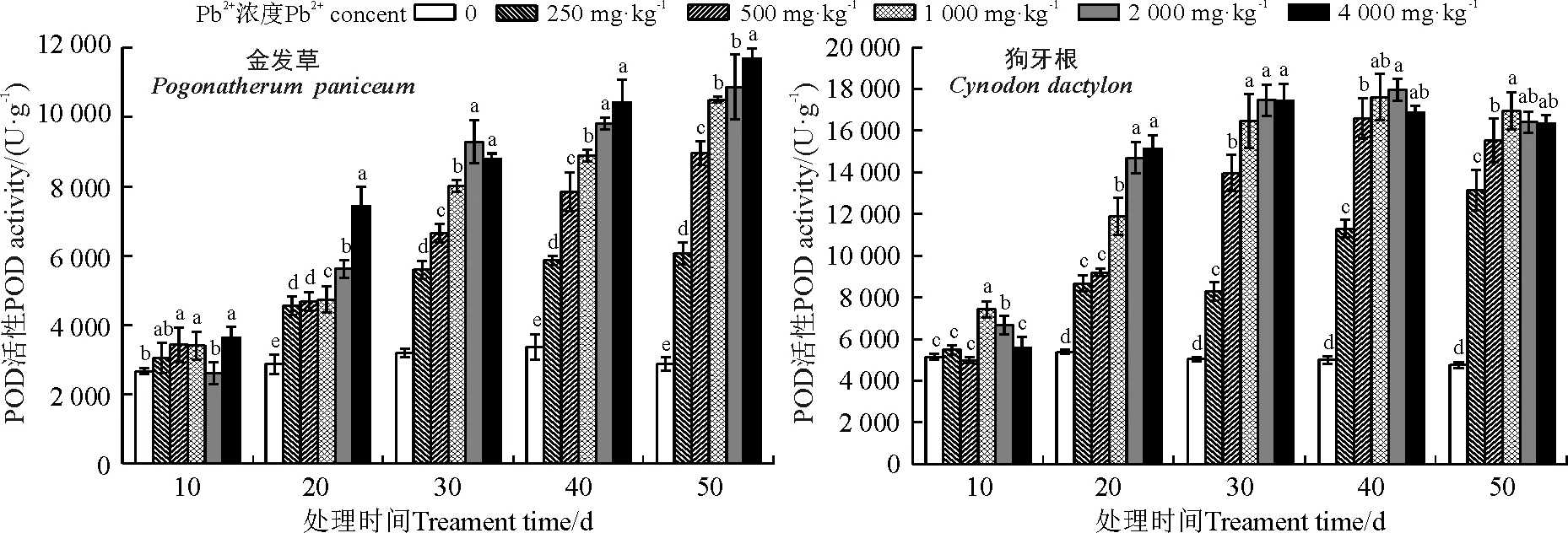
图7 不同浓度Pb处理对金发草和狗牙根POD活性的影响Fig. 7 Effect of different concentrations of Pb on the POD activity of two herbs
2.6.3对CAT的影响 处理10~50 d内,金发草CAT活性随Pb2+浓度增大先升高后下降。Pb胁迫10 d~40 d时间内,各Pb2+浓度下的CAT活性持续升高,并在处理40 d,Pb2+浓度为4 000 mg·kg-1时达到最大值,较同时期对照升高176.95%。处理50 d时各Pb2+浓度下CAT活性较40 d时明显下降,但仍高于同时期的对照,并且同对照差异显著(P<0.05)。狗牙根CAT活性在处理20 d且Pb2+浓度为500 mg·kg-1时达到最大值,与同期对照相比升高45.23%,处理30、40和50 d时狗牙根各Pb2+浓度下CAT活性较20 d出现下降,在处理50 d且Pb2+浓度为4 000 mg·kg-1时达到最低,但仍较对照升高2.6%。
2.7 Pb在金发草和狗牙根地上部分和根系的分布特征
根据外观形态发现,金发草在处理50 d,Pb2+浓度为4 000 mg·kg-1时生长状态呈现枯萎干黄,生物量骤降等情况,结合渗透调节,抗氧化酶系统指标分析,可以得出金发草并不适合在Pb浓度为4 000 mg·kg-1的土壤中长时间正常地生长。处理50 d且Pb2+浓度为2 000 mg·kg-1时金发草地上部分Pb含量为1 072.28 mg·kg-1,含量高于1 000 mg·kg-1Pb2+处理,超过Pb超富集植物地上部分Pb富集量的标准,但转移系数0.39<1,未能达到Pb超富集植物转移系数的标准。狗牙根根系Pb含量在处理50 d,Pb2+浓度为4 000 mg·kg-1时达到最大值3 096.19 mg·kg-1,高于同时期金发草根系Pb含量,地上部分Pb含量为1 734.12 mg·kg-1,低于金发草。狗牙根对Pb的转移系数最大值出现在Pb2+浓度为250 mg·kg-1时,转移系数为0.70<1,同样未能达到Pb超富集植物转移系数的标准(表3)。
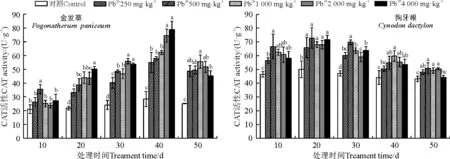
图8 不同浓度Pb处理对金发草和狗牙根CAT活性的影响Fig. 8 Effect of different concentrations of Pb on the CAT activity of two herbs
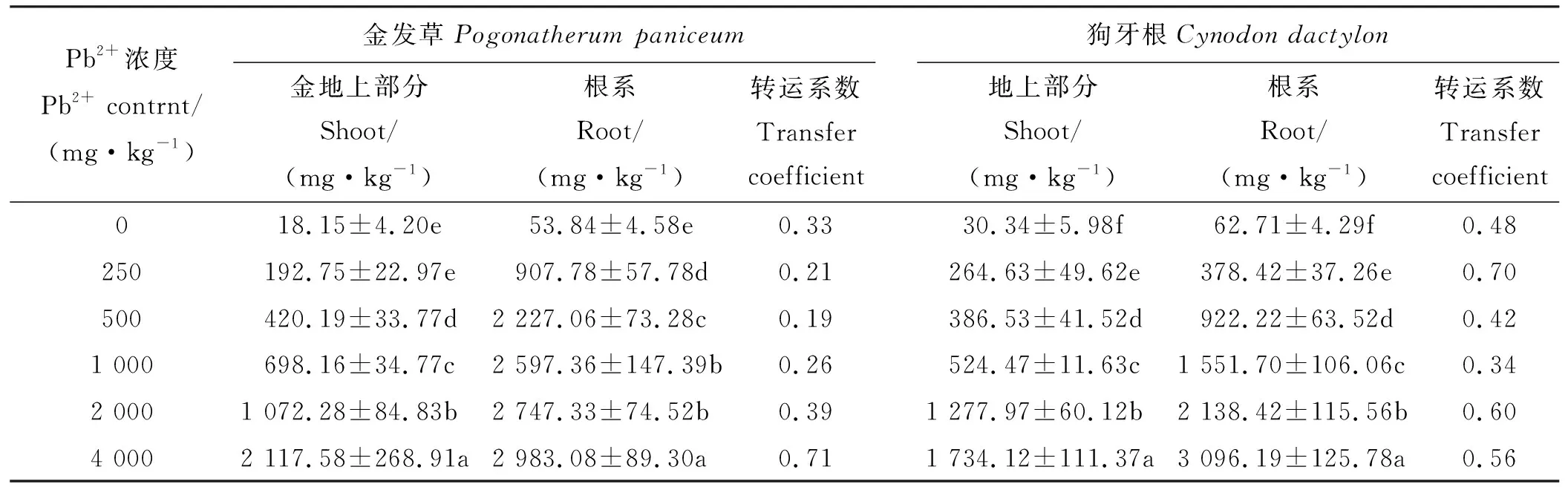
表3 两种植物50 d时地上部分和根系部分Pb含量Table 3 The contents of Pb in shoots and roots of two herbs in 50 d
重金属转移系数=地上部分重金属含量/根系重金属含量
Heavy metal transfer coefficient = heavy metal content above ground/heavy metal content in root.
3 讨论与结论
高浓度的Pb导致草本植物外观质量(色泽、密度、质地)下降,失绿和分蘖减少是Pb对植物生长影响较为直观的表现[21-22]。本研究中,其结果同样表明高浓度Pb2+(≥1 000 mg·kg-1)胁迫会造成草本植物的生长及外观形态的伤害,且随着Pb2+胁迫浓度的增大伤害愈发明显,这一结果与朱燕华[23]研究草坪植物对Pb的耐性及富集特性结论相一致。此外,在最高浓度Pb2+4 000 mg·kg-1时,金发草叶片失绿发黄,枯萎卷曲严重,而狗牙根仅叶片基部失绿,其上部叶片并未表现出明显受害症状,从叶片外观上看,狗牙根较金发草具有更高的Pb耐受能力。
本研究中,金发草和狗牙根生物量上表现出相同的变化趋势,根部干重和地上部干重均随Pb2+浓度增大逐渐减少,但根部干重较地上部下降幅度更大,可能是根系作为植物和土壤直接接触的首要部位,其受到的毒害症状比地上部更直接和明显。这与前人的研究[21,24]结果一致。金发草根系生物量下降幅度大于狗牙根,从这一方面狗牙根根系的Pb耐受性强于金发草。
叶绿素是植物进行光合作用的物质基础,通过含量高低可以判定植物光合作用强弱[25-26]。Chl a能够将光能转换成电能,进行电子传递后,最后变为植物可以利用的化学能,Chl b的作用为将光能吸收并且进行传递,Chl a/b的比值能够说明植物光合作用速率的强弱,与其呈负相关[27]。本研究中,随着Pb2+胁迫浓度增大,金发草和狗牙根的Chl a、Chl b和Chl a+b含量均逐渐下降,但在4 000 mg·kg-1Pb胁迫下,狗牙根较对照下降幅度为60.62%、62.92%、61.08%,金发草较对照下降幅度为70.89%、66.00%、70.08%,狗牙根下降幅度均低于金发草,从这一方面可以推断出狗牙根对高浓度Pb胁迫的耐受性强于金发草,并且与前面目测外观质量结果相吻合。金发草和狗牙根的Chl a/b值的最小值分别出现在500和1 000 mg·kg-1的低浓度Pb2+(≤1 000 mg·kg-1)处理下,说明低浓度Pb会提高植物的光合速率,增强植物的光合作用。
细胞膜是保障植物细胞内外物质交换运输的重要结构,Pb2+可以通过破坏植物细胞膜完整性,致使膜透性增加,使细胞内的渗透势、水分失衡,影响细胞的正常生理活动[28]。逆境胁迫下,植物的ROS等物质的积累会增多,MDA是膜脂过氧化产物之一,其含量的高低可以反映膜脂过氧化程度[29]。结果表明,高浓度Pb2+胁迫下,金发草和狗牙根叶片REC增大,但金发草和狗牙根MDA含量却表现出不同的变化趋势,金发草MDA含量下降的原因可能是金发草通过自身保护机制调节清除MDA以抵御逆境胁迫,但是外观形态观察金发草在4 000 mg·kg-1Pb2+胁迫下已无法正常生长,叶片枯萎卷曲严重,说明长时间的4 000 mg·kg-1Pb2+胁迫严重超出了其耐受的阀值,植物濒临死亡,这也与50 d时4 000 mg·kg-1Pb胁迫下金发草的MDA再次上升相对应。而狗牙根的MDA含量50 d时下降可能是由于自身保护机制能够正常发挥作用,致使其MDA含量下降。而在低浓度Pb2+胁迫下,两种草的REC和MDA含量变化不显著(P>0.05),说明此时植物自身保护机制能够正常运行,所受到的毒害在植物可控范围内。
植物在干旱、高盐、低温以及重金属胁迫等逆境时,会通过积累可溶性蛋白、可溶性糖、甜菜碱等一系列渗透调节物质来维持植物细胞的重要代谢活动,增强植物的抗逆性[30]。通常可溶性糖含量越高,植物抗逆性越强[31]。试验发现,两种草可溶性糖含量均出现先升后降的变化趋势,说明植物在低浓度下可通过调节体内可溶性糖来抵御Pb胁迫,而高浓度Pb影响了植物吸收营养物质,使可溶性糖合成过程受阻,从而导致可溶性糖含量下降[32]。狗牙根可溶性糖含量变化幅度较金发草小,说明狗牙根自身具有较强的维持细胞膨压、降低渗透势的能力。金发草的可溶性蛋白含量持续升高,狗牙根的可溶性蛋白含量先升后降,原因一方面可能是因为低浓度Pb诱导两种草形成金属硫蛋白和类金属螯合蛋白等结合蛋白,提高植物的抗逆性[32];另一方面可溶性蛋白可以保证细胞渗透势正常的代谢活动[33-34]。而狗牙根下降的原因可能是高浓度、长时间的Pb胁迫使其渗透调节系统达到了阀值,植物膜系统遭到严重破坏[35]。
正常情况下,作为保护酶系统的重要组成部分,SOD、POD、CAT等能维持体内ROS产生和清除的动态平衡,从而防止过量ROS对细胞的毒害[5]。植物在不同逆境下,会通过抗氧化酶系统和非酶抗氧化物质来抵抗逆境诱导的氧化伤害,以减少ROS的积累,降低膜伤害的程度[36]。结果表明,金发草和狗牙根SOD活性均随Pb胁迫时间的延长表现出先升后降的变化趋势,说明在Pb胁迫下SOD通过增强活性来清除ROS,当胁迫时间延长,植物体内累积过多Pb2+时,高浓度Pb2+会使得H2O2积累过多并抑制O·2-转化,进而使SOD活性降低[21]。在高浓度Pb2+下狗牙根的SOD活性上升和下降幅度均大于金发草,说明狗牙根SOD活性对Pb胁迫造成的ROS清除方面更为敏感和迅速,后期降幅大的原因可能是狗牙根的抗氧化酶系统及时地进行了调整和适应[21]。过氧化物酶POD的主要作用是清除氧代谢中产生的H2O2以及由此产生的氢过氧化物ROOH[5]。结果表明,两种草在Pb胁迫下POD活性均显著增加,其中金发草POD活性随胁迫时间的延长持续升高,狗牙根在高浓度Pb处理下,POD活性先升后降,原因可能是当两种草处于低浓度Pb胁迫时,植物通过提高POD活性来增强清除H2O2的能力,但是当Pb2+浓度超出植物的耐受范围时,有害物质过多会导致细胞内的酶系统受到损害,代谢趋于紊乱,抑制抗氧化酶基因的表达,导致POD活性下降[37]。CAT是植物体内一种重要的氧化还原酶,可以清除植物通过呼吸代谢或者光合作用等途径产生的H2O2,维持活性氧代谢平衡,保护细胞膜的完整性[38]。两种草CAT活性均随着时间延长和Pb2+浓度增大先升后降,金发草CAT活性在40 d时达到最大值后骤降,可能是因为金发草对Pb胁迫产生应激保护反应后,Pb2+浓度过大和长时间胁迫,超出植物的耐受范围后活性被减弱,符合植物对胁迫的典型特征[5,39]。狗牙根CAT活性变化范围较金发草小,10 d时CAT活性较对照显著升高后下降幅度平缓,说明狗牙根的CAT发挥作用时间较金发草早,并且在Pb2+高浓度、长时间胁迫下仍能正常的发挥作用,说明不同植物的自身保护酶体系机制不同,其CAT活性对Pb胁迫反应时间也存在较大的差异。
随着Pb2+胁迫浓度的升高和时间的延长,两种草根系和地上部的Pb含量逐渐增加,Pb在两种草体内的分布特征均为根系含量高于地上部含量,说明根是积累Pb的主要器官[40]。金发草在4 000 mg·kg-1时生长状态呈现枯萎干黄、生物量骤降等,结合其他所测生理指标分析,可以得出金发草在Pb2+浓度4 000 mg·kg-1时并不能正常生长,而在Pb2+浓度2 000 mg·kg-1时金发草能够较为正常的生长。狗牙根在250 mg·kg-1Pb2+胁迫下的转移系数最大。两种草地上部Pb富集含量均高于Pb超富集植物的标准,但转运系数均未达到Pb超富集植物标准。
Pb污染土壤会抑制两种草的生长,叶片外观质量、生物量及叶绿素含量均出现不同程度的下降,两种草均能够通过增加渗透调节物质和提高抗氧化酶活性来抵御土壤Pb胁迫。金发草在Pb2+浓度4 000 mg·kg-1时并不能正常生长,Pb2+浓度为2 000 mg·kg-1时金发草能保持较为正常的生长状态。Pb2+浓度为4 000 mg·kg-1时狗牙根的耐受能力强于金发草。因此狗牙根能够更好地适应土壤Pb污染环境,在Pb污染土壤修复中具有更大的应用价值。

