PET/MRI在儿童难治性癫痫定位诊断中的应用
张桂霞,卢 倩,党浩丹,刘雨田,刘丽英,刘家金,徐白萱,邹丽萍,
1解放军总医院 儿童医学中心,北京 100853;2首都医科大学 脑重大疾病研究中心,北京脑重大疾病研究院,北京 100069;3解放军总医院 核医学科,北京 100853
癫痫是中枢神经系统的常见疾病,全世界大约6 500万人患有癫痫[1],多在儿童期发病,经过抗癫痫药物治疗,大部分患儿的发作可以得到控制,但有20% ~ 30%的患儿治疗效果欠佳,成为儿童难治性癫痫[2]。癫痫的病因复杂,包括结构、遗传、感染、代谢、免疫以及不明原因等[3]。随着检查技术的进步,越来越多的致痫因素被发现,针对病因的精准治疗,更有利于发作的控制。磁共振成像(MRI)是临床常用的检查方法,但有些难治性癫痫病例MRI显像为阴性。正电子发射计算机断层显像(positron emission tomography,PET)是近年来新兴的影像诊断方法,能够反映癫痫灶的代谢活动,但PET显像的分辨率较低,难以准确判断病灶的范围,而MRI检查对软组织的显像清晰,细节分辨率高[4]。随着神经影像学的发展,将PET与MRI成像融合,不但能发现大脑组织解剖结构异常,还能发现代谢及功能异常,为癫痫的诊断和病灶的定位提供了确切的依据。国外PET/MRI在小儿神经系统疾病的诊断及癫痫术前的定位诊断方面应用较多,但国内研究仍较少。本研究对61例难治性癫痫患儿采用PET/MRI检查,探讨其在临床中的应用价值。
资料和方法
1 资料 回顾性分析2015年9月- 2018月4月于解放军总医院行PET/MRI检查的61例难治性癫痫患儿资料。入组标准:1)符合难治性癫痫的诊断标准:应用两种以上抗癫痫药物,合理治疗6个月~ 1年,发作未减少50%;2)临床病史、EEG、MRI及PET/MRI资料完整。排除标准:1)不符合难治性癫痫诊断标准;2)有明确出生缺陷及遗传代谢性疾病等;3)临床资料不完整;4)依从性差,对检查治疗不能很好配合。入组患儿均经家长或监护人知情同意并签署同意书。
2 脑电图检查 入组患儿均行常规EEG检查,采用国际10-20系统,包括清醒和睡眠期脑电图监测。由2名专业医师分析脑电图,判断有无癫痫样放电及放电部位,观察基本节律是否正常。
3 MRI检查 利用MR扫描机对头颅进行常规横位、轴位、冠状位及矢状位T1WI、T2WI、FLAIR序列扫描。由磁共振室2名专业医师阅片,进行综合判读。
418F-FDG PET/MRI检查 61例患儿均在发作间期行18F-FDG PET/RMI显像,数据采集由德国Siemens公司Biograph mMR PET/MR仪完成。放射性示踪剂采用18F-FDG(放化纯度>98%),确认患儿无MRI检查禁忌证。检查前至少禁食4 h以上,按3.7 MBq/kg静脉注射18F-FDG,注射完毕后卧床休息40 min,开始PET和MRI同步扫描。采集图像:1)PET采集1个床位,采集8 min,采用基于超短回波时间(ultrashort echo time,UTE)序列为基础的衰减校正方法。2)MR序列在PET采集的同时同机进行,共40 ~ 45 min,采用12通道头部线圈,共采集7个序列,依次为PET/MR衰减校正序列,横断及冠状T2加权液体衰减反转恢复序列(transverse and coronal T2 fluid-attenuated inversion recovery,T2-FLAIR),T1加权三维磁化强度预备梯度回波序列(T1 weighted imaging-three dimensional magnetization prepared rapid acquisition gradient echo,T1WI-3D-MPRAGE)、DWI序 列 最后采集。由两名有经验的核医学科医师共同双盲阅片,进行视觉分析,判断各部位放射性分布情况,以患者健侧或正常人相同部位的放射性摄取为标准,连续在两个层面上出现明确的高或低代谢区视为异常,两侧相应区域对比放射性活度降低或升高15%考虑为致痫灶[5]。对不合作的患儿检查前给予口服10%水合氯醛溶液镇静。
5 统计学处理 采用SPSS22.0软件分析数据。符合正态分布的计量资料以-x±s表示,组间比较采用t检验。计数资料以例数及百分数表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
结 果
1 纳入患儿一般情况 符合入组条件的难治性癫痫患儿61例,其中男性32例,女性29例,男女比例为1.1∶1。男性平均发病年龄(6.45±3.04)个月,女性平均发病年龄(7.21±3.44)个月,差异无统计学意义(P=0.37)。
2 EEG特征 61例入组患儿EEG均有异常放电,其中高度失律23例,不典型高度失律16例,弥漫性棘波、慢波5例,左额棘波、棘慢波4例,双额棘波、棘慢波4例,右颞慢波、尖波3例,左后头部棘慢、尖慢2例,顶叶尖慢波4例。
3 MRI阳性检出率 患儿均行MRI脑显像,未发现异常33例(54.1%),发现病灶28例(45.9%),其中囊肿1例,肿瘤1例,脑发育不良7例,胼胝体缺如1例,海马硬化1例,脑萎缩2例,其余15例为非特异性改变,阳性检出率45.9%。
4 PET/MRI特征 61例均于癫痫发作间期做了18F-FDG PET/MRI显像,全部显示为低代谢灶,单部位代谢减低24例(39.3%),其中左侧代谢减低17例(70.8%),右侧代谢减低7例(29.2%);多部位代谢减低37例(60.7%),其中左侧代谢减低15例(40.5%),右侧代谢减低2例(5.4%),双侧代谢减低20例(54.0%)。见表1。
5 PET/MRI与MRI定位致痫灶比较 在MRI阴性的33例中,PET/MRI显像单部位代谢减低10例(30.3%),多部位代谢减低23例(69.7%);MRI阳性的28例中,PET/MRI显像7例(25.0%)为单部位低代谢,21例为多部位低代谢(75.0%),两种检查方法比较,PET/MRI显像多为多灶异常(χ2=7.50,P=0.006)。见表 2。
6 手术治疗 手术患儿19例,其中7例实施半球离断术,11例行癫痫灶切除术,2例行热凝术。在11例手术切除的患儿中,1例病理报告为中枢神经细胞瘤,1例左颞囊肿,9例病理报告为局灶性皮层发育不良(focal cortical dysplasia,FCD),其中FCDⅠ型6例,FCDⅡ型2例,FCDⅢ型1例。19例手术患儿中,16例(84.2%)患儿根据详细的神经系统查体、发作视频判断癫痫灶的起源、脑电图定位及PET/MRI显像定位与术中定位完全一致,随访时间6 ~ 18个月,其中2例(10.5%)(1例行半球离断术,1例行胼胝体前段切开并左额皮质热灼术)术后半年复发,但发作较术前减少50.0%,17例(89.5%)患儿术后无发作。

表1 61例难治性癫痫患儿PET/MRI显像异常代谢灶的分布Tab. 1 Distribution of abnormal metabolic focus in PET/MRI in 61 children with refractory epilepsy (n, %)

表2 PET/MRI与MRI定位致痫灶的比较Tab. 2 Comparison of epileptogenic focus between PET/MRI and MRI (n)
7 典型病例 患儿男,1岁9个月,癫痫,部分性发作6个月,视频脑电图(VEEG):左额、中央区尖慢波发放。相继给予口服丙戊酸钠、氯硝西泮、托吡酯、左乙拉西坦等治疗6个月,发作未减少。既往史、个人史及家族史无异常。神经系统查体:右手不能抓握,右侧肌张力高,血尿代谢筛查均未见异常。PET/MRI示:双侧额顶交界区皮质放射性摄取减低,以左侧为著,同机MRI未见确切结构异常(图1)。经严格术前评估后,手术切除左侧额顶皮质组织(即致痫灶)。病理:镜检见皮质神经元排列构筑紊乱,部分灰白质界限不清,局灶灰白质交界区可见气球样细胞,白质内神经元增多,为FCDⅡb型。患儿为部分性发作,术前神经系统查体、VEEG、PET/MRI判断的病灶部位与术中发现一致。术后发作控制,随访6个月,复查EEG左侧中央区低电压(术后改变)。
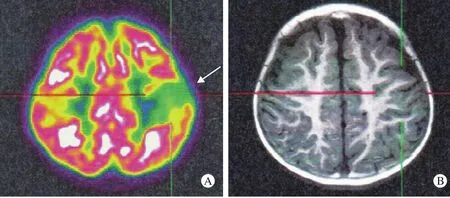
图1 PET/MRI示:双侧额顶交界区皮质放射性摄取减低,以左侧明显(A图箭头所示),同机MRI未见确切结构异常(B图)Fig. 1 PET/MRI showed a decrease in radioactivity uptake in the bilateral fronto-parietal junction cortex, which was evident on the left side (arrow on panel A). No structural abnormalities was found on the MRI (panel B)
讨 论
PET是将人体代谢所需的某种物质,标记上放射性核素(如18F、11C等)注入体内,利用符合探测技术进行数据采集和处理,通过对该物质的代谢聚集进行诊断的影像技术。通过特异性示踪剂测量,显示放射性药物在人体内的分布情况,从而确定体内某种代谢水平和生理功能,达到对疾病的早期诊断,具有很高的灵敏度和准确性[6]。PET/MRI是把PET的分子影像学和MRI显像两者技术融合于一体,一次扫描可以同时获得PET与MRI图像,实现大脑功能、代谢及解剖结构的精准融合。目前对于癫痫灶的定位,国内18F-FDG PET/CT应用较多,但是在检查过程中,患者将接受一定剂量的X线及PET辐射,儿童处于生长发育阶段,对放射线更敏感,并且自我修复能力差,接受过多的射线,危害更大。PET/MRI用于判断癫痫病灶避免了X线造成的电离辐射,结合发作间期或发作期EEG放电部位及临床症状学,进行术前评估,为癫痫外科手术治疗提供更精准的定位信息。
本研究共纳入61例难治性癫痫患儿,MRI脑显像,阳性检出率45.9%,与文献报道基本一致[7]。61例患儿均于癫痫发作间期行18F-FDG PET/MRI显像,全部显示为低代谢灶,其中单部位代谢减低17例,多部位代谢减低44例。在癫痫发作期,致痫灶神经元反复过度的超同步化放电,是一个显著的耗能过程,表现为高代谢灶,随后的发作间期无额外耗能,且致痫灶残留的神经元数量较正常脑组织少,故消耗能量较正常脑组织少,出现局部代谢减低[8]。国外文献报道18F-FDG PET所示的葡萄糖代谢减低区包含致痫灶,并且低代谢范围比手术区域大[9]。分析可能与病灶引起的神经传导网络损伤有关[10]。两种检查方法比较,PET/MRI更多的显像为多灶异常。
本组19例手术患儿中,2例(10.5%)术后半年复发,但发作较术前减少50%,17例(89.5%)术后无发作。Capraz等[11]研究24例MRI阴性、PET阳性颞叶癫痫病人行手术治疗,超过2/3的病人术后癫痫发作得到了控制。北京大学第一医院总结难治性癫痫手术患儿,行癫痫灶切除,术后无发作率可达到80%左右。当不能明确致痫灶,或为多灶性或全面性发作,无法行切除性手术时,给予姑息性手术,包括胼胝体切开或迷走神经电刺激手术,半数患儿可实现发作减少50%以上或发作程度减轻,与我们的研究结果接近[12]。
FCD是局部大脑皮质发育畸形,与成人和儿童癫痫相关,在病理学上分为3型,分别是FCDⅠ型、FCDⅡ型及FCDⅢ型[13]。本组11例行癫痫灶切除的患儿,术中发现致痫灶与PET/MRI异常代谢灶、EEG放电部位完全相符,9例(81.8%)病理报告为FCD,其中FCDⅠ型6例,FCDⅡ型2例,FCDⅢ型1例。有报道称FCD是癫痫最常见的神经病理类型[10],在手术病人中占20% ~ 50%。Serino等[14]研究了36例FCD所致的癫痫患儿,其中26例(72.2%)为药物难治性癫痫,手术切除是控制发作的有效措施。国外文献报道,在MRI阴性癫痫患者中,术前用PET/MRI融合定位致痫灶,判断手术切除范围,术后87%的癫痫患者发作得到控制,在发作间期应用PET/MRI定位低代谢病灶,是临床实践中用于癫痫术前评估的一种行之有效的方法[15-16]。我们的研究也证实了这个发现。发作间期PET/MRI的典型表现为致痫灶葡萄糖代谢减低,低代谢可以由很多因素引起,包括神经元缺失,神经功能不能联系,神经功能失调,突触密度减低或过度抑制等[17-18]。
EEG代表脑电生理,MRI反映解剖结构,18FFDG-PET/MRI融合显像既能从解剖结构又能从代谢方面反映脑细胞功能,早期发现致痫灶。临床上可首选EEG、MRI等初步检查寻找致痫灶,当MRI没有发现明显的结构异常,而EEG有局部放电,结合患儿发作视频、临床症状学及神经系统详细查体初步判断癫痫是由局部病灶引起时,再选择PET/MRI显像以进一步明确致痫灶。EEG联合PET/MRI能提高致痫灶的检出率,并对术前评估提供更精确的定位,帮助神经外科医生选择手术适应证,术中判断需要切除的病灶范围,术后判断预后,提高手术疗效,达到控制癫痫发作的目的。总的来看,18F-FDG PET/MRI显像为难治性癫痫患儿无创术前精准定位提供了一种可能,但其价格较昂贵,限制了其在临床中的应用。
Shin等[19]、Fernandez等[20]研究难治性癫痫手术患者,发现PET/MRI融合显像比单独应用MRI或PET更能提高潜在致痫灶的检出率,尤其是对于MRI检查阴性病例,PET/MRI更有利于术中电极的安放及手术定位。与PET/CT相比,PET/MRI辐射剂量小,更适用于儿童这一特殊群体,并且对于软组织分辨率,MRI有其独特的优势[21]。虽然PET/MRI具有许多优点,但仍然需要多中心、大样本量进一步研究其临床应用。

