siRNA靶向NRP-1基因沉默经Wnt、ROS及TGF-β1途径抑制宫颈癌细胞增殖①
李慧敏 王晓霞 武美丽 金莉娅 苗丽娟 孙 礼
(甘肃省妇幼保健院生殖内分泌科,兰州730050)
宫颈癌是常见的女性恶性肿瘤之一,近些年的发病率上升,且呈现出年轻化的趋势,给女性的生命健康造成严重的威胁[1]。宫颈癌的发生发展是一个多阶段、多基因调控的复杂过程,涉及表观遗传学和免疫学改变、癌基因的激活和抑癌基因失活等,因此,寻找有效的宫颈癌诊疗靶点具有重要意义。神经纤毛蛋白(Neuropilin,NRP)是一种细胞膜表面的跨膜糖蛋白,因在神经发育方面的作用而被认识,也因此而得名,有NRP1和NRP2两个成员,NRP1主要在神经细胞、肿瘤细胞和血管内皮细胞等的细胞膜表面表达,属于非酪氨酸激酶辅助受体,是VEGF的共受体,能够与其结合促进血管新生及肿瘤的发展和转移[2,3]。已有研究显示,多种恶性肿瘤中NRP1出现过表达,如肺癌、结肠癌、乳腺癌等,其高表达可促进肿瘤的发生发展[4-6]。目前NRP1在宫颈癌中的研究相对较少,有研究显示,宫颈癌中NRP1的表达升高,其高表达与淋巴结转移和临床分期有关[7],但关于NRP1对宫颈癌生物学特性的影响及机制研究尚未清楚。Wnt信号通路是一类保守的信号通路,与包括宫颈癌在内的多种肿瘤发生发展密切相关,其激活可促进肿瘤发展[8]。本研究通过RNA干扰技术沉默宫颈癌细胞中NRP1的表达,试图研究其对癌细胞活力、凋亡、免疫抑制因子表达及Wnt信号通路的影响。
1 材料与方法
1.1主要材料、试剂和仪器 人正常宫颈细胞Ect1/E6E7 及宫颈癌Hela、CaSki、SiHa、HCC94细胞均购自中科院上海细胞库;DMEM培养基、双抗均购自美国Gibco;胰蛋白酶购自南京凯基生物;NRP-1、TGF-β1、Wnt1、β-catenin、Survivin、Cyclin D1抗体均购自美国Abcam;CCK8试剂盒购自DoJINDO;Bradford试剂盒、Annexin V-FITC/PI细胞凋亡试剂盒、ECL发光试剂盒均购自碧云天生物;脂质体LipofectamineTM2000购自美国Invitrogen;DCFH-DA购自美国Sigma;酶标仪购自美国Thermo;流式细胞仪购自美国BIO-RAD。
1.2方法
1.2.1细胞培养 Ect1/E6E7、Hela、CaSki、SiHa和HCC94细胞用DMEM培养液(含有10%小牛血清及双抗),置于5%体积分数的CO2培养箱中37℃培养。每两天将细胞培养基更换一次,胰酶消化后传代。后续实验选择生长至对数期的细胞。
1.2.2细胞转染 NRP-1的特异性干扰序列(NRP-1-siRNA)及无意义siRNA系列(NC-siRNA组)均委托广州锐博生物设计并合成,通过LipofectamineTM2000进行瞬时转染。转染前一天以每孔1 ml细胞悬液(约1×105个细胞)接种CaSki细胞于6孔板,细胞达60%生长密度时,换为无血清和抗生素的培养液,参照LipofectamineTM2000转染说明将NRP-1-siRNA和NC-siRNA转染CaSki细胞,转染浓度为100 nmol/L,并设置空白对照组(Control组),仅加入脂质体,转染过程严格参照转染说明,转染后于5%体积分数的CO2培养箱中37℃培养5~6 h,换为含血清和无抗生素培养液,继续培养48 h,通过Western blot检测转染后的细胞中NRP-1的蛋白表达。
1.2.3Western blot 在生长至对数期的Ect1/E6E7、Hela、CaSki、SiHa和HCC94细胞及转染NRP-1-siRNA后48 h的CaSki细胞中加入适量的细胞裂解液,置于冰上反应30 min,离心收集总蛋白。Bradford试剂盒测定蛋白浓度;蛋白与上样缓冲液充分混匀后于100℃变性5 min,加50 μg变性蛋白在每孔道中行SDS-PAGE分离,电泳结束后切下目的胶转PVDF膜,将转好的膜在5%浓度的脱脂奶粉中封闭2 h,洗膜,4℃孵育稀释好的NRP-1、TGF-β1、Wnt1、β-catenin、Survivin、Cyclin D1抗体过夜,洗膜,加入二抗,室温孵育1 h,洗膜,ECL显色,化学发光仪内曝光并保存图像。
1.2.4CCK8法检测细胞活力 以每孔中100 μl(1×105ml-1)接种生长至对数期的CaSki细胞于96孔板,常规培养24 h后将NRP-1-siRNA和NC-siRNA转染CaSki细胞,并设置空白对照组(Control组),每组均设置5个复孔,于转染的48 h在每个待测孔中加入CCK8试剂10 μl,培养箱内培养1 h,酶标仪测定450 nm吸光度值(OD值),以OD值反映细胞活力,可以间接反映出细胞的增殖能力。实验重复3次。
1.2.5流式细胞术检测细胞凋亡率 细胞凋亡率检测使用Annexin V-FITC和PI进行荧光染色,通过流式细胞仪检测。收集转染48 h的细胞,PBS洗涤细胞,胰酶消化后将细胞悬浮于500 μl的Binding缓冲液中,混匀后加入5 μl的Annexin V-FITC和5 μl 的PI,室温避光环境孵育10~15 min,上机,流式细胞仪检测。实验重复3次。
1.2.6流式细胞术检测ROS含量 PBS洗涤细胞,细胞悬浮于含DCFH-DA(终浓度为10 μmol/L)的无血清培养液中,37℃孵育20 min,以无血清的培养基洗涤细胞,将没有进入细胞的DCFH-DA去除掉,流式细胞仪检测荧光强度(激发波长和发射波长分别为488 nm和525 nm),由于荧光强度与细胞内的ROS水平呈现出正相关,因此可以荧光强度大小反应细胞内ROS的水平。实验重复3次。

2 结果
2.1NRP-1在宫颈癌细胞表达 以人正常宫颈细胞Ect1/E6E7 为对照细胞,Western blot检测宫颈癌Hela、CaSki、SiHa、HCC94细胞NRP-1的蛋白表达,结果如图1所示,Ect1/E6E7、Hela、CaSki、SiHa、HCC94细胞NRP-1的蛋白表达分别为(0.092±0.010)、(0.245±0.032)、(0.473±0.041)、(0.337±0.038)、(0.316±0.033),NRP-1在宫颈癌细胞的表达均显著高于在Ect1/E6E7 细胞中的表达(P<0.05)。
2.2NRP-1-siRNA转染CaSki细胞效果 NRP-1-siRNA转染CaSki细胞48 h, Western blot检测转染后的细胞中NRP-1的蛋白表达,结果如图2所示,Control组、NC-siRNA组和NRP-1-siRNA组NRP-1的蛋白表达分别为(0.312±0.032)、(0.324±0.036)、(0.090±0.009),NRP-1-siRNA组NRP-1的表达显著低于对照组(P<0.05),而在NC-siRNA组的表达与对照组差异无统计学意义(P>0.05)。
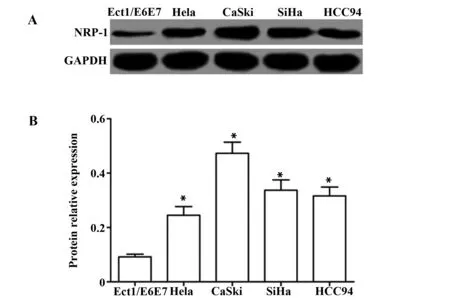
图1 NRP-1在宫颈癌细胞表达Fig.1 NRP-1 expression in cervical cancer cellsNote: A.Western blot was used to detect the expression of NRP-1 in cervical cancer cells;B.The relative expression of NRP-1 protein in cervical cancer cells;compared with Ect1/E6E7 cells,*.P<0.05.
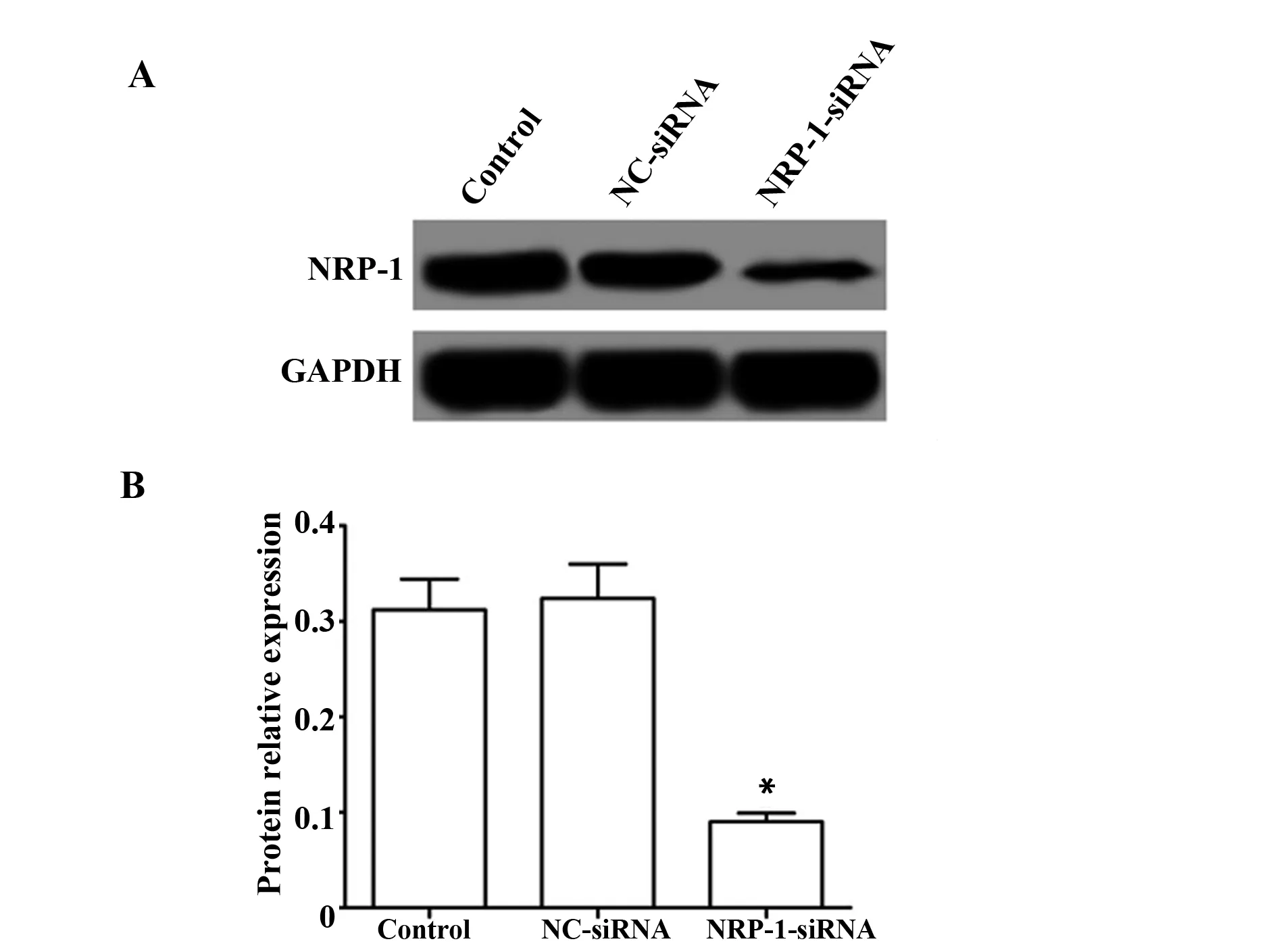
图2 NRP-1-siRNA转染CaSki细胞后NRP-1的蛋白表达Fig.2 Protein expression of NRP-1 after NRP-1-siRNA was transfected into CaSki cellsNote: A.The protein expression of NRP-1 in CaSki cells transfected with NRP-1-siRNA were detected by Western blot;B.The relative expression of NRP-1 protein;compared with the Control group,*.P<0.05.
2.3NRP-1-siRNA转染降低CaSki细胞活力及诱导细胞凋亡 各组细胞活力及凋亡率检测结果如图3所示,Control组、NC-siRNA组和NRP-1-siRNA组的OD值分别为(0.683±0.065)、(0.669±0.062)、(0.321±0.037),凋亡率分别为(2.01±0.32)%、(2.12±0.38)%、(11.83±0.87)%,与对照组比较,NRP-1-siRNA组细胞活力显著降低(P<0.05),细胞凋亡率显著升高(P<0.05)。
2.4NRP-1-siRNA转染诱导CaSki细胞ROS产生 通过流式细胞仪检测各组细胞中相对荧光强度,由于荧光强度与细胞内的ROS水平呈现出正相关,因此可以荧光强度大小反应细胞内ROS的水平,结果如图4所示,Control组、NC-siRNA组和NRP-1-siRNA组ROS水平分别为(16.6±1.02)、(18.1±1.11)、(34.3±1.85),与对照组比较,NRP-1-siRNA组ROS水平显著升高(P<0.05)。
2.5NRP-1-siRNA转染降低CaSki细胞免疫抑制因子TGF-β1表达 Western blot检测各组细胞中免疫抑制因子TGF-β1表达,结果如图5所示,Control组、NC-siRNA组和NRP-1-siRNA组TGF-β1的蛋白表达分别为(0.362±0.042)、(0.374±0.045)、(0.153±0.016),与对照组比较,NRP-1-siRNA组TGF-β1的表达显著降低(P<0.05)。
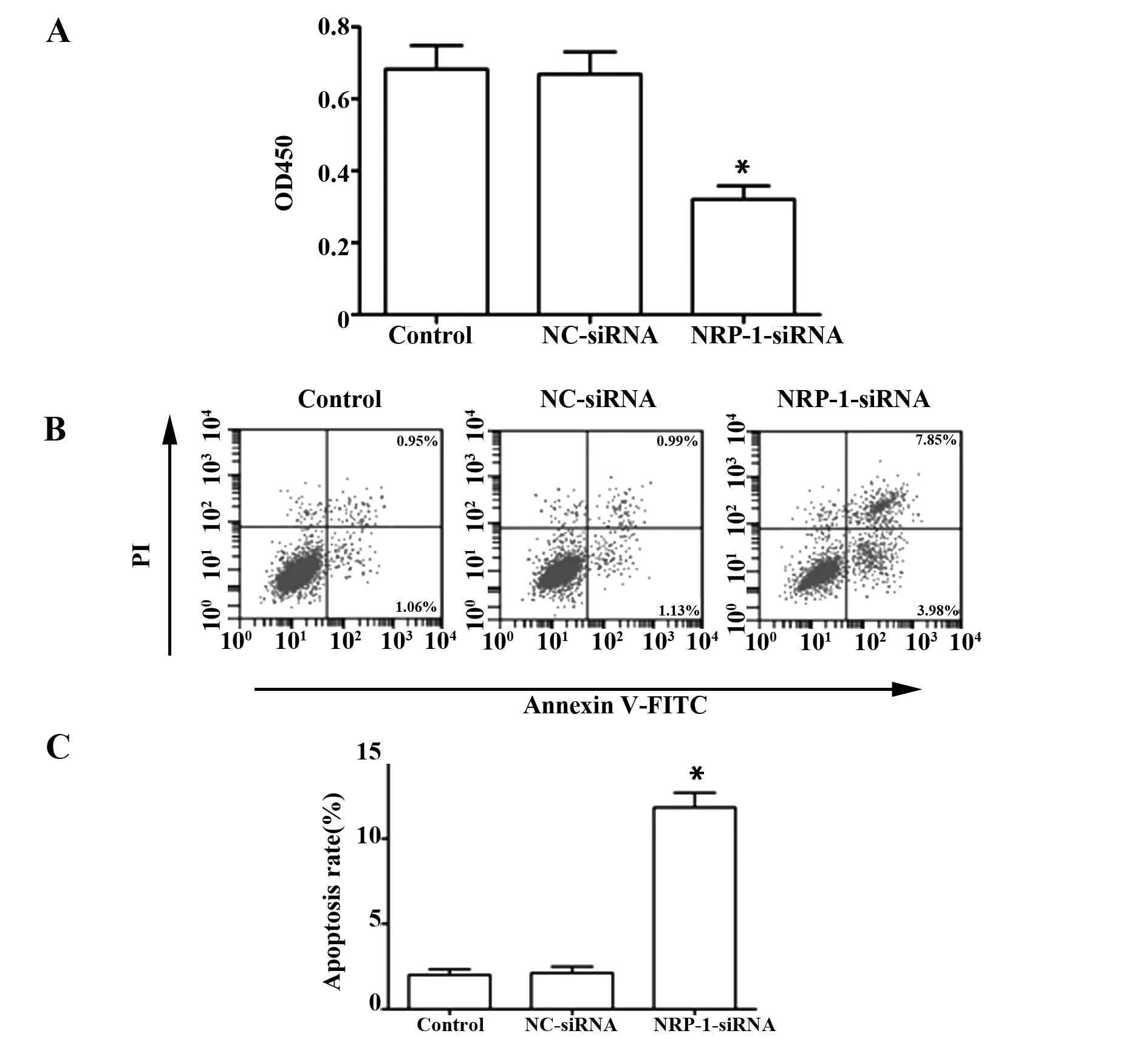
图3 NRP-1-siRNA转染对CaSki细胞活力及细胞凋亡的影响Fig.3 Effect of NRP-1-siRNA transfection on viability and apoptosis in CaSki cellNote: A.The OD value of each cell;B.The results of cell apoptosis detection in each group;C.Cell apoptosis rate in each group;compared with Control group,*.P<0.05.
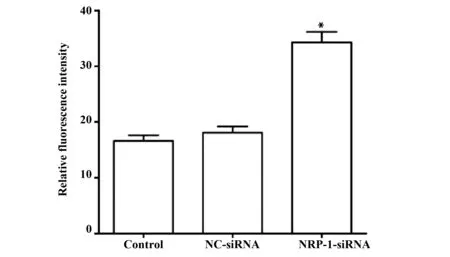
图4 NRP-1-siRNA转染对CaSki细胞ROS含量的影响Fig.4 Effect of NRP-1-siRNA transfection on the content of ROS in CaSki cellsNote: Compared with the Control group,*.P<0.05.
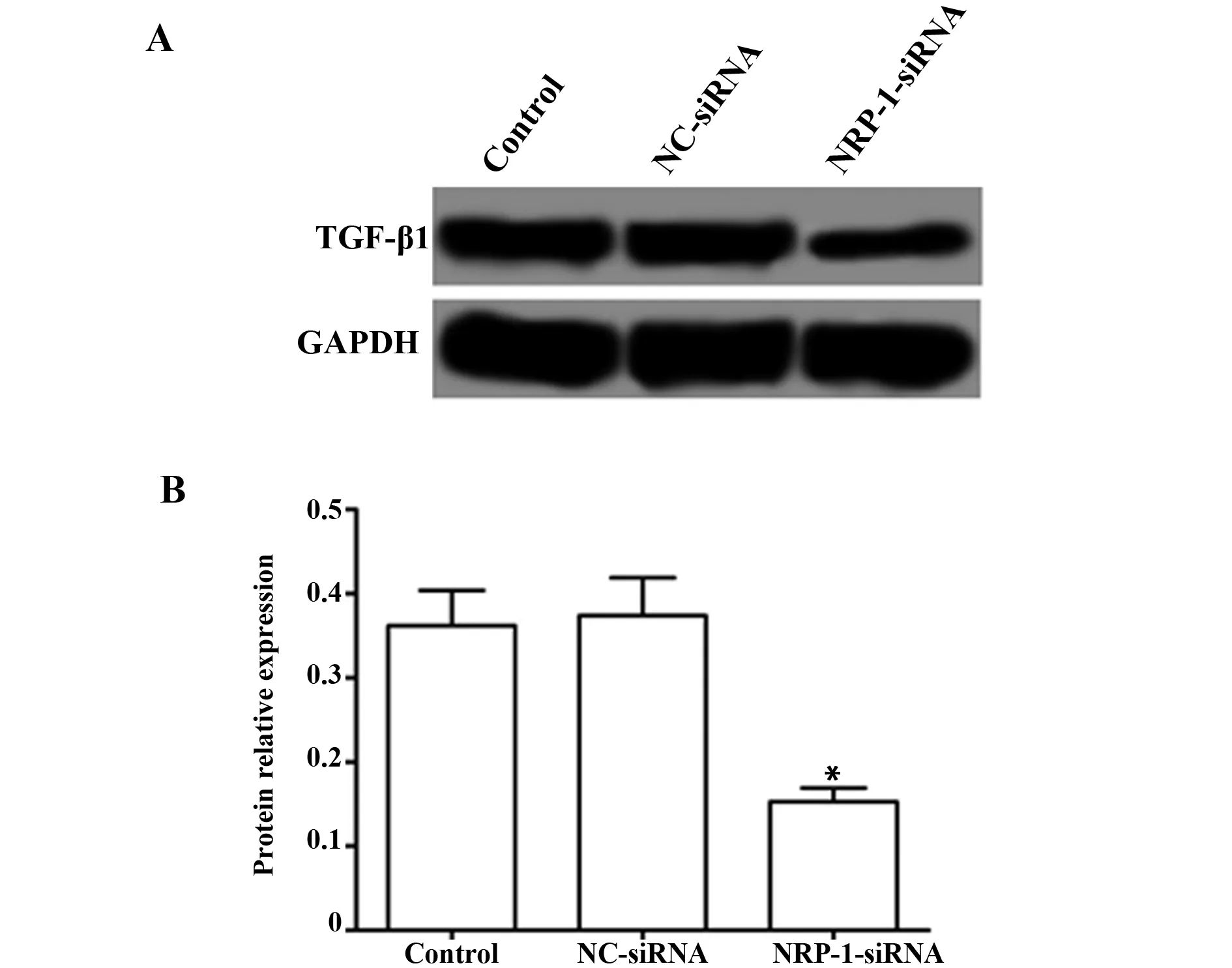
图5 NRP-1-siRNA转染对CaSki细胞免疫抑制因子TGF-β1表达的影响Fig.5 Effect of NRP-1-siRNA transfection on the expression of immunosuppressive factor TGF-β1 in CaSki cellNote: A.Western blot was used to detect the protein expression of TGF-β1;B.The relative expression of TGF-β1 protein;compared with the Control group,*.P<0.05.
2.6NRP-1-siRNA转染下调Wnt信号通路表达 Western blot检测Wnt信号通路相关蛋白Wnt1、β-catenin、Survivin、Cyclin D1的蛋白表达,结果如图6所示,Control组、NC-siRNA组和NRP-1-siRNA组Wnt1的蛋白表达分别为(0.756±0.075)、(0.773±0.072)、(0.192±0.023),β-catenin的蛋白表达分别为(0.342±0.034)、(0.359±0.036)、(0.123±0.015),Survivin的蛋白表达分别为(0.187±0.021)、(0.177±0.020)、(0.103±0.013),Cyclin D1的蛋白表达分别为(0.211±0.018)、(0.205±0.019)、(0.148±0.013),与对照组比较,NRP-1-siRNA组Wnt1、β-catenin、Survivin、Cyclin D1的蛋白表达均显著降低(P<0.05)。
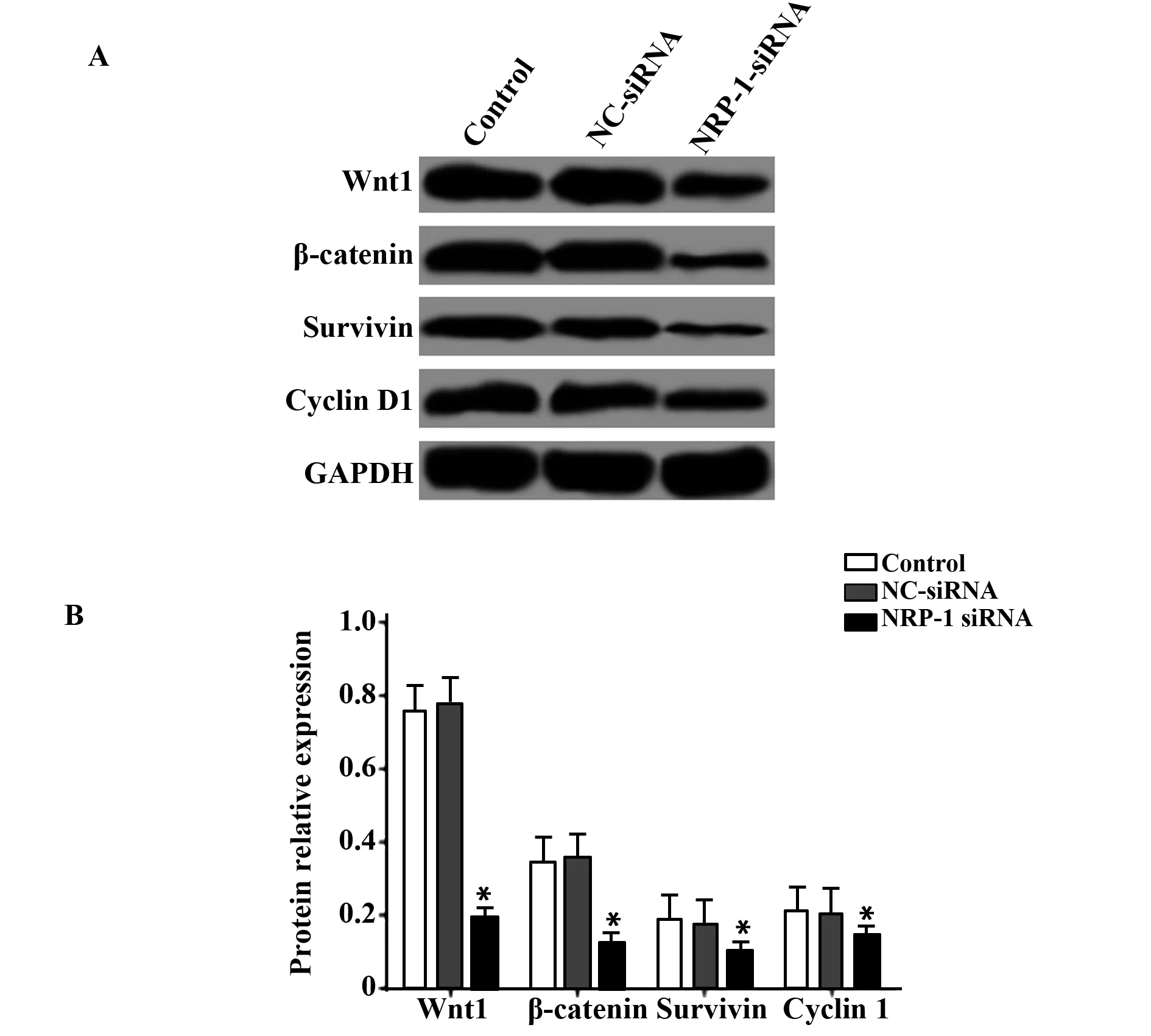
图6 NRP-1-siRNA转染对Wnt信号通路的影响Fig.6 Effect of NRP-1-siRNA transfection on Wnt signaling pathwayNote: A.Western blot was used to detect the expression of Wnt signaling pathway protein;B.The relative expression of Wnt signaling pathway protein;compared with Control group,*.P<0.05.
3 讨论
RNA干扰技术是一种能有效沉默基因表达的方法,具有高度特异性、高效性及浓度和时间依赖性等特点,较其他传统的基因沉默方法有着更多的优势,目前已成为基因治疗、基因功能研究的一个重要工具[9-11]。在基因治疗宫颈癌的研究中,采用RNA干扰技术特异的抑制一些原癌基因的表达可有效降低宫颈癌的发生发展[12,13]。NRP-1基因有广泛的表达,在几乎人类所有的恶性肿瘤组织中有表达,既可以在肿瘤细胞上直接分布,也可在肿瘤血管内皮细胞上分布,在多种肿瘤中出现过表达,其过表达可增加肿瘤的发生发展,而也有研究发现通过RNA干扰技术抑制NRP-1的表达可降低肿瘤的发生发展[14,15]。乳腺癌中通过RNA干扰技术抑制NRP-1的表达可降低癌细胞的增殖和诱导细胞凋亡,并提高其对表柔比星的敏感性,而过表达反之;RNA干扰沉默脑胶质瘤中NRP-1的表达后可抑制细胞增殖,促进细胞凋亡和阻滞细胞周期[16]。NRP-1对宫颈癌的影响研究尚未清楚。有研究显示,宫颈癌中NRP1的表达升高,其高表达与淋巴结转移与临床分期有关[7]。因此本试验旨在研究NRP1对宫颈癌细胞生物学特性的影响。
本研究首先检测不同宫颈癌细胞中NRP1的表达,发现CaSki细胞中NRP1的表达最高,因此选择其作为研究对象,通过RNA干扰技术抑制CaSki细胞NRP1的表达,发现NRP1-siRNA组NRP1的表达明显降低,说明可用于后续实验研究。CCK8法及流式细胞仪检测的结果发现,NRP1-siRNA组细胞活力明显降低,凋亡率升高。人体正常情况下,ROS产生与清除处于动态平衡,而一些病理因素,可打破其平衡,导致氧化应激的出现,多项研究表明,ROS产生与多种肿瘤细胞生长密切相关[17-20]。本研究的结果提示抑制宫颈癌中NRP1的表达可通过提高ROS含量诱导细胞凋亡。Wnt信号通路是一类保守的信号通路,目前Wnt信号经典通路Wnt/β-catenin及下游的靶基因成为研究热点。当Wnt被过度激活时可引起β-catenin大量积聚在细胞质内,可引起Survivin、Cyclin D1等下游与肿瘤相关靶基因的激活,从而导致癌细胞发生增殖过度,进而引起肿瘤的发生[21,22]。多项研究显示,宫颈癌、肾癌等多种肿瘤中Wnt信号被激活,可促进其发生发展,而通过Wnt信号通路抑制剂抑制其表达可降低肿瘤的发生发展[23,24]。TGF-β在机体正常发育及肿瘤发生中有重要作用,有研究发现,TGF-β1具有重要的免疫抑制作用,其在宫颈癌中的大量分泌可逃脱免疫反应的攻击[25]。宫颈癌中TGF-β1的表达升高,Wnt信号通路可通过促进TGF-β的表达而促进肿瘤血管生成,从而促进肿瘤发生发展[26]。本研究结果显示,抑制宫颈癌NRP1的表达可降低Wnt信号通路Wnt1、β-catenin和下游靶基因Survivin、Cyclin D1及TGF-β1的表达。这提示NRP1可通过下调Wnt信号通路降低宫颈癌的发生发展。
综上所述,抑制宫颈癌中NRP-1基因表达可降低癌细胞活力,诱导细胞凋亡,降低免疫抑制分子TGF-β1表达,其机制与提高细胞ROS水平和下调Wnt信号通路有关。该研究提示NRP-1可能对宫颈癌的防治具有一定的价值,但需更多的研究及临床试验作为支撑。

