转移性肾癌中PD-1与Treg的表达及其预后预测价值*
姚家喜 秦玉洁 单永玮 魏小义 牛世杰 胡骁轶 郭剑明
肾细胞癌约占人类恶性肿瘤的3%,转移性肾癌(metastatic renal cell carcinoma,mRCC)的5年生存率低于10%[1]。以酪氨酸激酶抑制剂(tyrosine kinase in⁃hibitors,TKI)为代表的靶向药物出现为mRCC患者的治疗带来新的选择,但最终仍有部分患者因耐药导致疾病进展直至死亡[2]。因此,对于mRCC的新型治疗方法的研究从未停止,其中有针对性的免疫治疗效果显著[3]。程序性死亡受体-1(programmed cell death protein-1,PD-1)广泛表达于人体内各种细胞中,主要在肿瘤浸润性细胞毒性淋巴细胞(cytotoxic lymphocyte,CTL)中表达,与肿瘤细胞表面的程序性死亡受体配体1(programmed cell death protein-ligand 1,PD-L1)结合,起到调控T细胞活性、抑制T细胞对肿瘤的杀伤作用[4]。因此,PD-1阳性淋巴细胞可能参与肿瘤细胞的免疫逃避。但在肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)中,免疫组织化学法检测并未证实ccRCC组织中的PD-1表达与临床预后相关[5]。调节性T细胞(regulatory T cell,Treg)是一群免疫细胞,可以抑制自身免疫反应及抑制自身CTL的抗肿瘤效应[6]。研究显示,肿瘤内浸润的Treg细胞数量与弥漫性大B细胞淋巴瘤预后不良有关[7]。本研究旨在评估肿瘤内浸润的PD-1阳性淋巴细胞及Treg细胞与行TKI治疗的mRCC患者的临床病理资料及预后的关系,为临床治疗mRCC的预后判断提供帮助。
1 材料与方法
1.1 病例资料
收集2007年6月至2017年6月269例复旦大学附属中山医院mRCC患者的临床病理资料,其中男性195例、女性74例,年龄为14~87岁,中位年龄为57岁。术后病理或穿刺活检均证实转移,转移部位为肺脏、骨、肝脏、脑等,切除的原发病灶标本用于本研究。对病例均重新进行TNM分期评估,根据国际泌尿病理协会(ISUP)对Fuhrman分级重新定义[8-9]。本研究获得复旦大学附属中山医院伦理委员会批准与患者知情同意。
1.2 方法
1.2.1 免疫组织化学法检测 免疫组织化学法检测mRCC患者组织中的PD-1和Treg表达。于EDTA缓冲液中使用高压抗原修复方法处理组织切片10 min。FoxP3(检测Treg细胞)和PD-1抗体均购自艾博抗上海贸易有限公司,稀释比例为1:100,一抗4℃孵育过夜,37℃温箱孵育二抗,DAB显色、苏木精复染。
1.2.2 结果判断 评估每例肿瘤浸润的Treg细胞和PD-1阳性细胞的数量。PD-1阳性细胞主要为肿瘤间质淋巴细胞,先观察整张切片(×100倍),随后随机选择5个高倍视野(×400倍),求其平均值作为该病例PD-1阳性细胞数。根据PD-1阳性细胞在肿瘤组织中分布的多少分为阳性、阴性表达组。Treg细胞以同样方法进行计数,分为高表达、低表达组。
1.2.3 随访 所有患者均有完整的随访资料,随访截至2017年6月。总生存(overall survival,OS)期的计算从手术日期至随访截止日期,或死亡日期;无进展生存(progression-free survival,PFS)期的计算从手术日期至随访截止日期,或疾病进展日期。
1.3 统计学分析
采用SPSS 21.0软件进行统计学分析。计量资料不同组间比较采用t检验,计数资料不同组间比较采用χ2检验,生存率的组间比较采用Kaplan-Meier生存曲线法及Log-rank检验。单因素和多因素Cox比例风险回归分析进行评估Treg和PD-1与生存的关系。以P<0.05为差异具有统计学意义。
2 结果
2.1 PD-1和Treg与mRCC患者临床病理特征的关系
PD-1主要在细胞的细胞膜及细胞质中表达,Treg细胞主要在肿瘤间质中散在分布(图1)。269例mRCC患者组织中PD-1阳性表达为85例,Treg高表达为99例。PD-1阳性表达与患者Fuhrman分级相关(P=0.004),Treg高表达与患者性别(P=0.004)、Fuhrman分级(P=0.011)显著相关(表1)。
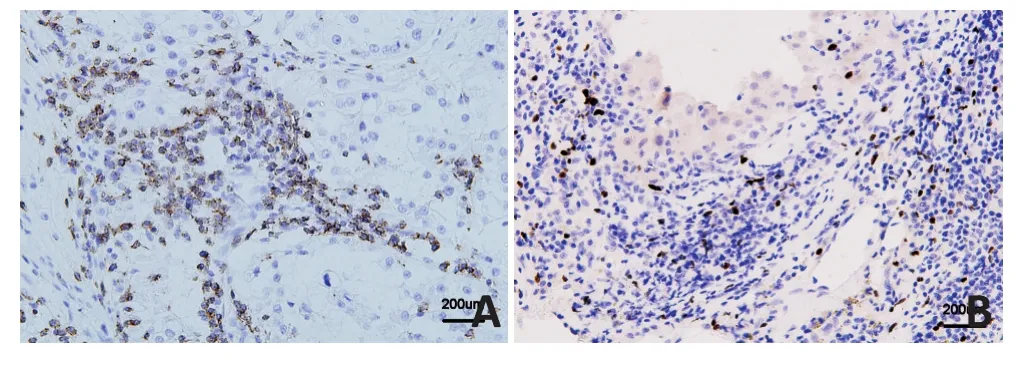
图1 免疫组织化学法检测mRCC患者组织中PD-1和Treg表达(DAB染色×200)
2.2 PD-1和Treg与mRCC患者术后生存的关系
269例mRCC患者的Kaplan-Meier生存分析显示,mRCC患者组织中PD-1和Treg浸润的数量与患者生存相关,PD-1阳性与Treg高表达患者的OS(P=0.017 9与P=0.005 4)及PFS(P=0.019 2与P=0.044 2)更低(图2)。PD-1联合Treg(PD-1/Treg)评估mRCC患者的预后显示,PD-1阳性/Treg高表达的患者的中位OS及PFS分别为23.5、10.0个月,预后最差;PD-1阴性/Treg低表达患者的中位OS及PFS分别为51.0、21.0个月,预后最佳(图3)。
2.3 mRCC患者与PD-1和Treg表达关系的单因素和多因素Cox比例风险回归分析
单因素分析显示,Treg、PD-1、TNM分期、Fuhrman分级、肺转移、IMDC与OS显著相关;Treg、PD-1、TNM分期、性别、肺转移、IMDC与PFS显著相关。将上述单因素有意义变量纳入多因素Cox比例风险回归分析,TNM分期、肺转移、IMDC和PD-1/Treg是mRCC患者OS的独立预后因素;TNM分期、IMDC和PD-1/Treg是mRCC患者PFS的独立预后因素。PD-1阳性/Treg高表达患者的OS相对危险度上升2.474倍(P=0.001),PFS相对危险度上升2.065倍(P=0.002),见表2。
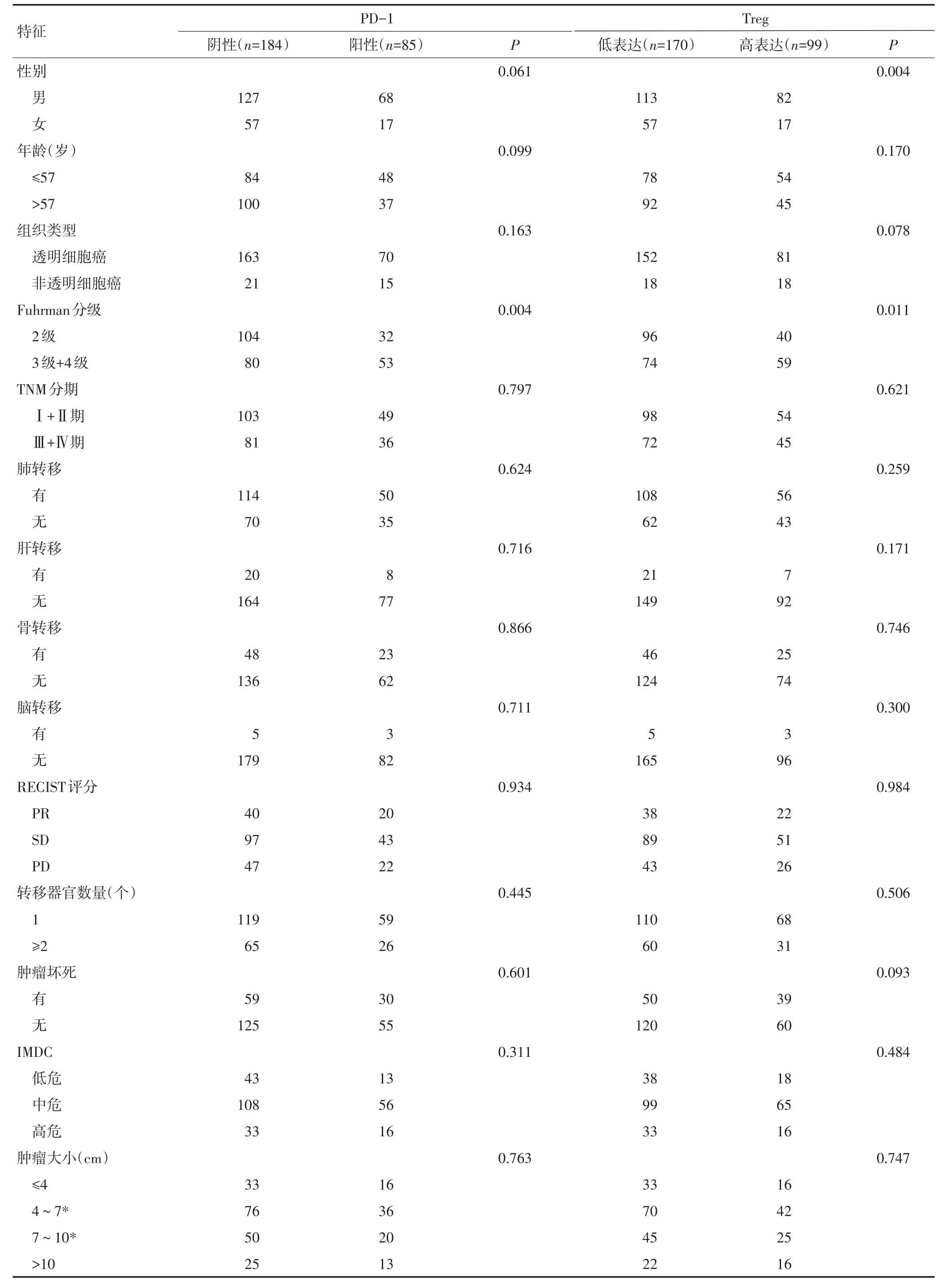
表1 269例患者临床病理特征与PD-1和Treg表达的关系
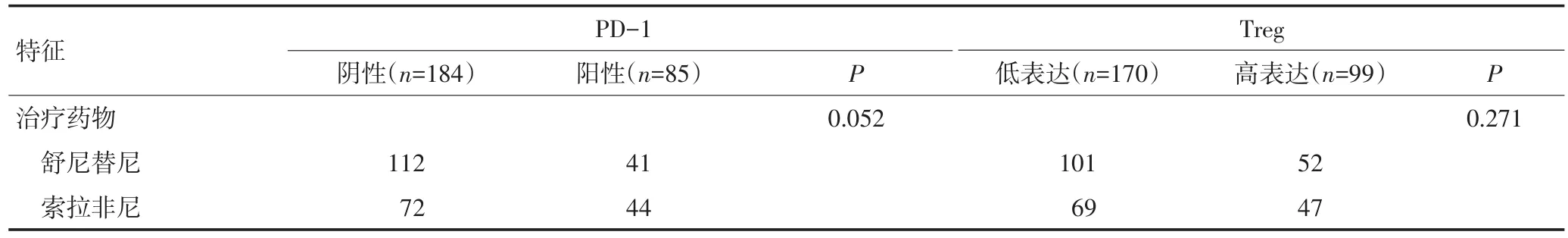
表1 269例患者临床病理特征与PD-1和Treg表达的关系(续表1)
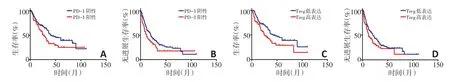
图2 mRCC患者术后OS和PFS与PD-1和Treg表达的关系
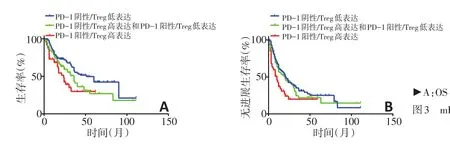
图3 mRCC患者术后OS和PFS与PD-1/Treg表达的关系
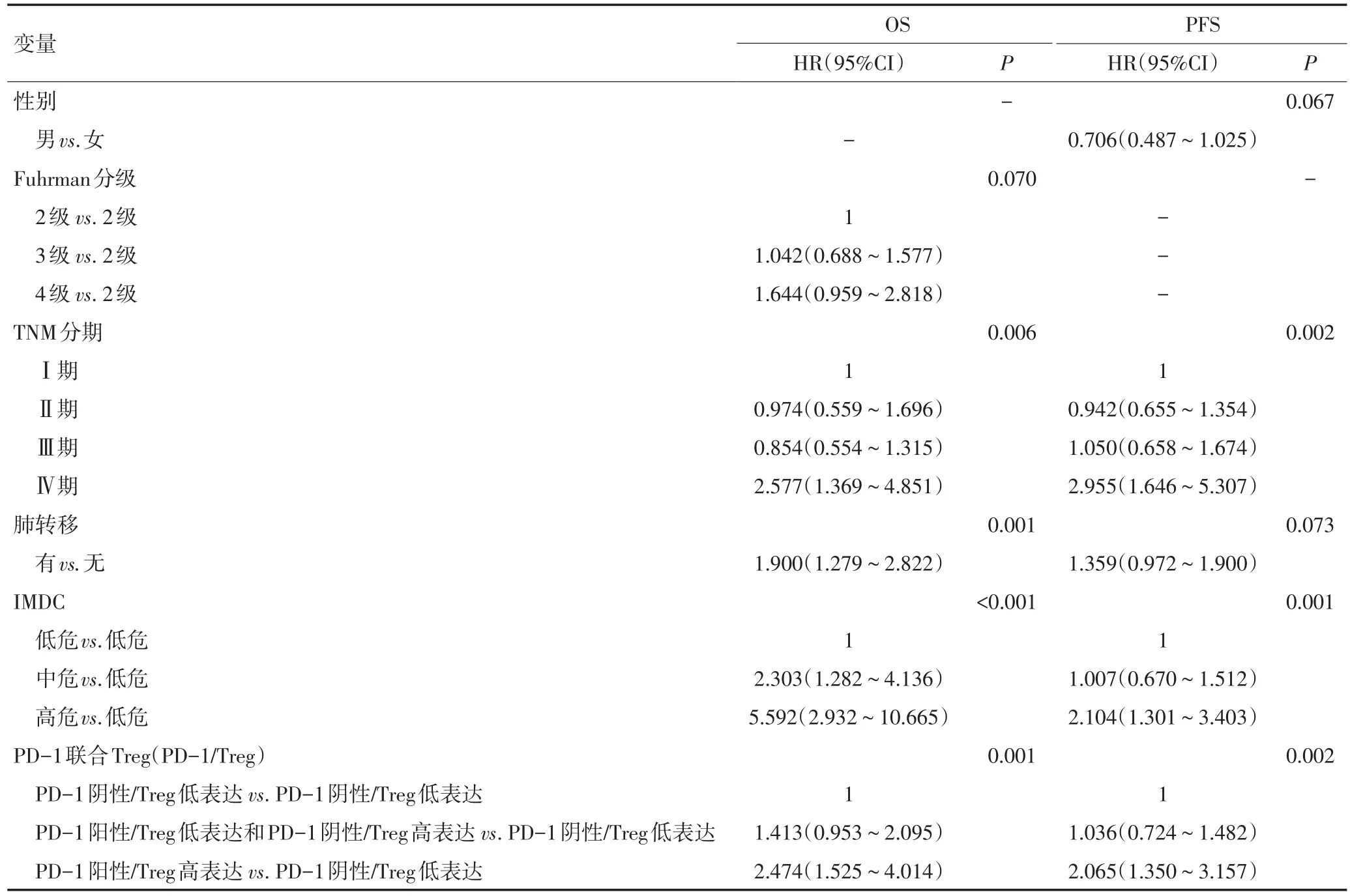
表2 多因素Cox比例风险回归分析各指标与mRCC患者OS及PFS之间的关系
3 讨论
本研究发现,肿瘤内浸润性PD-1及Treg对mRCC预后有独立预测作用。PD-1表达和Treg细胞浸润数量是mRCC患者OS和PFS的独立预测因子,提示PD-1/Treg可作为mRCC患者的预后指标。纳武单抗(nivolumab)与依维莫司对比的临床试验数据分析显示,在既往使用舒尼替尼的患者中,二线治疗使用nivolumab与依维莫司的中位OS分别为23.6、19.8个月;既往使用帕唑帕尼的患者中,二线治疗使用nivolumab与依维莫司的中位PFS分别为15.6、11.7个月[10-11]。因此,相比TKI靶向药物,PD-1靶向免疫治疗可能具有更好的应用价值及疗效,免疫治疗在mRCC中显示出巨大潜力。
本研究发现,PD-1及Treg均与mRCC不良预后指标(Fuhrman分级)显著相关,生存分析显示Treg高表达预示mRCC的OS和PFS较短。Whiteside等[12]研究表明,肿瘤内浸润性Treg高表达与各种恶性肿瘤的预后不良有关。该研究发现,肾细胞癌(renal cell carcinoma,RCC)患者外周血中Treg细胞数量高于健康人,治愈性切除肿瘤后,外周血中Treg细胞数量降至正常水平。同时该研究表明,肿瘤相关因子可能参与Treg的浸润聚集,但Treg如何参与调节肿瘤微环境的确切机制尚未明确。Treg相关免疫抑制功能可能通过阻断T细胞和抗原呈递细胞的功能来介导。Kim等[5]采用免疫组织化学法对ccRCC患者组织中的PD-1进行检测,并未发现与临床预后相关,可能与研究对象为非mRCC有关,且病例数相对较少。因此本研究针对mRCC组织中的PD-1及Treg表达进行检测,并对其与OS及PFS的关系进行分析,发现Treg浸润与PD-1阳性细胞的浸润显著相关(P<0.001),56.5%(48/85)PD-1阳性患者同时存在Treg高表达。本研究结果表明,PD-1与Treg介导的免疫抑制显著相关,PD-1的阻断和Treg的功能抑制可能是mRCC免疫治疗的一种可选治疗方法。因此,评估mRCC患者组织中PD-1和Treg有助于对预后不良进行判断,以利于尽早干预治疗。mRCC的治疗正发生日新月异的变化,随着近几年多种药物通过FDA批准快速上市,以及免疫治疗兴起,以nivolumab和派姆单抗(pembrolizumab)及伊匹单抗(ipilimumab)为代表的免疫治疗药物在恶性肿瘤患者中广泛应用。nivolumab已被批准用于TKI治疗失败后的二线治疗,以及联合ipilimumab治疗先前未行药物治疗的中高危的晚期RCC患者。正在开展的临床试验可能会加快一线治疗中nivolumab单药的使用,或联合TKI药物治疗的审批早日通过。
综上所述,本研究表明mRCC肿瘤内PD-1及Treg浸润为不良预后指标,PD-1阳性/Treg高表达患者的OS及PFS较PD-1阴性/Treg低表达者差,对预测mRCC的预后具有良好价值。因此,评估mRCC患者肿瘤组织中PD-1表达和Treg细胞的浸润有助于选择合适患者进行有效的免疫治疗,尽早对临床上预后不良的患者进行早期干预治疗。

