黄芪甲苷对脑缺血/再灌注损伤大鼠细胞自噬的影响*
李 媛, 靳晓飞, 周晓红, 高维娟△
(1承德医学院病理生理学教研室, 河北 承德 067000; 2河北中医学院, 河北省心脑血管病中医药防治重点实验室, 河北 石家庄 050200)
缺血性脑血管病可导致严重的认知和运动障碍、神经退行性疾病甚至急性死亡[1]。组织纤溶酶原激活剂(tissue plasminogen activator,tPA)是目前美国食品药品监督管理局批准的治疗急性脑缺血的唯一疗法,然而,tPA治疗严格的3 h时间窗是急性静脉溶栓的主要障碍[2]。因此,识别并探索新的治疗靶点成为该领域的主要任务和挑战。细胞自噬广泛存在于真核生物中,是决定细胞命运的主要机制。自噬不仅在许多生理过程如细胞增殖、分化与衰老中扮演着重要角色,在病理条件下也发挥着重要的作用,其中包括神经退行性疾病、糖尿病、肿瘤和脑血管疾病等[3]。虽然自噬参与脑缺血这一过程是无可争议的,但关于自噬在脑缺血疾病中确切的功能和影响尚未达成共识。本课题组一直致力于中医药对脑血管疾病的防治,传统中药黄芪具有抗炎、抗纤维化和抗氧化应激等功效,黄芪甲苷(astragaloside Ⅳ, AS-Ⅳ)为其主要的活性成分之一。在缺氧缺糖/复氧复糖PC12细胞的离体实验研究中,我们观察到黄芪甲苷可通过激活自噬抑制细胞凋亡[4],在脑缺血/再灌注(ischemia/reperfusion,I/R)损伤动物模型中,黄芪甲苷是否也能通过对自噬的调节达到神经保护作用?这将为我们研究治疗脑血管病提供新的思路。
材 料 和 方 法
1 材料
1.1动物 清洁级健康雄性SD大鼠70只,体重250~280 g,购自北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2016-0011。
1.2主要试剂和仪器 氯化2,3,5-三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC; Sigma, T8877);兔抗大鼠beclin-1单克隆抗体(Abcam, ab207612);兔抗大鼠微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)多克隆抗体(赛维尔生物科技有限公司, GB11124);甲苯胺蓝溶液和水合氯醛(北京索莱宝生物科技有限公司);大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)线栓(北京西浓生物科技有限公司);黄芪甲苷(南京森贝伽生物科技有限公司,每瓶100 mg,纯度≥98%,生产批号 170302);3-甲基腺嘌呤(3-methyladenine,3-MA; Sigma, 124M4071V);雷帕霉素(rapamycin,Rapa; 北京索莱宝生物科技有限公司, 104C0311);其它试剂为国产分析纯。EG11508型组织包埋机、RM2255型全自动轮转切片机和DMI3000B型光学显微镜(Leica);H-7650型透射电子显微镜(Hitachi)。
2 方法
2.1动物分组与造模 SD大鼠随机分为7组:假手术(sham)组、脑缺血/再灌注(I/R)组、溶剂对照(solvent)组、黄芪甲苷(AS-IV)组、黄芪甲苷+自噬抑制剂(AS-IV+3-MA)组、自噬抑制剂(3-MA)组和自噬激活剂(Rapa)组。采用线栓法建立大鼠局灶性脑缺血/再灌注损伤模型:SD大鼠于造模前适应性饲养1周,手术前12 h禁食,4 h禁水。大鼠腹腔注射麻醉剂10%水合氯醛(3.5 mL/kg)后,仰卧位固定在手术台上。颈部备皮、消毒,采用正中切口并逐层分离颈部左侧肌肉组织,充分暴露左侧颈总动脉(common carotid artery,CCA)、颈内动脉(internal carotid artery,ICA)和颈外动脉(external carotid artery,ECA)。结扎并离断ECA,选取合适的线栓由ECA残端进入,经ICA到达大脑中动脉,并阻塞大脑中动脉血流,造成大脑局灶性缺血[5]。缺血2 h后缓慢地拔出线栓至ECA残端,使血流通畅,实现再灌注。Sham组线栓由ECA残端进入ICA,但不阻塞大脑中动脉。AS-IV组与AS-IV+3-MA组于再灌注的同时给予黄芪甲苷20 mg/kg,黄芪甲苷粉末由二甲基亚砜(dimethyl sulfoxide,DMSO)溶解后,加生理盐水稀释配成终浓度为1 g/L溶液[6]; solvent组给予相同配比的DMSO生理盐水稀释液;AS-IV+3-MA组与3-MA组于术前30 min给予自噬抑制剂3-MA (2 mg/kg),3-MA粉末由生理盐水水浴70 ℃加热溶解为终浓度0.3 g/L溶液;Rapa组于术前30 min给予自噬激活剂Rapa (5 mg/kg),Rapa粉末由生理盐水超声振荡溶解为终浓度1 g/L溶液。各组分别于再灌注24 h后处死取材。
2.2神经功能学评分 取材前根据Zea Longa评分标准进行神经功能学评分: 无神经缺损症状为0分;不能完全伸展右侧前爪为1分;行走向右侧转圈为2分;行走向右侧倾倒为3分;不能自发行走,意识丧失为4分。将0分、4分和死亡者剔除,1~3分者列为实验对象。
2.3TTC染色测定大鼠脑梗死体积 处死大鼠后,迅速取出完整的脑组织置于-20 ℃冰箱中冰冻15 min,随之行冠状位切片,每片厚度约为2 mm。将脑片置于配好的2 % TTC染液中,37 ℃恒温箱避光孵育30 min,PBS终止染色,4%多聚甲醛固定液中固定,相机拍照,采用Image-Pro Plus 6.0图像分析系统计算脑梗死体积。
2.4尼氏染色观察神经细胞形态 将新鲜脑组织置于4%多聚甲醛固定液中固定,流水冲洗,梯度乙醇脱水,二甲苯溶液透明,石蜡包埋、切片。选取合适的位置切片,依次经二甲苯溶液、梯度乙醇脱蜡至水,浸入1%甲苯胺蓝水溶液中50 ℃恒温孵育40 min。蒸馏水冲洗,95%乙醇分色,脱水、透明、中性树胶封片,光学显微镜下观察、拍照。
2.5透射电子显微镜观察自噬体 取缺血侧体积大小为1 mm×1 mm×1 mm脑组织数块,迅速置于预冷的4%戊二醛溶液中固定4 h,PBS清洗后转入1%锇酸中固定2 h。依次浸入梯度丙酮溶液中脱水,纯丙酮与包埋剂1∶1混合液中浸透1 h、纯丙酮与包埋剂1∶3混合液中浸透3 h、纯包埋剂浸透5 h,37 ℃温箱聚合12 h,60 ℃温箱聚合48 h。经半薄切片选区后行超薄切片,醋酸铀和柠檬酸铅双重电子染色,在透射电子显微镜下观察细胞自噬体的形成。
2.6Western bolt检测beclin-1和LC3-Ⅱ的蛋白表达水平 取缺血侧脑组织50 mg剪碎,加入1 mL细胞裂解液匀浆30 min,12 000×g离心5 min取上清获得总蛋白,BCA法测定蛋白浓度。调整蛋白浓度后加上样缓冲液,煮沸变性5 min。采用SDS-PAGE分离蛋白,半干电转移法将蛋白转移到PVDF膜上,5%脱脂奶粉封闭2 h,加入Ⅰ 抗beclin-1(1∶2 000)、LC3(1∶2 000)和β-actin(1∶2 000),4 ℃孵育过夜。TBST洗膜液洗涤,加入Ⅱ抗(1∶3 000)室温孵育1 h,TBST洗涤后用ECL化学发光法显色,ImageJ软件分析测量灰度值,以beclin-1与β-actin的比值和LC3-Ⅱ与LC3-Ⅰ比值为蛋白相对表达水平。
3 统计学处理
采用SPSS 19.0软件进行统计分析。实验数据以均值±标准差(mean±SD)表示,多组间比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
结 果
1 各组脑梗死体积的变化
Sham组未见梗死灶,其它各组均有不同程度的梗死灶形成。与I/R组相比,AS-IV组和Rapa组脑梗死体积减小(P<0.05),3-MA组梗死体积略有增大(P<0.05),solvent组则无明显变化。与AS-IV组相比,AS-IV+3-MA组和3-MA组梗死体积有所增大(P<0.05),见图1。
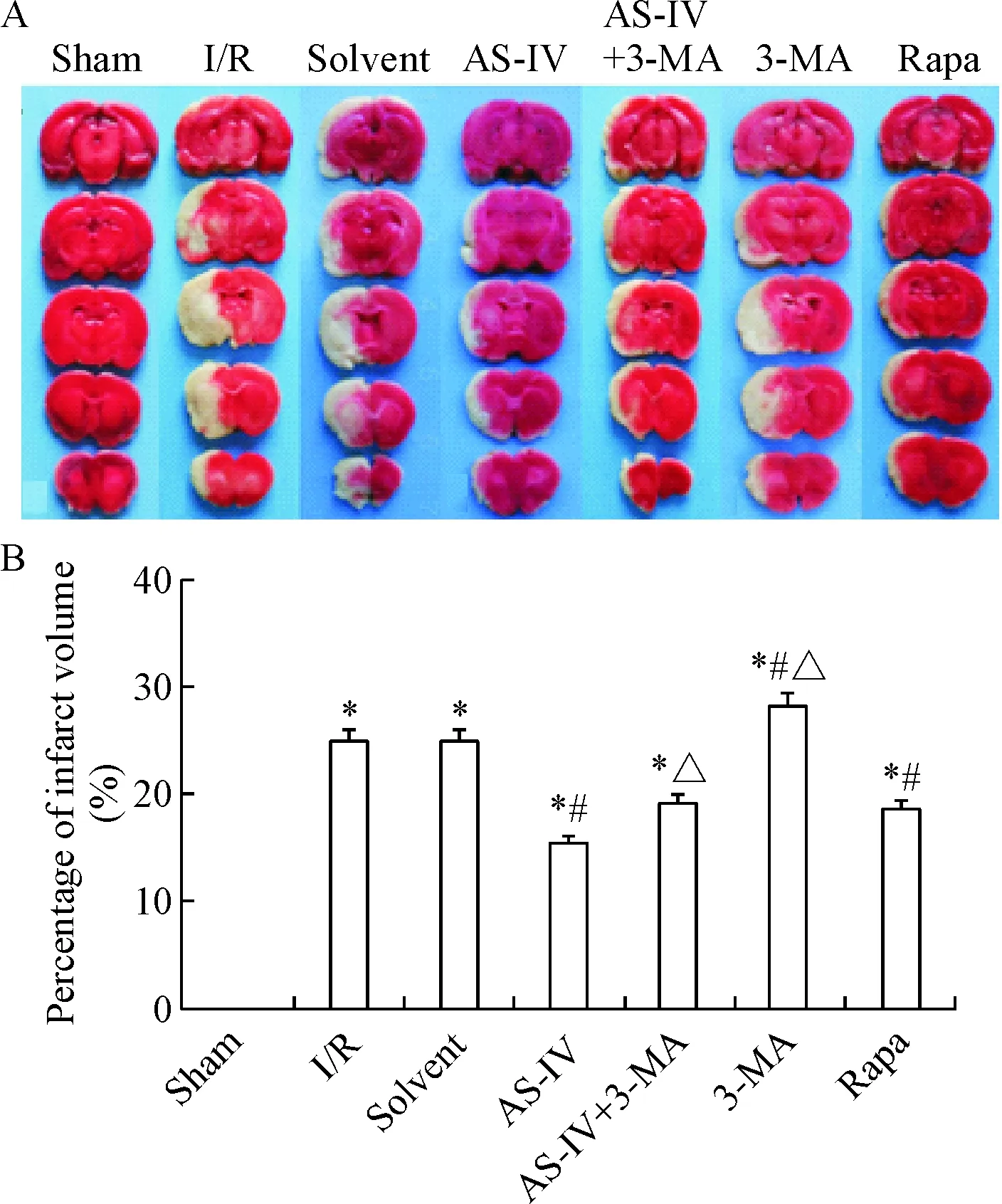
Figure 1.The changes of infarct volume with different treatments examined by TTC staining. A: the photographs of brain sections with TTC staining; B: the percentage of infarct volume. Mean±SD. n=6. *P<0.05 vs sham group; #P<0.05 vs I/R group; △ P<0.05 vs AS-IV group.
2 各组缺血侧神经细胞的形态学变化
Sham组的神经细胞排列整齐,核膜、核仁清晰,胞质内布满蓝色颗粒状的尼氏体,无明显神经细胞坏死。与sham组相比,I/R组的神经细胞排列紊乱,形态不规则,核膜、核仁模糊不清,尼氏体数量减少(P<0.05),染色较浅。与I/R组比较,AS-IV组和Rapa组的神经细胞状态有所改善,核膜、核仁较清晰,尼氏体数量增多(P<0.05);3-MA组神经细胞形态不规则,尼氏体数量减少(P<0.05);solvent组则无明显变化。与AS-IV组相比,AS-IV+3-MA组和3-MA组的神经细胞坏死数量增多,尼氏体数量减少、着色较浅(P<0.05),见图2。
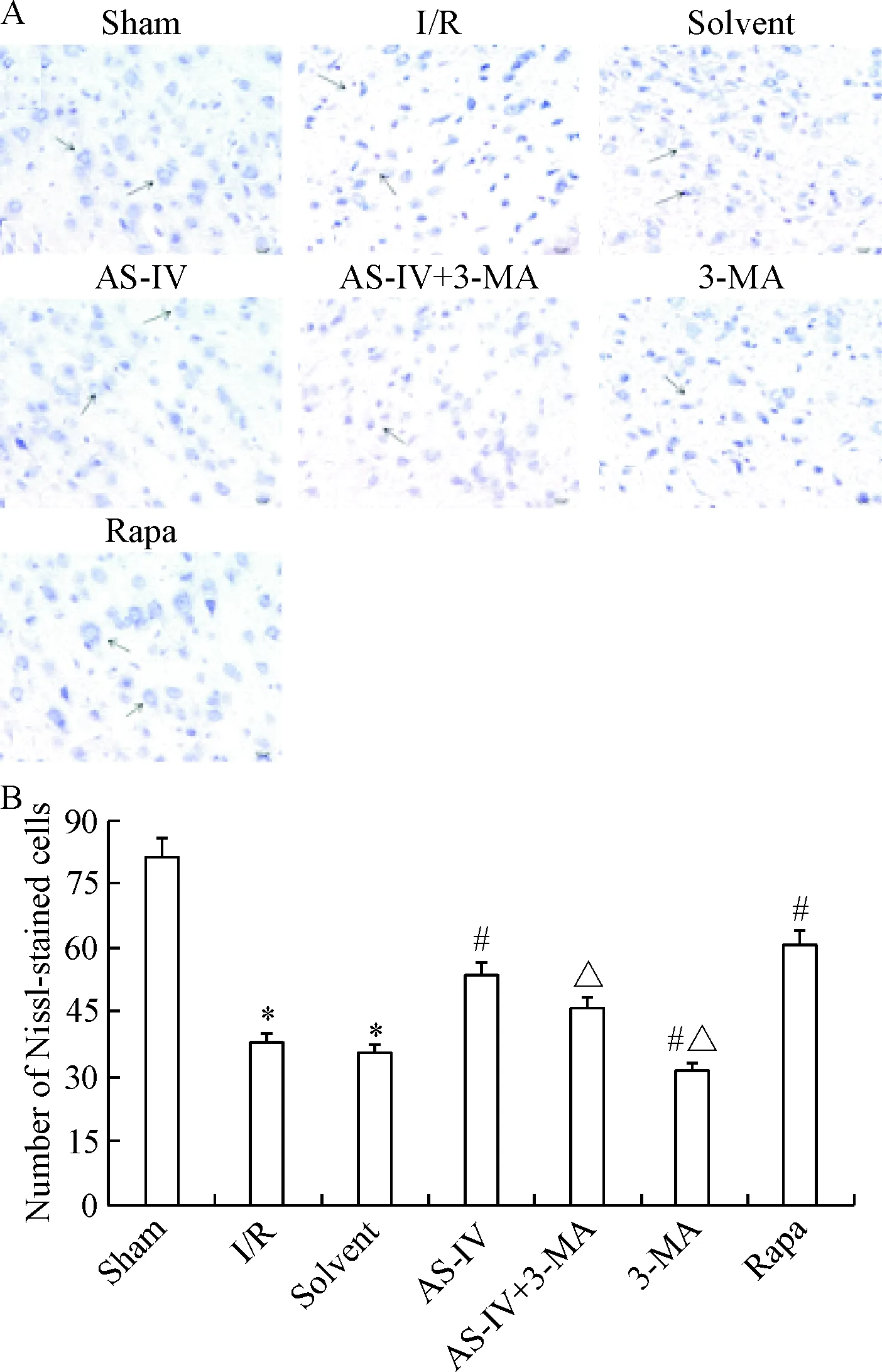
Figure 2.The morphological changes of nerve cells in each group (Nissl staining, ×400). A: the photographs of brain sections with Nissl staining; B: the average numbers of Nissl-stained cells across 5 random visual fields per section were used for the statistical analysis. Mean±SD. n=6. *P<0.05 vs sham group; #P<0.05 vs I/R group; △P<0.05 vs AS-IV group.
3 透射电子显微镜下观察自噬体
Sham组偶见自噬体。I/R组可见典型双层膜结构的自噬体增多(P<0.05)。与I/R组比较,AS-IV组和Rapa组典型自噬体数量增多(P<0.05),可见自噬形成至降解过程中每个阶段的形态;3-MA组典型自噬体数量减少(P<0.05); solvent组则无明显变化。与AS-IV组相比,AS-IV+3-MA组和3-MA组自噬体数量均减少(P<0.05),见图3。

Figure 3.Observation of autophagosomes in all groups by TEM (×200 000). A: the photographs of autophagosomes; B: the quantity of autophagosomes in each square micron. Mean±SD. n=4. *P<0.05 vs sham group; #P<0.05 vs I/R group; △ P<0.05 vs AS-IV group.
4 各组缺血侧脑组织中beclin-1和LC3-Ⅱ蛋白表达量的变化
与sham组相比,I/R组的beclin-1和LC3-Ⅱ蛋白表达明显增多(P<0.05)。与I/R组比较,AS-IV组和Rapa组的beclin-1和LC3-Ⅱ蛋白表达量增多(P<0.05),而3-MA组的表达量减少(P<0.05), solvent组则无明显变化。与AS-IV组比较,AS-IV+3-MA组和3-MA组的蛋白表达量减少(P<0.05),见图4。
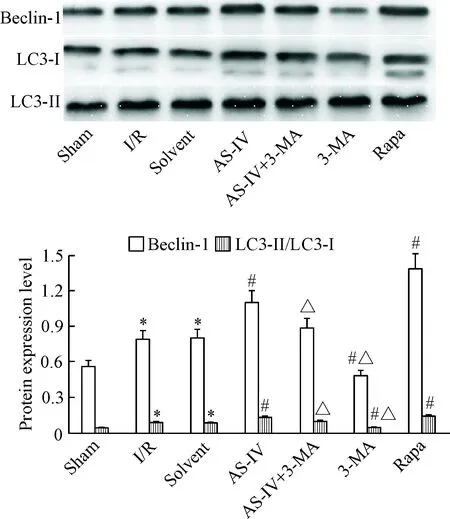
Figure 4.Western blot was used to detect the protein expression of beclin-1 and LC3-II in all groups. Mean±SD. n=4. *P<0.05 vs sham group; #P<0.05 vs I/R group; △P<0.05 vs AS-IV group.
讨 论
细胞自噬是目前生物医学广泛研究的热点之一,它是由溶酶体介导的细胞内成分自我降解的过程。当病原体入侵、细胞内受损衰老的细胞器增多、蛋白质异常聚集等现象发生时,在自噬相关基因(autophagy-associated gene,ATG)的调控下,细胞内囊泡样膜结构延伸包裹细胞内容物,形成自噬体,再与溶酶体融合形成自噬溶酶体。自噬溶酶体可释放蛋白水解酶,将内容物消化降解为小分子物质,为细胞有氧呼吸提供原材料,维持细胞内环境的稳态[7]。一般情况下,细胞自噬处于一个较低的水平,起到持家的作用。当机体处于饥饿、激素失衡和氧化应激等情况时,细胞自噬水平升高,在一定范围内,可通过降解细胞内成分为机体提供能量。Beclin-1是酵母菌ATG6/VSP30在哺乳动物的同源基因,亦是最早被发现的参与自噬调节的关键因子,可诱导自噬相关蛋白定位到自噬体膜上,调控自噬体的形成与成熟。LC3是酵母菌ATG8在哺乳动物的同源基因,在自噬相关蛋白ATG4的作用下脱去羟基生成LC3-Ⅰ,游离于胞质中的LC3-Ⅰ随后在ATG7及ATG3共同作用下与磷脂酰乙醇胺结合酯化形成LC3-Ⅱ,LC3-Ⅱ可定位到自噬体膜上,是自噬体形成的生物学标志[8]。
1995年 Nitatori等[9]采用透射电子显微镜首次证实了脑缺血后神经细胞中自噬现象的发生。近年来,越来越多的证据表明,脑缺血与细胞自噬密切相关10。研究证明,缺氧缺糖/复氧复糖PC12细胞在应用自噬抑制剂后,细胞凋亡程度升高,相反,应用自噬激活剂激活自噬,细胞凋亡程度显著降低[11]。高压氧预处理对脑缺血/再灌注损伤大鼠的神经保护作用部分是通过自噬的激活来完成的,应用自噬抑制剂雷帕霉素可使自噬相关蛋白beclin1和LC3-Ⅱ表达上调,脑梗死体积减小[12]。新生大鼠在缺血缺氧后,应用雷帕霉素亦可减轻神经细胞损伤[13]。Sheng等[14]研究证实,自噬抑制剂3-MA可有效阻断自噬的活性,使LC3-Ⅱ蛋白表达量减少,神经细胞坏死增多,降低了缺血预处理对缺血再灌注损伤脑组织的保护作用。本实验采用线栓法建立大鼠局灶性脑缺血/再灌注模型。脑缺血/再灌注发生后,大量活性氧释放,体内自由基增多,引起氧化应激损伤,通过上调自噬相关蛋白beclin-1和LC3-Ⅱ的表达从而诱导细胞自噬。内质网稳态失衡,导致错误折叠或未折叠的蛋白在内质网内堆积,成为自噬的诱导物,促进自噬现象的发生[15]。在此模型的基础上应用自噬激活剂雷帕霉素后,大鼠行为学表现有所改善,脑梗死体积减小,而应用自噬抑制剂3-MA抑制细胞自噬后,大鼠神经功能障碍严重,脑梗死体积增大,神经细胞坏死增多。研究结果证实自噬在大鼠脑缺血/再灌注损伤中发挥神经保护作用。
传统中药黄芪的应用已有两千多年的历史。黄芪味甘、性温,具有益气固表、敛疮生肌、利水消肿等功效,可应用于全身多个系统疾病的治疗,具有广泛的应用价值。迄今为止,已从黄芪中提取出几十种活性成分,其中主要化学成分为黄芪皂苷、黄芪多糖及黄芪黄酮。黄芪皂苷大多属于四环三萜类,其中活性最好的为黄芪甲苷。黄芪甲苷具有清除氧自由基、抗炎、抗病毒、提高机体免疫力和改善心血管功能等多方面功效[16]。黄芪甲苷可降低脑缺血再灌注大鼠髓过氧化物酶活性,减轻炎症反应[17]。缺氧缺糖/复氧复糖PC12细胞在应用黄芪甲苷后,其凋亡率、凋亡指数显著降低[18],本实验在应用黄芪甲苷后,大鼠无明显的神经功能障碍,脑梗死体积显著减小,在光学显微镜下观察到神经细胞整体状态有所改善。且应用黄芪甲苷后,自噬体明显增多,自噬标志蛋白beclin-1和LC3-Ⅱ表达量明显升高。根据本实验结果推测,黄芪甲苷对脑缺血/再灌注损伤大鼠具有神经保护作用,并且在一定程度上是通过自噬的激活来完成的,自噬的药理激活剂雷帕霉素可以模仿黄芪甲苷的神经保护作用。
自噬参与了脑血管疾病的发生过程这一点毋庸置疑,但自噬在脑血管疾病中发挥的作用仍存在争议。自噬本身具有两面性,持续的应激或自噬相关基因过表达则有可能导致细胞死亡。Yang等[19]在应用参麦注射液治疗脑缺血再灌注损伤的研究中发现,一定程度上抑制细胞自噬可以缓解神经细胞损伤;电针可通过抑制神经细胞自噬达到治疗脑缺血再灌注损伤的作用[20]。关于自噬在脑缺血再灌注损伤中呈现完全不同的作用,猜测其可能原因与缺血再灌注时间、药物等外界刺激相关。若能正确引导自噬使其在疾病中发挥积极作用,这将为脑血管疾病的治疗开启新纪元。

