离子迁移质谱技术及其在脂质分析中的应用
吴邦富,魏 芳,谢 亚,徐淑玲,吕 昕,陈 洪
(中国农业科学院油料作物研究所,农业部油料加工重点实验室,农业部油料作物生物学与遗传育种重点实室,油料脂质化学与营养湖北省重点实验室,湖北 武汉 430062)
脂质是一类具有高度多样性的生物分子,包含多种复杂脂质种类,脂质数据库(LIPIDMAPS)最新数据显示,确定结构的脂质分子(包括计算生成)多达4万多种,这些脂质与其他物质共同构成生命体最基本的结构、具有能量储存以及信号传导等生物功能的分子网络,并与人体的生理健康和代谢状况息息相关,是炎症[1]、癌症[2-3]及内分泌失调[4]等诸多疾病的潜在生物标记物。因此,对生物样本的脂质进行分析具有非常重要的生物学意义。
但脂质结构的多样性以及同类脂质结构的相似性为脂质组学研究中的全脂质分析提出了巨大挑战,传统的脂质分析方法主要分为直接进样(Shotgun mass spectrometry,Shotgun-MS)和液相色谱-质谱联用(LC-MS)方法[5-6],这两种方法可以针对不同样本需求进行较高选择性和灵敏度的脂质分析。然而,与蛋白质或多肽等分子不同,大部分脂质分子的质量分布范围极窄(0~1 000 Da),相同或相近分子质量下存在大量的同分异构体,传统的色谱分离技术很难对其进行分离。因此,为提高生物样本中脂质鉴定的可信度,需建立一种可对脂质异构体进行分离的新技术。
离子迁移质谱技术(Ion mobility mass spectrometry,IM-MS),或离子淌度质谱技术,是一种将离子迁移谱(Ion mobility spectrometry,IMS)与质谱(MS)串联的新型二维技术[7],与传统的色谱-质谱串联技术不同,它是将IMS置于离子源与质量分析器之间,利用电离后离子在迁移谱缓冲气体或电力场中的迁移速率不同对离子进行筛选或分离,进入质谱后再按照质荷比进行分离和鉴定的技术。与单独使用MS相比,IM-MS可以减少气相离子中的干扰信号,从而提高谱图清晰度、峰容量、选择性和灵敏度。此外,这种新型技术还可与传统色谱分离技术相结合,提供多一个维度的分离作用,提高目标检测物的选择性和专一性。近年来,该技术得到了迅猛发展,已被广泛用于蛋白质[8-10]和代谢物[11-12]等生物大分子的分析中,尤其是在异构体物质分离、结构表征以及构象动态学方面展现出强大的应用潜力[13]。本文介绍了几种常见的IMS技术及其结构和原理,对IM-MS联用技术在脂质分析方面的应用进行综述,并对其未来发展方向进行了展望。
1 离子迁移谱与离子迁移质谱技术概述
1.1 离子迁移谱的分类、结构及原理
离子迁移谱是根据离子迁移率不同对离子进行分离的技术,单独的IMS也需配置一个电离源、分离室以及离子检测器[14]。IMS与MS的根本区别在于MS中对离子的分离几乎在真空条件下进行,而IMS则根据离子与缓冲气体的碰撞频率或差分电压实现离子的分离[14]。IMS根据其分离原理和结构可分为不同的类型。
1.1.1漂移时间离子迁移谱漂移时间离子迁移谱(Drift time ion mobility spectrometry,DTIMS)是分离电离离子最传统的设备,其分离室由一系列堆叠的环形电极组成(图1A),沿漂移管轴线产生均匀连续的电场,样品离子通过离子门(每50~200 μs开1次)后形成离子群,然后在电场力作用下通过分离室,而中性气体(主要是氮气、氦气或氩气)的逆流从检测区的一侧引入,与样品离子发生碰撞,不同离子具有不同的碰撞截面(CCS),受到的碰撞力不同,从而到达离子检测器的时间(DT)也不同[7]。在整个分离过程中,样品中的非电离组分被漂移气体移出漂移区。因缓冲气体密度以及电场强度均为静态,且漂移管长度也已知,所以DTIMS可以提供最高精度的离子迁移率测量,具有很高的分析分辨率。但由于离子气体扩散造成的离子损失较大,因此DTIMS的灵敏度较低[15]。
1.1.2行波离子迁移谱行波离子迁移谱(Travelling wave ion mobility spectrometry,TWIMS)与 DTIMS原理类似,但不同于其恒定电场,TWIMS的电场是与离子运行方向平行的交变电场(图1A)。其分离室由一系列叠层环离子导轨组成,然后在相邻环形电极上施加一个反相射频电压(RF),除产生使离子轴向运动的推动力外,还会对离子产生一种径向约束力以减少离子扩散,提高离子的传输效率[15-16]。通过改变移动电压波的速度和大小,可以实现离子的迁移率分离。
1.1.3场不对称离子迁移谱/差分离子迁移谱与前两种IMS分离原理不同,场不对称离子迁移谱(Field asymmetric ion mobility spectrometry,FAIMS),或称为差分离子迁移谱(Differential mobility spectrometry,DMS)通常由两块平行的平板或同轴的圆筒电极组成(图1B),两电极之间施加非对称波形的射频电压。离子除了在气流方向运动外,还在射频电场作用下沿着与载气垂直的方向做上下振荡运动。由于高低场离子迁移率系数的不同,在每个射频电场周期内,离子均会在垂直气流方向上产生一个位移,经过多个周期后离子会在上下极板上湮灭。如果在高频电场上施加匹配的补偿电压(CV),使离子在垂直气流方向上的总位移小于其初始位置到极板的距离,则离子可以通过漂移室到达检测端[15,17]。在FAIMS/DMS中,通常以CV表征不同的离子。由于离子在轴向方向上仅受气流的作用,DMS能够实现正负离子的同时分离和检测。
1.1.4俘获离子迁移谱俘获离子迁移谱(Trapped ion mobility spectrometry,TIMS)的工作原理与传统离子迁移谱相反。TIMS是利用非均匀电场使离子在流动的气体中保持静止状态,此时离子受到的气体漂移力作用被电场力抵消,而离子群依据其尺寸与电荷的比值大小分离[18]。TIMS的通道类似漏斗(图1C),主要由漏斗型入口、迁移率分析区以及漏斗型出口三部分构成。带电离子首先通过漏斗型入口富集后随气流注入迁移率分析区(第一步:离子注入)。离子迁移率分析区由一系列施加RF电压的电极组成,沿轴线方向分布着随距离增大而增大的电场。注入的不同离子在尺寸和所带电荷上存在差异,因此受到的气流漂移力也不同,当电场力增至与离子所受漂移力相同时,则离子在该区域停止,故不同离子会停留在不同的轴向位置(第二步:分离)。当调节电场力减小时,离子群会根据各自尺寸与电荷之比从大到小依次从出口释放,到达检测器(第三步:释放)[15]。虽然TIMS的工作原理与传统DTIMS相反,但其物理原理相同。因此,前述的CCS同样适用于TIMS[18]。
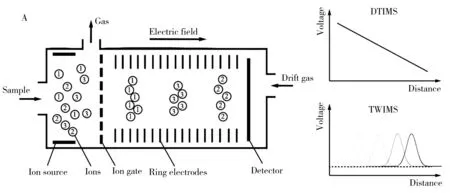
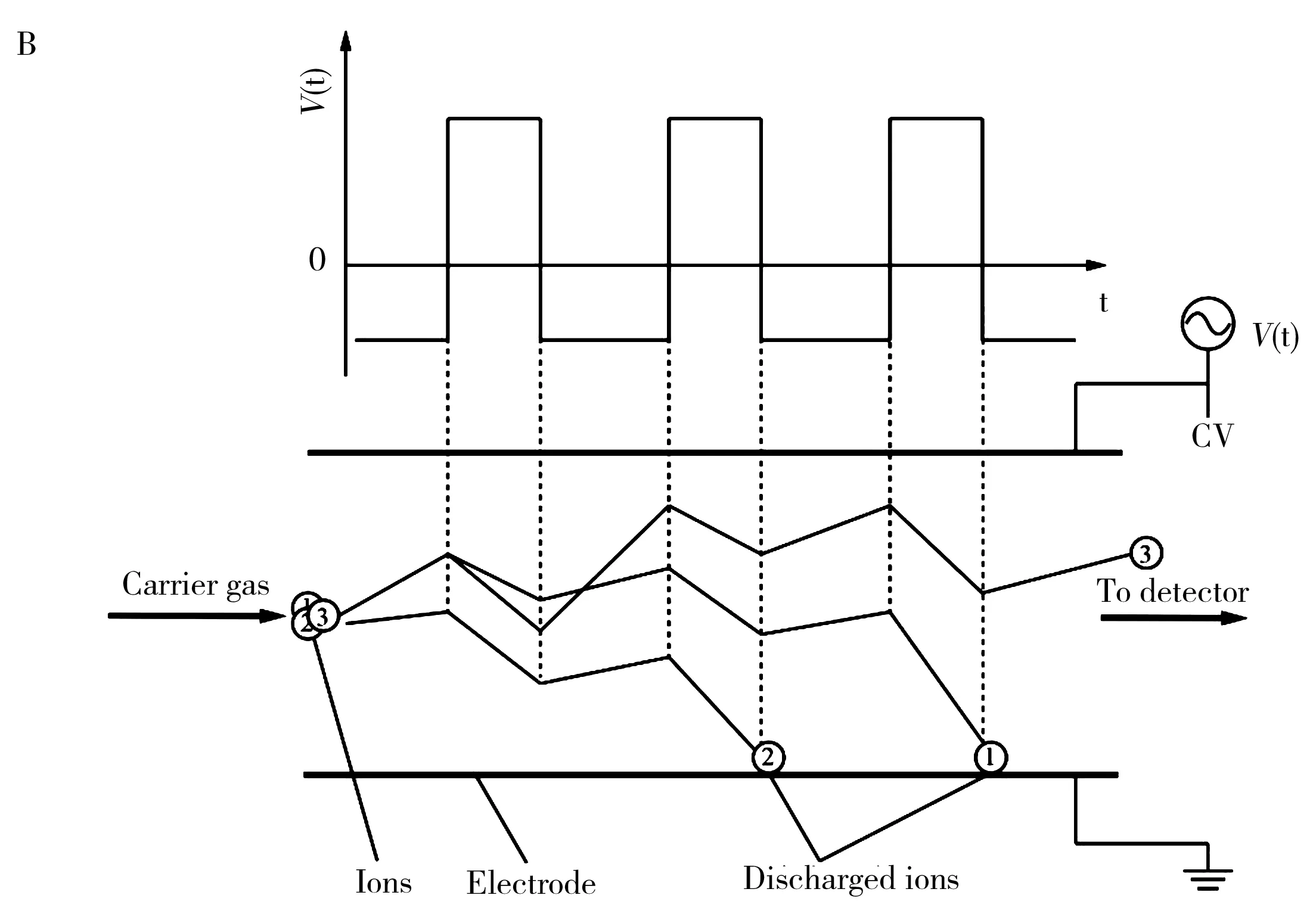
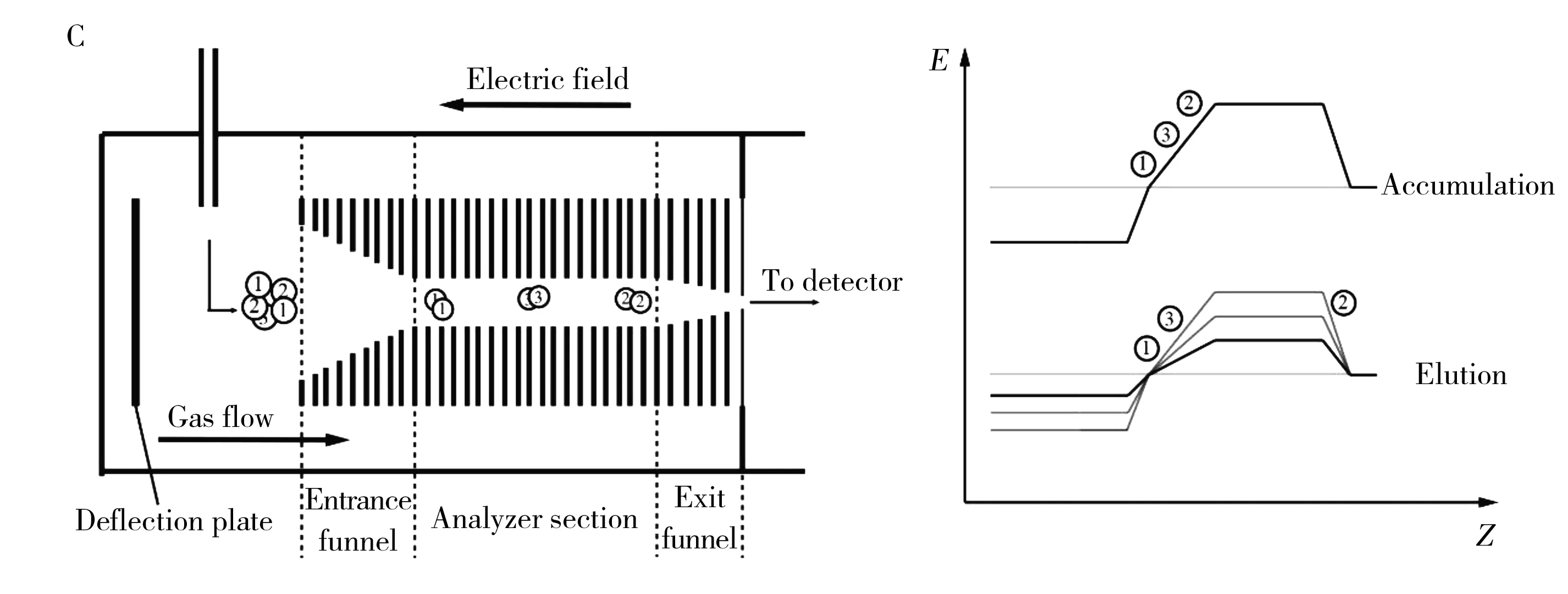
图1 4种常见的离子迁移谱结构示意图Fig.1 Schematics of 4 common kinds of ion mobility spectrometry A:DTIMS and TWIMS; B:FAIMS/DMS; C:TIMS
1.2 离子迁移质谱技术
尽管单独的IMS可以提供关于分析物尺寸、形状以及电荷等用于鉴定目标物的有用信息,但对于精准判断分析物的信息(如离子的质量、结构等)仍很难得到。MS也是一种利用电场分离离子的技术,具有灵敏度高、样品用量少、分析速度快、分离和鉴定同时进行等优点。电喷雾电离、基质辅助激光解吸电离和大气压化学电离等软电离技术的出现,使得生物大分子的MS分析成为可能,并开发出一种新的质谱——生物质谱,且在生命科学领域得到广泛应用[19]。IM-MS技术结合了二者的优点,且IMS的分离原理与传统色谱完全不同,因此IM-MS可以很好地与色谱技术联用,进一步提高分析物的检测灵敏度以及线性范围[20]。另外,由于分析物离子在进入质谱质量分析器之前首先在IMS中得到了一定的分离,一些杂质离子被缓冲气体吹出分离室或打到电极板上,因此MS分析的信噪比及峰容量得到了提高[21-22]。Arthur等[22]使用场不对称离子迁移谱与液相色谱质谱联用(LC-FAIMS-MS)分析尿液样本中代谢物时,由于背景信号的减少,其峰容积比LC-MS提高了3倍。同时,杂质离子的减少也简化了MS谱图,降低了后期解谱和数据处理的复杂性。
2 离子迁移质谱技术在脂质分析中的应用
对实际样本中复杂脂质分子进行全面的定性定量分析是脂质组学研究中最重要和最基础的内容。目前,最常见的脂质定性定量分析方法主要有两种:①将简单前处理的分析样品直接进行质谱分析(Shotgun-MS);②对前处理好的样品先进行色谱分离再进行质谱分析(LC-MS)。这两种方法已被广泛应用于动植物[23-25]、微生物[26]及人[27-28]等各种样本中的脂质分析,并且在脂质鉴定过程中通常会与串联质谱技术(MS/MS)联用,如碰撞诱导解离或高能碰撞解离,从而可以根据碰撞后不同模式下产生的特征离子碎片判断每种待测脂质的酰基链和头部基团。Shotgun方法具有前处理简单、分析时间短和扫描模式丰富灵活等优点,应用较为广泛。但由于其存在离子化抑制效应且不同类别脂质的含量差异较大,导致低丰度脂质很难检测。液相色谱根据脂质的疏水性或极性可以实现较好的脂质分离效果[29-30],但其分离时间较长,一般需数十分钟,甚至数小时,并且对某些脂质的分离效果差,易出现共洗脱。IM-MS分离时间极短(ms),与传统脂质分析方法联用(图2),不仅可以大大缩减脂质分离时间,且对一些结构相似的同分异构体脂质有非常好的分离效果。IM-MS在脂质分析方面的应用主要包括提高脂质分析选择性和分辨率以及分离鉴定同分异构体两个方面。
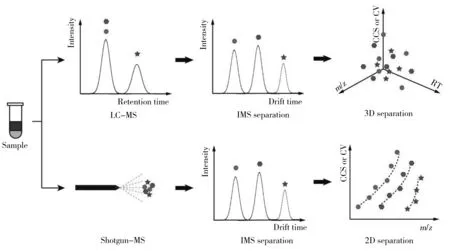
图2 IMS与传统脂质分析方法联用的工作流程图Fig.2 Workflow of IMS combined with traditional lipidomic approaches
2.1 提高脂质分析的选择性与分辨率
在传统脂质鉴定流程中,主要通过将测定的脂质分子质量数与数据库中标准质量数或标准品进行匹配实现脂质分子的确定,脂质分子的结构信息则通过二级特征离子碎片信息判断。但生物样品复杂的基质以及脂质分子种类繁多成为限制这些技术应用的主要障碍。因此需更多与脂质分子物理化学性质相关的参数作为鉴定不同脂质分子的参考指标。
2.1.1DT值或CCS值脂质离子的CCS值代表脂质离子与缓冲气体之间可以发生碰撞的有效面积[31]。在DTIMS、TWIMS和TIMS仪器中,CCS值常被用作分离脂质离子的参数,该值与脂质离子自身的尺寸、形状及所带电荷紧密相关,可看作是脂质离子固有的物理化学特性,与实验条件及设备差异无关[32]。在传统带有均匀电场的DTIMS中,可直接由DT值计算得到CCS值;而在TWIMS等仪器中,则通过已知CCS值标准品的DT值计算得到CCS值[33]。一些较先进的仪器能够自动完成计算过程并直接显示测定物质的CCS 值[34-35]。
不同脂质离子因其碳链长度、双键数以及空间构象不同而具有不同的DT值或CCS值。2009年,Kim等[36]利用TWIMS串联正交加速飞行时间质谱(oa-TOFMS)测定了氮气气氛下质量数范围为400~1 000 Da的磷脂酰胆碱(Phosphatidylcholine,PC)的质荷比(m/z)与DT之间的关系,发现饱和PC的m/z与DT之间存在线性关系,且PC酰基链上的不饱和键会导致DT值减小5%,每增加1个不饱和键,DT值会减少1%。Zhang等[37]在脂肪酸(Fatty acids,FAs)的CCS测定中也发现了类似规律,他们利用一个内嵌有漂移管的电喷雾飞行时间质谱(ESI-IM-QTOF)测定了18种FAs的CCS值。结果发现在饱和脂肪酸中,其CCS值与m/z呈线性关系。而双键的增加则会减小FAs的CCS值,但影响比酰基链长度要小。其原因为双键的存在会使酰基链在电场中呈弯曲结构,从而使CCS值减小。同时他们还发现顺式脂肪酸异构体的CCS值小于同种反式异构体。除碳链长度和双键数外,脂质离子的空间构象对其CCS值也有非常大的影响,不同种类的脂质离子之间CCS值差异更大。Paglia等[38]将TWIMS与两种传统脂质鉴定方法(LC-MS和Shotgun-MS)相结合,提高了脂质鉴定的分辨率和可信度。该方法通过测定人大脑中13类共244种脂质的CCS值,发现在以脂质m/z为横坐标,CCS为纵坐标的坐标体系中,不同类别和亚类的脂质均分布在不同区域,可以实现很好地区分,且同亚类脂质的CCS与其m/z之间也呈线性关系。同时,研究结果也表明脂质的CCS值具有高度可重复性,不受实验室和仪器的影响(RSD<3%)。
为验证所测CCS值的准确性,很多研究者利用脂质标准物测得或利用计算机建模计算生成CCS值,建立了脂质CCS标准数据库[38-39]。Zhou等[40]利用基于机器学习的预测模式对脂质分子的CCS值进行准确预测,并建立了巨大的脂质CCS值数据库(LipidCCS)。首先采用大量脂质标准品测得的CCS值建立预测模型,同时使用生物信息学手段优化结构分子描述符,使该系统在不同实验室、不同仪器条件下测得的数据预测的CCS值中位相对误差在1%以下。LipidCCS数据库包含有15 646种脂质共63 434个CCS值,并提供了免费的网络端口,从而为基于IM-MS的大规模脂质组学研究提供了重要的分析手段。利用这些脂质CCS数据库与实验测得的CCS进行匹配后评分,可减少假阳性和假阴性的判断。
2.1.2CV值在FAIMS或DMS仪器中,CV值常被用作脂质分离和判别的指标。如Shvartsburg等[41]在2011年首次将DMS应用于脂质分离,利用CV值对不同种类脂质(磷脂、溶血磷脂、甘油酯、半乳糖脂和鞘脂等)进行了很好的区分。此外,在CV值差异不明显时,还可以通过改变一些外部条件从而实现更好的脂质分离效果。因此,当一些公司研发的商业DMS(如ABSciex研发的SelexION系列)在常规设置无法实现很好的离子分离效果时,可以通过在载气中添加挥发性的化学修饰剂(如异丙醇等),以进一步增大分析离子之间CV值的差异,提高分析离子的选择性和峰强度[42-44]。2014年,Ekroos等[45]将DMS与Shotgun-MS技术串联分离鉴定磷脂,选择正丙醇、2-丙醇、正丁醇、正庚烷和氯仿5种化学修饰剂测试磷脂酸、磷脂酰乙醇胺、磷脂酰胆碱、磷脂酰丝氨酸和磷脂酰甘油的分离效果。发现在同一质谱条件下,当不使用修饰剂时,只有PC可从这些磷脂中分离。而使用正丙醇或异丙醇作为化学修饰剂时,检测的分辨率最高。脂质离子自身的质荷比对其CV值也有一定影响,故相同类别不同亚类的脂质也可以根据最优CV值进行分离。一般而言,碳链长度越长,最优CV值越大,而双键的存在则会降低脂质的CV值,这与CCS值的变化趋势一致。此外,由于带电离子在DMS中会受到垂直运行方向的电场力作用,而不同离子的CV值存在差异,只有特异性的脂质离子才能在最优CV值下通过DMS到达检测器,因此DMS的背景噪音非常小,信噪比很高,其检测灵敏度相对更高[46-47]。
2.2 分离鉴定脂质异构体
脂质异构体的分离鉴定是脂质分析中最大的挑战之一,相同质量数的脂质分子可能属于不同的脂质种类(如PC32∶2和PS36∶1),也可能是双键位置不同或酰基链位置异构(sn-1和sn-2)或空间结构异构(顺反异构体和手性异构体)的同类脂质分子[48]。当这些同分异构体存在于复杂生物样本中时,在不借助分离手段或者其他前处理的情况下,即使用高分辨质谱也无法对其进行准确分析。LC-MS方法在一定程度上可以用于一些脂质异构体标准品,如酰基链位置异构或含双键的顺反异构体的分离鉴定,但对于复杂基质样本中同分异构体的精准判断却存在困难,许多同分异构体会共洗脱或产生相似的图谱。其他方法如低能碰撞诱导解离[49]、有机物离子的电子碰撞激发[50]、臭氧诱导解离[51-52]和PB衍生反应[53]等也能对异构体脂质进行鉴定,但需对质谱进行改造或者采用复杂的样品前处理过程。IM-MS技术可根据异构体的结构和形状进行分离,将其与传统色谱分离手段相结合,提高了分离选择性,从而为脂质异构体的分离提供了一个新的维度。
2.2.1双键位置及空间异构体脂肪酸是所有脂质的基本组成单元,其链上双键位置不同可以形成不同的异构体。DTIMS-MS可以根据单不饱和脂肪酸标准品内部双键“纽结(Kink)”结构的CCS值差异对其异构体进行区分和鉴定[54]。Groessl等[55]于2015年首次证明了使用高分辨DTIMS-MS对双键位置异构体脂质进行分离的可行性,考察了不同离子加合物(H+、Na+、K+)对PC18∶1(6Z)/18∶1(6Z)、PC18∶1(9Z)/18∶1(9Z)以及PC18∶1(9E)/18∶1(9E)CCS值的影响。结果表明Na+加合物的CCS值差异最大,并成功应用于复杂生物样本(牛心脏、猪脑和酵母)中PC 18∶1(9Z)/18∶1(9Z)的鉴定。Kyle等[54]也发现由于单不饱和脂肪酸中呈顺式方向的双键会使主链比反式方向更弯曲,从而具有更小的CCS值,据此分离了顺反异构体单不饱和脂肪酸。另外,在顺式单不饱和脂肪酸中,当双键位置远离羧基端时,也会使整个脂肪酸链更弯曲,导致更小的空间构象。同样地,在甘油磷脂的异构体鉴定中,Wojcik等[56]发现当PC酰基链上的单个双键位置越靠近其头部基团时,整个PC分子的空间构象也会变大。DMS/FAIMS-MS也在双键位置异构体鉴定中有着重要的应用。Bowman等[57]利用高电场FAIMS-MS成功对甘油酯和甘油磷脂的双键位置异构体进行分离和鉴定。本实验室使用DMS-Q TOF MS对C17∶1双键顺反异构体(C17∶1(10Z)和C17∶1(10E))进行了分离,发现当分离电压(SV)为3 200 V时,两种异构体不能分离;当SV为3 900 V时,在CV值为最优(8 V和11 V)时,两种异构体的分离效果很好。说明在适宜参数下,DMS-MS也可以对双键位置异构体进行准确地判别。
2.2.2sn位置异构体另一类脂质异构体是由于脂肪酸位于脂质骨架分子的不同位置(sn-1、sn-2、sn-3)所致,统称为位置异构体。Kyle等[54]采用DTIMS对不同脂肪酸位置异构的PC(如PC16∶0/18∶0和 PC18∶0/16∶0)进行分离,发现当较长的酰基链连接在sn-1位时,整个PC分子的构象大于连接在sn-2位。但双键的存在会使酰基链尺寸减小(如18∶1<16∶0),所以含双键酰基链连接在sn-1时,其分子尺寸会小于该位置为饱和脂肪酸的脂质分子。Groessl等[55]使用Ag+与PC 16∶0/18∶1和PC18∶1/16∶0形成加合物,成功将其在高分辨DTIMS-MS中分离鉴定,并采用该方法在猪脑提取物样本中发现存在88%的PC 16∶0/18∶1和12%的PC18∶1/16∶0。DMS-MS同样也在位置异构体鉴定中展现出巨大的潜力。Maccarone等[58]利用DMS-ESI MS在不同CV值下分离了Ag+与PC 16∶0/18∶1和PC18∶1/16∶0的加合物,可对PC的sn位置异构体相对含量进行准确定量,结果与传统磷脂酶水解法一致,并将其应用于鸡蛋黄、牛肾、牛脑中PC异构体的测定。ala等[59]利用类似的方法,以1-丁醇或1-丙醇为化学修饰剂,用DMS成功分离了含不饱和脂肪酰基链的甘油三酯位置异构体。与传统的银离子法或反相高效液相色谱-串联质谱法相比,优化的DMS-MS方法可在1 min内实现所有异构体的分离,大大提高了分析通量。利用该方法测定了猪脂肪组织提取物中OSO/SOO、SOS/SSO、POP/OPP和OPO/OOP 4对不同甘油三酯位置异构体的相对含量,结果与传统方法一致。
2.2.3手性异构体脂质分子内部手性中心的判断,即手性异构体脂质的分离鉴定属于脂质异构体鉴定中的难题。研究报道[60],将手性助剂(如2-丁醇的对映异构体)掺入DTIMS-MS装置漂移气体中时,一些氨基酸、葡萄糖等的手性异构体可以实现一定的分离。2013年,Ahonen等[61]对激素类固醇手性异构体(α-雌二醇/β-雌二醇、3α-雄酮/3β-雄酮和17α-睾酮/17β-睾酮)进行衍生化处理后,用TWIMS-MS对其进行了分离。由于原始的固醇异构体之间的CCS值非常接近,很难直接分离,而与对甲磺酰基异氰酸酯衍生化反应后,异构体间的CCS值差异增大,且离子与漂移气体间相互作用的强度增加,从而改善了其在IMS中的分离效果。Kyle等[54]使用DTIMS-MS在正离子模式下对神经酰胺手性异构体Cer(d18∶1/18∶0(2S-OH) )和Cer(d18∶1/18∶0(2R-OH))的钠加合物进行分离。当钠离子结合到R构型的Cer时,2-OH基团会远离长酰基链,使两条酰基链紧密且结构紧凑;而在S构型的Cer中2-OH基团会靠近长酰基链,从而导致两条酰基链互相之间排斥,形成更大的结构。这两种不同结构会使二者CCS的差异增大,从而实现两种手性异构体的分离。
3 总结与展望
IMS作为一种分离手段,已被越来越多地应用于脂质组学研究中,尤其是随着一些数据处理软件的开发,能够实现对IM-MS提供的关于脂质离子信息的自动处理,从而为大规模脂质组学研究带来了新的契机。将IMS与传统基于MS的脂质分析方法相结合,首先为脂质鉴定提供了更多关于分子结构和构象方面的信息(CCS值、DT值、CV值),有效地提高了脂质,尤其是异构体脂质的分离效果,同时排除了假阳性和假阴性干扰;其次,减少了背景噪音的干扰,提高了信噪比,使脂质离子的谱图更加清晰,为解谱工作带来了很大便利;最后,相对于传统分离手段,IMS可在ms时间内实现离子的分离,可与MS技术实现完美结合,且不影响样品分析时间,从而提高样品的分析通量。
近年来,各种分析仪器的快速发展以及新分析方法的不断开发和涌现为脂质组学的研究提供了新的发展方向。使用单独的某一种技术很难实现复杂生物样本中所有脂质的分离和鉴定,未来的脂质组学研究一定是基于各种技术和仪器的联用。新的快速分离分析手段也将日益得到研究者的重视,IM-MS技术就是这一背景下的产物,相信这一技术在未来的脂质组学研究中将扮演更加重要的角色。

