化疗相关性低钠血症病因分析与治疗
王怀冲,宋晓坤
低钠血症是临床最常见的电解质紊乱之一,住院患者中低钠血症发生率为15%~30%[1]。低钠血症是指血浆(或血清)中的钠<135 mmol/L,常伴有血浆渗透压的下降[2];严重者可引起低钠性脑病,早期表现为头痛、躁动、抽搐,继而表情淡漠、昏睡,甚至发生昏迷、呼吸停止和死亡[3]。因其临床症状轻重不一,鉴别诊断复杂,可能延误治疗。与化疗药物相关性的低钠血症已有报道,但多属于个案,并且病因追踪分析局限于文献的直接引用,缺少规律的、明晰的、系统的病因追踪方法和治疗评价。本文旨在通过分析1例多柔比星联合环磷酰胺(AC)方案化疗后出现低钠血症的诊治,展开病因追踪分析、提出治疗建议,以期为医药护人员处理相关药物不良事件(ADE)提供借鉴。
1 病例简介
患者,女,55岁,因“右侧乳腺癌术后7周余”拟行术后辅助化疗于2017-09-04收治入院。患者于2017年7月无意中发现右侧乳腺一肿块,直径约3.5 cm。超声检查示:右侧乳腺癌(BI-RADS:5)。核磁共振示:右侧乳腺中上方肿物(3.0 cm×3.8 cm×3.2 cm)——乳腺癌,右腋下多发淋巴结(较大者约1.0 cm×0.8 cm)。2017-07-19行右侧乳腺局部扩大切除+右前哨淋巴结活检+右低腋窝淋巴结清扫术。术后病理检查示:(右)乳腺浸润性导管癌,组织学Ⅱ级,肿物大小2.5 cm×2.4 cm×2.3 cm;免疫组化检查示:雌激素受体α(2%),孕激素受体(<1%),人表皮生长因子受体-2(HER-2)(+++),Ki-67抗原(40%),肿瘤抑制蛋白p53(70%);术后分期:pT2N1aM0,ⅡB期,HER-2过表达型。
患者2010年患高血压,服用美托洛尔、氯沙坦后血压控制尚可。2011年发现“甲状腺功能减退”,服用左甲状腺素控制良好。2011年发现“骨髓增生异常综合征(血小板增高症)”,使用过羟基脲、干扰素治疗。2014年发生心肌梗死,行介入取栓术,术后口服阿司匹林、替格瑞洛。18年前行“双乳肿物切除术”,自述病理结果良性(右侧乳腺纤维腺瘤、左侧乳腺囊性增生)。30年前患“结核性腹膜炎、淋巴结核”,经药物治疗后痊愈。余无殊。
患者查体右侧乳腺呈保乳术后改变,右侧乳腺上方、右腋下可见术后瘢痕,愈合良好;左侧乳腺未触及肿物。浅表未触及肿大淋巴结。患者一般情况可,饮食、睡眠佳,二便正常,无头晕、头痛等,体质量无明显增减。患者体表面积1.73 m2,体质指数23.87 kg/m2,Karnofsky评分90分。入院完善相关检查:血常规(除血小板515×109/L)、肝肾功能、血糖、电解质、凝血功能、乳腺肿瘤标志物、甲状腺功能指标大致在参考范围内。心电图、血压无殊。2017-09-06行AC方案术后辅助化疗第1周期,具体为:多柔比星脂质体(ADM)60 mg,d1,静脉滴注+环磷酰胺(CTX)1 g,d1,静脉滴注。当日输液量2 700 ml(其中0.9%氯化钠1 150 ml),患者遵医嘱多饮水(后经调查饮水量≥2 500 ml)。患者化疗过程顺利,但化疗后3 h(2017-09-06 18:00)患者突发意识模糊,呈昏睡状;予呋塞米20 mg肌肉注射,精神症状有所好转。7 h后(2017-09-06 22:00)患者出现平卧不能,四肢抽搐,似癫痫发作;予制动,地西泮10 mg肌肉注射,甲泼尼松龙40 mg肌肉注射。急查血常规结果回报基本正常;血糖回报12.42 mmol/L;电解质检查回报:血钠118 mmol/L,血氯86 mmol/L,血钾3.3 mmol/L,血镁0.53 mmol/L,血钙2.05 mmol/L。当班医师予0.9%氯化钠500 ml加氯化钾1 g静脉滴注,意识障碍,呼之不应不能缓解,2017-09-07 01:30转入ICU进一步治疗。予鼻导管吸氧,禁食,留置导尿管,记录每小时液体出入量,心电监护、血气分析示各项指标大致在参考范围内,予10%浓氯化钠6 g加入0.9%氯化钠溶液250 ml静脉滴注,并予氯化钾、硫酸镁、氯化钠混合溶液静脉滴注,完善肝、肾、心、甲状腺功能及电解质、血常规、尿常规、血凝常规、乳酸、心脏标志物、血/尿渗透压、降钙素原等检查评估内环境。次晨,患者可自主睁眼,四肢活动可,无法语言沟通,不能遵医嘱活动。24 h补液量790 ml,尿量1 470 ml。复查电解质示血钠122 mmol/L,血氯96 mmol/L,低钾血症已纠正,继续适量补钠,10%浓氯化钠溶液3 g加入0.9%氯化钠溶液100 ml静脉滴注,并予适量其他复合电解质、营养、神经保护剂治疗。2017-09-08患者轻度嗜睡,呼之应答,可遵医嘱活动。24 h共计补液量2 180 ml(口入量20 ml),尿量5 450 ml;查电解质示血钠135 mmol/L,血氯105 mmol/L。至2017-09-10患者电解质紊乱已纠正,意识恢复正常,转回内科继续治疗。
2017-09-07 02:00患者血渗透压较低,为248 mOsm·kg-1·H2O-1( 参 考 范 围 275~305 mOsm·kg-1·H2O-1);2017-09-07 02:00、2017-09-08 06:00尿渗透压检测均较低,分别为 247、121 mOsm·kg-1·H2O-1(参考范围 600~1 000 mOsm·kg-1·H2O-1),血、尿渗透压变化趋势见图1;血钠、血氯变化趋势见图2;电解质及血糖的检测值详见表1;N端-B型钠尿肽前体(BNP)3次检测值分别为834、392、69 pg/ml(参考范围0~125 ng/L);血压于ICU初次检测较高,下肢血压为161/102 mm Hg(1 mm Hg=0.133 kPa,后多次检测收缩压均较高,舒张压正常);肝肾功能、甲状腺功能、尿常规、乳酸、降钙素原多次(≥3次)检测均显示大致在参考范围内。血气分析、血pH值大致在参考范围内。颅脑CT示未见明显异常。床旁胸部X线检查示双肺纹理增多。治疗后各项指标均大致在参考范围内。
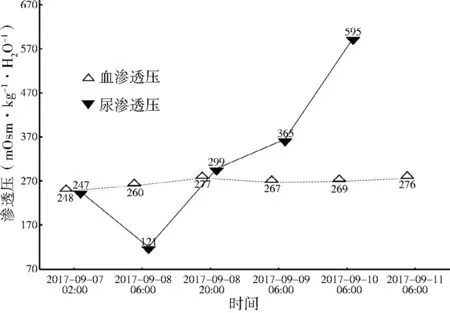
图1 血、尿渗透压变化趋势图Figure 1 Graph of trends in plasma and urine osmotic pressure
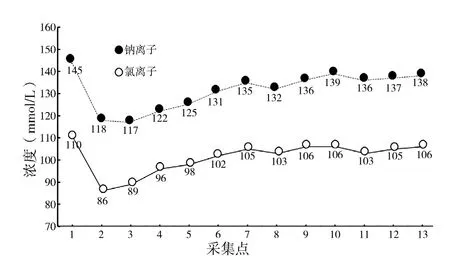
图2 钠离子、氯离子变化趋势图Figure 2 Graph of Na+ and Cl- levels
2 病因分析
解析低钠血症的因果关系,需要解答如下3个问题:(1)本次ADE的主要原因是什么?(2)导致低钠血症的因素有哪些?(3)本次低钠血症的主因是什么?通过追踪分析,辨析得出相应的结论,进而对症处理。同时还涉及以下3个方面问题:(1)急性低钠血症如何处理?(2)如何审视低钠血症与大量水化之间的关系?(3)如何防范或警惕低钠血症?首先,从患者意识障碍为主要临床表现的病因分析开始。

表1 不同时间点患者主要电解质、血糖数值变化Table 1 Major electrolytes and blood glucose at different time points
2.1 意识障碍病因分析 意识障碍是指人对周围环境及自身状态的识别和觉察能力出现障碍;多由高级神经中枢功能活动受损引起,严重的意识障碍表现为昏迷。意识障碍病因主要包括颅内疾病、颅外疾病两类,颅内疾病包括脑血管病、颅内占位性病变、颅内感染、颅脑创伤性疾病、癫痫等。颅外疾病包括:(1)系统性疾病:肝性、肺性、肾性、心性、胰性脑病,糖尿病性昏迷,低血糖性昏迷,内分泌疾病,物理性缺氧性损害,水电解质紊乱、酸碱平衡失调(低渗性低钠血症、低氯血症性碱中毒、高氯血症性酸中毒);(2)中毒性脑损害。
本例患者开始表现为意识模糊,继而抽搐,最后表现为意识障碍、呼之不应。颅脑CT检查未见明显异常,并且该患者无癫痫史,近期无感染史及相关异常指标,无创伤史,无肝、肺、肾相关性疾病史,无中毒性药物史,无肝性脑病等相关疾病发生。本例患者有甲状腺功能低下史,但在药物控制下维持在参考范围内(甲状腺素、促甲状腺激素、三碘甲状腺原氨酸等化疗前1次检测,化疗后2次检测均在参考范围内),且无甲状腺危象史;血糖曾一过性升高至12.42 mmol/L,但通常血糖每升高5.6 mmol/L血钠可下降1.6~2.4 mmol/L,难以用单一因素解释患者血纳最低至118 mmol/L的原因。本例患者血糖迅速得以纠正,无酮症酸中毒、高渗性昏迷指标支持。BNP有过异常升高,虽然BNP可以增加尿钠排泄,但同时可以通过脑干丘脑部位调节的作用,直接减少其自主排放量,一般不直接导致低钠血症的发生。患者发病初期体液排出量明显减低,心室的体积和压力增高可能导致血浆内BNP的升高。患者血pH值ADE后初次检测值为7.39,无酸碱失调证据。患者血渗透压ADE后初次为248 mOsm·kg-1·H2O-1,血钠为118 mmol/L,结合病史、检测指标和临床表现,低渗性低钠血症很可能是导致患者意识障碍的主要因素。
2.2 低钠血症归因分析 依据2014年欧洲低钠血症临床诊疗指南[4],(1)根据血钠水平分为:轻度低钠血症(血钠130~135 mmol/L)、中度低钠血症(血钠125~129 mmol/L)、重度低钠血症(血钠<125 mmol/L),血钠低于110 mmol/L时患者症状明显且加重。(2)根据发生时间分为:急性低钠血症(<48 h)、慢性低钠血症(≥48 h);低钠血症发生<48 h更易发生脑水肿,且脑需要48 h适应低钠环境,但如果血钠纠正过快,则可能再次发生脑损伤。(3)根据症状分为:轻度症状、中度症状、重度症状(呕吐、心跳-呼吸窘迫、异常和深度嗜睡、癫痫样发作、昏迷);低钠血症的临床症状与血钠降低和下降速度有关。(4)根据血渗透压分为:低渗性低钠血症(血清渗透压<280 mOsm·kg-1·H2O-1)、等渗性低钠血症(血清渗透压280~295 mOsm·kg-1·H2O-1)、高渗性低钠血症(血清渗透压>295 mOsm·kg-1·H2O-1)。其中低渗性低钠血症根据细胞外液容量的状况分为低容量性(直立性低血压、心动过速、皮肤饱满度下降、黏膜干燥)、等容量性、高容量性(水肿、腹腔积液)。
患者癫痫样发作时间在化疗完成后7 h,继而在10 h左右出现昏迷。血压多次检测显示收缩压均较高,无心动过速,无水肿、腹腔积液,结合血钠、血渗透压等重点监测指标和临床表现,患者最终定性为急性严重性等容量性低渗性低钠血症。
2.3 等容量性低渗性低钠血症诱发因素 等容量性低钠血症系水排泄明显减少,引起水潴留,但非水肿性疾病,最常见的诱发因素是抗利尿激素分泌异常综合征(SIADH)[5]。而导致SIADH的主要病因包括:(1)某些肿瘤组织合成并自主性释放抗利尿激素(ADH):最多见的为小细胞肺癌,约80%的肿瘤相关性SIADH患者由此引起;是否出现SIADH取决于水负荷的程度。其他肿瘤如胰腺癌、大肠癌、淋巴瘤、肉瘤、胸腺瘤等也可引起SIADH。(2)肺部感染:如肺结核、肺炎等有时也可引起SIADH,可能是由于肺组织合成与释放ADH造成。在有结核病变的肺组织中曾发现有ADH,但正常肺组织中则无。(3)中枢神经病变:包括创伤、炎性反应、出血、肿瘤等可影响下丘脑-神经垂体功能,促使ADH释放而不受渗透压等正常调节机制的控制。(4)药物:如化疗药物、部分降脂药、吩噻嗪类药、抗抑郁药(三环类、选择性5-羟色胺再摄取抑制剂)、非甾体类抗炎药等可刺激ADH释放,从而引起SIADH[6-8]。(5)其他:左房室瓣狭窄分离术后,因左心房压力骤减刺激容量感受器,可反射性地促使ADH分泌增多。少数患者找不到明确的原因,可能是肾小管对ADH的敏感性增加所致等。除SIADH外,糖皮质激素缺乏、腺垂体功能减退、甲状腺功能减退、大量摄入水或低钠溶液等亦可引起等容量性低钠血症。当尿渗透压≤100 mOsm·kg-1·H2O-1,水摄入相对过量是低渗性低钠血症的主要原因。
患者尿渗透压最低检测值为121 mOsm·kg-1·H2O-1,因此,大量摄入水可能是本次低钠血症的充分条件,而非必要条件,SIADH可能是患者诱发低钠血症主要因素,并且CTX可能是患者导致SIADH的主要原因。
2.4 SIADH关联性分析
2.4.1 SIADH诊断标准 SIADH是指多种原因引起的内源性ADH分泌异常增多或活性增加,从而导致水潴留、尿排钠增多以及与稀释性低钠血症等有关的临床表现的一组综合征。此综合征由SCHWARTZ等[9]于1957 年首次报道。主要诊断指标包括:(1)低血渗透压;(2)尿渗透压>100 mOsm·kg-1·H2O-1;(3)临床等容量(无低容量或高容量性临床表现);(4)尿钠>40 mmol/L(正常钠摄入情况下);(5)甲状腺和肾上腺功能正常;(6)近期未使用噻嗪类利尿剂;(7)辅助指标,如血尿酸<238 μmol/L、血尿素氮降低<3.75 mmol/L,0.9%氯化钠溶液补液无效,ADH升高。患者皮质醇和ADH未行常规检测,但结合临床、影像和肾功能监测指标,皮质醇基本推断为正常。ADH测定为SIADH诊断中辅助指标,不推荐患者常规测量,因为SIADH 中 ADH 分泌模式有4 种不同类型,单纯血浆ADH测定水平不能诊断或者排除SIADH[6]。患者化疗前尿酸、尿素氮分别为274 μmol/L(参考范围154.7~357.0 μmol/L)、4.4 mmol/L(参考范围 2.8~7.2 mmol/L),化疗后初次检测183 μmol/L、3.7 mmol/L,呈下降表现并低于SIADH辅助诊断指标;尿钠初次检测值为55 mmol/L;近期未使用过噻嗪类利尿剂;并且ADE后初始静脉滴注0.9%氯化钠溶液未能改善昏迷症状;结合血渗透压、尿渗透压等检测指标和临床表现,患者符合SIADH诊断。
2.4.2 ADH、SIADH与低钠血症相互关系 SIADH使机体ADH分泌增多。ADH是由9个氨基酸残基组成的小肽,在下丘脑合成,由垂体后叶释放,通过血液循环到达肾脏,结合并激活肾髓质远端集合管与远曲小管基底细胞膜的V2受体,活化腺苷酸环化酶,增加肾小管上皮细胞内的环磷酸腺苷含量,环磷酸腺苷作用于细胞质内的蛋白激酶A,后者使位于细胞内囊泡的水通道蛋白-2氧化磷酸化,再经微管和肌动蛋白丝的作用使囊泡向管腔侧细胞膜移动并融入管腔侧细胞膜,使细胞膜对水的通透性增高,肾小管对水回吸收增加,细胞外液容量增加,醛固酮分泌受到抑制,尿钠排出增加;血容量增加还引起心房利钠肽分泌增加,共同作用使尿钠排出增多,导致低钠血症和低渗状态。通常单纯ADH增加不引起低钠血症,在ADH增加基础上胃肠道摄入或静脉滴注过量低渗液体才引起低钠血症[10-11]。
2.4.3 SIADH需与脑耗盐综合征(CSWS)鉴别 存在神经系统受损的患者,在发生低钠血症时须鉴别SIADH和CSWS。CSWS是指在颅内病变的进程中,因钠盐经下丘脑-肾脏途径丢失而导致的低钠血症,临床表现为血容量和总钠含量降低,且常伴血肌酐和尿素氮的升高。两者治疗原则不同,CSWS患者以补液、补钠为主,而SIADH需以限水、补钠为主。
3 ADE判别与佐证
3.1 CTX导致SIADH的可能机制 JAYACHANDRAN等[12]报道CTX可能同时影响控制ADH合成的下丘脑视上核和室旁核以及具备内分泌功能的肿瘤细胞,并且CTX可能通过其代谢产物间接导致ADH增加。为预防出血性膀胱炎,使用CTX同时大量水化,在ADH分泌增加的基础上进一步加重了低钠血症。另外,CTX本身被认为具有抗利尿作用,该作用可能与其烷基化代谢物对集合管上皮细胞的直接影响有关,CTX作用于水通道,增强ADH诱发的水分子传递。
3.2 文献证据 通过对国内外数据库检索发现,截至2017年9月CTX与抗肿瘤化疗相关性重度低钠血症的报道已有10余例患者[13-19],其中联合化疗方案均倾向于认为CTX是引起低钠血症的主要原因,且与CTX使用剂量大小无关。参照Baxter Oncology GmbH生产的CTX 2011-09-02修订版说明书,CTX的偶见药物不良反应(ADR)包括SIADH伴有低钠血症和水潴留,精神、神经症状表现为精神错乱、惊厥、眩晕等。患者应用AC方案中的ADM,参照Merck & Co.说明书并未发现低钠血症和水潴留的ADR,并且缺少相关文献报道。CTX导致SIADH引发低钠血症可能性很大,可通过国际通用Naranjo ADR评判表和我国改良“ADR评判标准”进行相关性评价分析。
3.3 Naranjo ADR评判分析 本例患者CTX发生低钠血症ADR根据Naranjo ADR评判表符合:“(1)该药是否曾引起此类反应”,是;“(3)有无其他诱发因素”,否;“(4)药物作用时间与ADR出现时间是否相关”,是;“(5)停药或采取相应解救措施后,ADR是否改善或消失”,是;合计评判分值为6分,判断为“很可能”,具体参考表2。
3.4 我国ADR评判标准 CTX发生低钠血症ADR根据我国ADR判断标准符合“合理的时间顺序”“已知药物的反应类型”“去除原因可以改善”,且无另外可行解释,CTX相关性ADR评价为“很可能”。
因此,ADR因果关系评价再次佐证了CTX很可能是本次低钠血症主要原因的判断,并且通过SIADH机制引发。
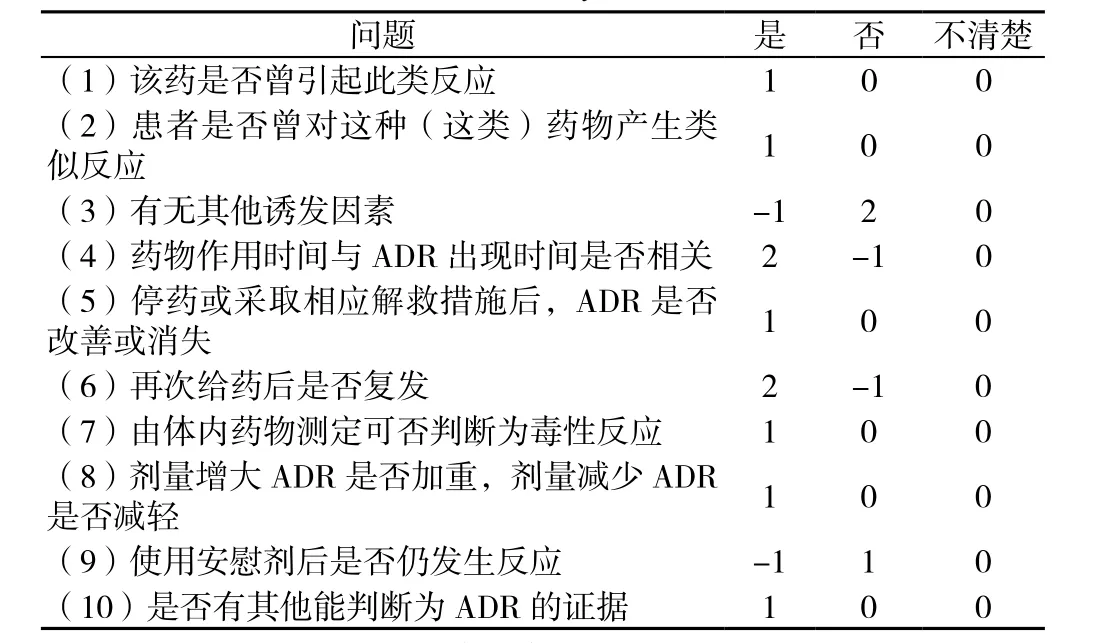
表2 Naranjo ADR评判表Table 2 Table of Naranjo ADR assessment
4 化疗相关性低钠血症治疗与转归
低钠血症治疗目标主要包括治疗原发病和纠正低钠血症。欧洲低钠血症临床诊疗指南建议,严重低钠血症患者第1 h推荐立即静脉输注3%高渗氯化钠注射液150 ml(20 min以上),20 min后复查血钠,必要时重复上述输液,直到达到血钠水平增加5 mmol/L[4]。补钠过程应缓慢,严重低钠血症纠正过速极易引起渗透性神经脱髓鞘综合征,特别是伴有严重营养不良、酒精中毒、肝功能不全的患者[20-21]。推荐补钠速度第1个24 h血钠水平升高<10 mmol/L,随后每24 h血钠水平升高<8 mmol/L,血钠水平达到130 mmol/L或临床症状改善,停止输入高渗氯化钠注射液[4]。中重度低钠血症,目标为每24 h血钠水平升高5 mmol/L。2016年《老年患者低钠血症的诊治中国专家建议》[22]认为,对于急性严重症状低钠血症,血钠的纠正速度不必严格限制,也不必降低过度纠正引起的血钠升高。对于发生抽搐的患者,应当给予抗惊厥药物以及适当的辅助通气。另外,纠正血钠同时纠正其他电解质紊乱,如纠正低钾血症可能有助于血钠增加。如果血钠上升而症状无改善,应多因素分析或寻找其他原因。SIADH对症治疗包括限制液体总量,可选择使用高渗氯化钠注射液、髓袢利尿药、口服钠、尿素、血管加压素V2受体拮抗剂(托伐普坦)等[23-24]。
患者化疗后3 h突发意识模糊,7 h后出现癫痫样发作,10 h后出现昏迷,期间检测电解质并予0.9%氯化钠联合氯化钾静脉滴注纠正电解质紊乱未能缓解。事件发生突然,紧急转科处置及时。提示临床,整个化疗周期均是重点监测时段,如发生意识障碍应及时综合分析,辨析病因或诱因,及时检测关联指标并积极对症处理。发生严重化疗相关性低钠血症,辨明原因后建议更改方案或更换导致低钠血症药物;轻中度症状低钠血症可以更改方案或在严密监护下维持原方案,预防性补钠或预防性优化水化方案,限制无电解质液体的总液占比,做好注意事项交代并密切观察病情变化,及时监测液体出入量和电解质变化。本例患者后续治疗更换为紫杉醇联合曲妥珠单抗方案,未再出现低钠血症,血钠水平维持在139~142 mmol/L。
5 化疗相关性低钠血症临床建议
严重低钠血症临床风险高,但初始表现隐匿性强,治疗不及时会导致抽搐、昏迷等严重后果,故应引起临床重视。当肿瘤患者化疗后出现乏力、头痛、嗜睡、尿量减少等症状警惕为低钠血症的早期症状,应密切观察患者意识和精神状态,及时检测电解质浓度、渗透压水平等,适时完善影像学检查。病因诊断是第一要素,除了等容量性低渗性低钠血症诱发因素外,化疗相关性低钠血症还可能与以下因素有关:肾毒性化疗药物因大量水化造成非电解质液体输入过多,尿量减少;化疗直接损伤肾小管上皮细胞干扰钠的重吸收;化疗引起胃肠道反应导致钠摄入不足,丢失过多或非渗透性刺激ADH释放作用;应用利尿剂、脱水剂经肾丢失或者大量出汗经皮肤丢失等。低钠血症病因诊断后停止一切诱发因素或治疗原发病,按不同病因规范补钠、利尿、镇静和必要时限液等积极对症治疗,需要时留置鼻饲管及导尿管,准确记录定时出入量。SIADH机制引发的严重低钠血症需严格控制液体总量,包括静脉和胃肠道摄入量,开始一般控制在500~1 000 ml为宜。
临床应用可能影响低钠血症的化疗药物,如CTX、异环磷酰胺、顺铂、卡铂、长春新碱、甲氨蝶呤等;或伴有其他疾病需要同时应用氯磺丙脲、卡马西平、噻嗪类利尿剂、吩噻嗪类药、抗抑郁药等可能影响血钠水平的药物时,应该引起足够重视。特别是有化疗相关性低钠血症病史或化疗周期中发现低钠血症早期症状时,应当及时监测电解质,并配好3%高渗氯化钠溶液,以备应急所需。伴有甲状腺、肾上腺皮质功能减退,肿瘤相关性内分泌异常,肺部感染,慢性充血性心力衰竭,神经系统疾病等的患者,需治疗和改善原发疾病,不要过度限盐或采用低盐及无盐饮食,以预防低钠血症的发生。目前化疗前水化预处理缺少相关指南规范,水化摄入液体总量(包括静脉和胃肠道途径)如何标准定量,电解质溶液占水化总量如何配比,如何预防性补钠和预防性采取积极措施,尚缺乏系统性评价和参考规范,有待临床工作中进一步探讨、归纳、总结。
本文价值:
肿瘤患者化疗引起的低钠血症临床风险高,隐匿性强,可能延误治疗。本文通过多柔比星联合环磷酰胺(AC)方案化疗后出现低钠血症的诊治,从临床症状展开病因追踪,结合实验室和影像学检查,阐明化疗药物可通过抗利尿激素分泌异常综合征(SIADH)机制诱导低钠血症,并提出治疗建议;诊断思路清晰,为医药护人员处理相关药物不良事件(ADE)提供借鉴。但不同药物引起的低钠血症除了SIADH机制还可能存在其他机制,限于篇幅不能逐一展开,具体药物还需区别对待。
作者贡献:王怀冲进行文章的构思与设计、病例资料/文献收集与整理,撰写论文;宋晓坤进行文章的修订、审校,负责文章的质量控制,对文章整体负责,监督管理。
本文无利益冲突。
——2017年渗透压相关高考真题赏析

