低蛋白饮食在非透析慢性肾脏病中的应用研究
王彦,孙建琴
本文文献检索策略:
检索数据库:PubMed检索词为low protein diet,protein restriction,chronic kidney disease,nutritional status,proteinuria,metabolic;万方数据库检索词为低蛋白饮食、慢性肾脏病。检索范围:建库至2017年12月,主要选取近10年关于低蛋白饮食与慢性肾脏病相关的核心期刊发表文献。
慢性肾脏病(CKD)是一类由各种原因导致的不同程度的慢性肾脏损害,起病隐匿,早期就诊率及治疗率低,预后不良、并发症多,医疗费用高昂,给个人、家庭和社会带来沉重负担,已成为威胁公共健康的主要疾病之一。一项发表在《柳叶刀》杂志上的流行病学调查结果显示,目前我国CKD的患病率为10.8%[1]。
低蛋白饮食(LPD)是一种限制蛋白质摄入的饮食模式,被认为是CKD综合治疗中的重要环节之一。目前,对于LPD是否有益于保护CKD患者的残肾功能,各研究结论不一;同时临床对于LPD对患者营养状况的影响也存在顾虑。本文综述了近年来有关蛋白质摄入对肾脏功能的影响,以及LPD对CKD患者作用的研究,并梳理了LPD实施中的要点,有助于提高CKD患者饮食管理的质量、减缓病情进展、延后或避免透析治疗,为营养师和临床医生对CKD患者制定和实施有效的饮食治疗计划提供参考。
1 饮食蛋白质摄入(DPI)与肾脏功能
高蛋白饮食(HPD)与肾小球高滤过有关,可引起尿蛋白排出增加,可能对肾脏和其他器官产生长期不利影响[2]。肾小球囊内压力和流量的增加可导致进行性肾小球损伤和硬化[3-4]。然而,人群研究显示,HPD与肾功能受损者的肾小球滤过率(GFR)下降加快相关,但在肾功能正常者中未观察到此现象[5]。一些相关研究也未发现HPD对肾脏健康人群的肾功能有影响[6-9]。虽然HPD对健康人群的不良影响尚未明确,但在如今越来越多的人以HPD作为减肥手段的背景下,值得引起更多的关注和研究。
在CKD的疾病进展中,动物研究早已明确地证实了LPD的积极作用:LPD可收缩入球动脉、降低肾小球囊内压力,而HPD则扩张入球动脉、增加肾小球滤过率[10],肾小球持续高滤过会损伤剩余的肾小球[11]。此外,低蛋白摄入还可通过血管紧张素通路调节扩张出球动脉,降低肾小球囊内压力[12]。
近年来多数研究支持LPD在CKD进展中的积极作用。LPD对于CKD的益处主要在于:(1)降低蛋白尿排出。研究显示,限制蛋白质摄入可使CKD患者的蛋白尿排出降低20%~50%[13-14],每日蛋白质摄入量(DPI)的降低与蛋白尿的降低存在线性关系[13]。在使用肾素血管紧张素系统(RAS)抑制剂过程中实施LPD,可能会使蛋白尿降至更低水平[3]。(2)延缓CKD进展。虽然著名的MDRD研究结果显示LPD在CKD进展中的益处很小[15],但MDRD研究存在的若干限制可能影响了试验结果[16],其二级分析研究显示,DPI降低0.2 g·kg-1·d-1与GFR的下降减慢29%有关,从而使进展到终末期肾脏病(ESRD)所用时间延长41%[17]。一项随访5.6年的前瞻性观察研究显示,DPI升高0.1 g·kg-1·d-1与ESRD风险升高1.09倍相关[18]。更多的研究肯定了LPD对降低GFR下降速度和延长进展至ESRD时间的作用[19]。(3)改善代谢。降低蛋白质摄入量可减少尿素生成[20-21],控制氮质血症,改善CKD患者的代谢性酸中毒。蛋白质尤其是动物蛋白质是膳食磷的主要来源,LPD通过限制DPI可帮助改善高磷血症,从而改善CKD矿物质骨代谢紊乱(CKD-MBD)[22-23]。另有研究显示,LPD可降低血清晚期糖基化终产物(AGE)[24],减轻胰岛素抵抗和氧化应激,可能对CKD患者的动脉粥样硬化有改善作用[25]。
目前对LPD的主要疑虑来自对限制饮食可能导致营养不良的担忧。有研究显示,18%~75%的CKD患者存在蛋白质能量消耗(PEW)[26-28];PEW会引起CKD患者发生肌肉衰减征,CKD患者出现肌肉衰减征早于同龄人[29]。MDRD研究中,LPD组受试者出现了营养相关测量指标的下降,包括体质量、体脂、皮褶厚度、手臂肌肉[30]。MDRD长期随访研究发现,极低蛋白饮食与更高的病死率相关[31]。然而,这些受试者的能量摄入较低(约22 kcal·kg-1·d-1),进而增加了PEW和蛋白质能量营养不良(PEM)的风险。因此,预防和纠正CKD患者的PEW和PEM尤为重要。研究显示,将LPD的DPI控制在0.6 g·kg-1·d-1这一下限时,营养不良的发生率较少[15,32],提示对于成人而言,此蛋白质限制量在营养和代谢上是安全的[33]。将DPI控制在0.6 g·kg-1·d-1并补充酮酸制剂可预防营养不良[34];个体化的LPD干预可对CKD患者起到治疗效果,改善患者病情、减缓肾功能的恶化,并升高血清前白蛋白水平,值得在临床推广应用[35-36]。
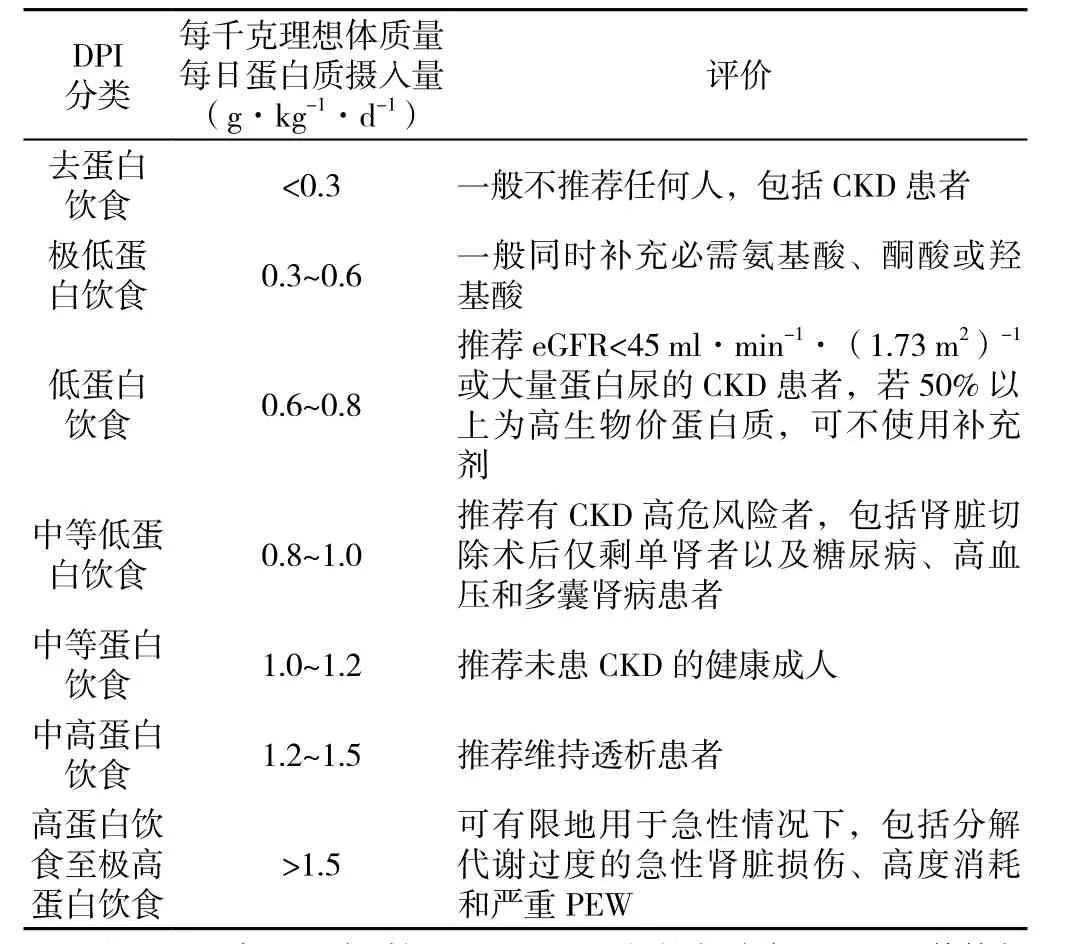
表1 蛋白质摄入量与肾脏疾病情况[37]Table 1 Recommendations for protein intake in patients with CKD
2 CKD患者的LPD
CKD患者摄入过多蛋白质会导致尿毒素的累积,而蛋白质摄入不足又会导致瘦体质量丢失及营养不良。因此,完整的LPD应包括合理的蛋白质摄入、充足的能量摄入、限制钠和纠正其他微量营养素摄入。
2.1 合理质与量的蛋白质摄入 对于非透析CKD患者的DPI目标量,目前使用最广泛的是0.6~0.8 g·kg-1·d-1[37]。极低蛋白饮食(DPI<0.6 g·kg-1·d-1)结合必需氨基酸或其酮酸的补充也时有应用,尤其在素食患者中[38]。KALANTARZADEH等[37]整理了肾脏疾病各阶段中的DPI水平并做出评价,值得参考借鉴(见表1)。
全球改善肾脏病预后组织(KDIGO)2012年版指南[39]推荐:(1)GFR<30 ml·min-1·(1.73 m2)-1的 CKD 患者,无论是否同时罹患糖尿病,DPI均应降低至0.8 g·kg-1·d-1,并接受合适的健康教育;(2)对于存在CKD病情进展风险的患者应避免HPD(>1.3 g·kg-1·d-1)。同时指出,将DPI下降到<0.8 g·kg-1·d-1的水平似乎没有益处,并强调饮食控制期间要注意监测营养相关的临床生化指标;高蛋白摄入,尤其是非奶类动物蛋白的高摄入,会加快CKD患者的肾脏功能衰退,应当避免。对于KDIGO提出的推荐,有持不同意见的研究表明,在CKD早期(1~3期)就应该开始LPD,并且应将 DPI控制在 0.6~0.8 g·kg-1·d-1[40]。有研究显示,极低蛋白饮食同时补充酮酸制剂,比普通LPD更有助于延缓肾功能衰退速度、降低肾脏替代治疗的需要[41]。
综上,笔者建议综合考虑低蛋白摄入对CKD的积极影响以及患者的可接受程度,同时尽量避免营养不良的发生,将非透析CKD患者的DPI目标控制在0.6~0.8 g·kg-1·d-1可能较为适宜,其中优质蛋白质需占50%以上,并注意营养监测与教育;若采用更低DPI的饮食要注意酮酸制剂的补充。
2.2 充足的能量摄入 充足的能量摄入是LPD实施中的关键,对预防和纠正CKD患者的蛋白质-能量营养不良尤为重要。一项随机对照试验对109例CKD患者进行0.6~0.8 g·kg-1·d-1蛋白质、30~35 kcal·kg-1·d-1能量的饮食咨询,并给予干预组(55例)200 kcal/d的无蛋白质能量补充(含40 g麦芽糊精和5 g油),分别在基线、12周、24周时测量各项生化指标,结果显示干预组的DPI和尿蛋白排出量均显著下降,且低于对照组,同时,干预组的血清肌酐和尿素氮基线水平也显著下降,GFR显著升高[42]。美国肾脏病预后生存质量指导(K/DOQI)[43]建议:<60岁的CKD患者能量摄入量为35 kcal·kg-1·d-1,>60 岁者为 30~35 kcal·kg-1·d-1。
2.3 钠及其他微量营养素的摄入 钠的摄入量是目前公认的影响血压水平的一大因素,而高血压是CKD进展中的重要因素之一。KDIGO指南[39]推荐CKD患者钠的摄入量<2 g/d,相当于食盐摄入量<5 g/d。
其他微量元素的摄入按具体情况而定:根据体内钾水平调整钾的摄入,避免高钾血症和低钾血症的发生;限制磷的摄入,以防高磷血症;适当增加钙的摄入量,防止体内钙失衡;注意水溶性维生素的补充;发生贫血时可适当补铁等。
3 LPD实施中的要点
3.1 实际蛋白质摄入量的估算 CKD饮食治疗成功与否很大程度上取决于患者的依从性,实际蛋白质摄入量达标是LPD有效实施的重要保证。我国营养门诊目前通常使用饮食记录等非实验室检查方法计算DPI,准确性偏低,若采取单独称重、单独烹调的操作手段,对患者而言也比较麻烦,依从性、操作性较差,难以得到较为可信的数值。目前国际上常采用以下公式作为估算实际DPI的客观方法:eDPI(g/d)=6.25×〔24 h尿液中的尿素氮(24 h UUN)+0.031×体质量(BW)〕(24 h UUN以g为单位,1 mmol=0.028 g;BW以kg为单位)[43],可有效反映非透析CKD患者的实际DPI[44]。因此,在LPD实施过程中可运用上述公式了解CKD患者的实际蛋白质摄入情况,对患者进行更有针对性的饮食指导。
3.2 低蛋白食品的应用 LPD虽然限制了蛋白质的总摄入量,但为满足CKD患者对必需氨基酸的摄入,避免蛋白质营养不良,临床提倡在CKD患者的LPD实施中,优质蛋白质应占总蛋白质摄入量的50%以上。普通米面中的蛋白质生物价较低,属非优质蛋白质,一般为每100 g普通米面含7~10 g蛋白质。若全部食用普通米面,会被迫压缩优质蛋白质来源食物的摄入量,但主食又是饮食中能量的主要来源,因此,如何减少主食中的低生物价蛋白质的摄入非常重要。
用麦淀粉替代主食是目前国内较为常用的饮食治疗手段之一,优点在于经济、实惠,但由于麦淀粉的口味一般,麦淀粉主食的制作与烹调欠便捷,不利于患者长期坚持,医务工作者可加强在CKD患者中开展具有实际操作性的饮食宣教,包括如何便捷地制作各种不同形式的麦淀粉主食,提高麦淀粉饮食的接受度。
此外,低蛋白食品也是一种方便有效的工具,能保证充足的能量摄入,降低含氮废物的产生,是CKD患者营养安全和成功饮食治疗的基石[45-46]。国外(如日本、意大利等)市面上有多种针对CKD患者设计的特殊低蛋白食品(低蛋白米饭、低蛋白面包等),可辅助LPD实施,目前在我国可通过部分医院和网络途径购买到低蛋白大米、低蛋白面条等低蛋白食品,值得在CKD患者中推广。
3.3 营养状况的监测 维持和改善CKD患者的营养状况与长期预后的改善相关,因此,建议规律监测CKD尤其是中、晚期患者的营养状况(每1~3个月),应作为常规治疗的组成部分。当营养摄入明显不足,存在明显的PEM,或伴发加重营养不良的疾病时,营养状态的评估应更为频繁。常用的评价指标包括:生化指标、人体测量指标、饮食调查、主观营养评估(SGA)等。根据营养评估结果,及时发现所存在的问题,并做出调整。
3.4 长期持续正规的营养管理 CKD的营养管理是一项长期、繁复的工作,在我国目前的诊疗模式下,CKD治疗多限于肾脏疾病,缺乏让患者获得长期持续正规营养指导的途径,饮食宣教和管理常面临手段单一、不连续、没有后续支持等问题,难以满足营养管理的要求。CKD进展中由于代谢异常,往往伴随味觉、嗅觉和食欲的改变[47-48],可能影响患者的饮食,需要引起关注。一些CKD患者为降低蛋白质的摄入而盲目减少主食和肉类的摄入量,长期如此,对营养状况存在不利影响,生活质量较差,影响预后。良好的营养管理可帮助维持和改善患者的营养状况。因此,在LPD的实施中,临床医生和营养师要重视为CKD患者提供长期持续的营养指导、评估、调整和支持。
4 小结与展望
综上,控制良好的LPD对非透析阶段的CKD有积极作用,并且在营养和代谢上是安全的。但仍需要更多控制良好的研究探索LPD最佳的开始时间和DPI量,并为LPD的作用提供更可靠的证据。
根据目前的研究与指南提示,非透析CKD患者的LPD应包括:(1)合理质与量的蛋白质摄入:DPI控制在0.6~0.8 g·kg-1·d-1可能较为适宜,其中优质蛋白质占50%以上,采用更低DPI的饮食要注意酮酸制剂的补充;(2)充足能量:<60 岁者 35 kcal·kg-1·d-1,>60 岁者 30~35 kcal·kg-1·d-1;(3)限制钠(钠的摄入量<2 g/d,相当于食盐摄入量<5 g/d)并纠正其他微量营养素的平衡。此外,LPD实施中应重视:(1)利用Maroni公式监测患者的实际蛋白质摄入情况;(2)应用低蛋白食品作为辅助手段;(3)监测营养状况,防止营养不良;(4)长期持续正规的营养管理。
CKD的治疗需要临床医生与营养师的共同参与,更需要患者的重视与配合。笔者作为营养师,希望为CKD患者提供长期持续正规的营养管理,积极作用于疾病归转,希望本文能为营养师和临床医生对CKD患者制定和实施有效的饮食治疗计划提供参考。
作者贡献:王彦负责文章设计、文献检索、资料整理、文章撰写和修改;孙建琴负责审稿和校对,并对文章总体负责。
本文无利益冲突。

