两种不同类型门冬酰胺酶在成人急性淋巴细胞白血病治疗中的疗效观察
鲍颖,梁颜,何丽,代喆
(1.湖北医药学院附属襄阳医院,湖北 襄阳 441000;2.武汉大学中南医院内分泌科,湖北 武汉 430000)
急性淋巴细胞白血病(ALL)为临床常见一类血液系统恶性病变,其以淋巴细胞为来源,特征为外周及骨髓中原始及幼稚淋巴细胞显著增加,具有异质性[1]。VDLP化疗方案是ALL患者的一线标准诱导治疗方案[2]。门冬酰胺酶,可以通过消耗胞内门冬酰胺,阻碍蛋白及核酸合成,进而杀死肿瘤细胞,且其对淋巴细胞敏感性较高,而对正常细胞影响较小[3]。本研究旨在探讨和比较应用不同门冬酰胺酶的VDLP方案在ALL患者中的近期、远期疗效及安全性。
1 资料与方法
1.1一般资料前瞻性收集湖北医药学院附属襄阳医院血液科2010年1月至2012年1月确诊为ALL的成人患者95例。入选标准:(1)年龄范围为18~70岁;(2)首次确诊为ALL且既往未行相关治疗者;(3)住院评估后拟行VDLP方案化疗者;(4)均签署了研究知情同意书。本研究得到了湖北医药学院附属襄阳医院医学伦理委员会批准。排除标准:(1)合并有其它系统恶性肿瘤者;(2)拟行VDLP化疗方案前已存在肝、肾、心、肺等脏器功能指标异常者;(3)伴颅脑器质性病变及精神疾患者;(4)各种原因所致未能将化疗方案完成者。
所有入组患者的ALL确诊依据患者的症状、血液常规、骨髓形态学、病理、免疫学、分子生物学等综合因素,诊断、分型、治疗和预后评估均采用2012年版中国成人ALL诊治专家共识[4]。VDLP方案为:长春新碱(或长春地辛)+柔红霉素(或去甲氧柔红霉素)+门冬酰胺酶[培门冬酶(PEG-Asp)或左旋门冬酰胺酶(L-Asp)]+泼尼松。诱导治疗之后,巩固治疗采用Hyper A/B方案交替。对于Ph染色体阳性者,添加伊马替尼或达沙替尼等常规络酪氨酸激酶抑制剂。此外,严格按照诊治规范对入组患者的中枢神经系统进行排查、防治。
1.2研究方法入组患者根据治疗方案的不同采用随机数字表法分为A组(PEG-Asp的VDLP方案)52例和B组(L-Asp的VDLP方案)43例。整个治疗过程中均予相应的对症支持治疗,如用药过程出现胰腺炎、肝损伤时,予抑酸、生长抑素、保肝等;化疗骨髓抑制出现中性粒细胞缺乏时予预防感染等。入组患者治疗后均予门诊、住院及电话随访,随访时间终点为5年。
1.3检测指标基线资料及ALL病情相关指标:白细胞、血小板、血红蛋白、骨髓原始幼稚细胞比例、形态、免疫、分子生物学等相关指标。
疗效评估:诱导治疗过程、诱导结束、维持治疗过程中对骨髓原始、幼稚细胞比例等相关指标复查,严格依据中国成人ALL专家共识评估疗效,并通过门诊、住院及电话进行随访跟踪,评估患者的总生存时间(OS)及无复发生存时间(RFS)。我们定义OS为:从确诊到随访结束或患者死亡的时间,RFS定义为从首次缓解到随访结束或患者复发、死亡的时间。
不良反应评估:化疗前、化疗过程中对患者的血常规、生化、肝肾功能、凝血功能、心肌酶谱、感染等指标进行复查、监测,评估治疗过程中的不良反应发生情况。

2 结果
2.1两组基线资料比较两组基线资料及初发病情组间比较均差异无统计学意义(P>0.05)。见表1。
2.2两组近期疗效比较两组近期疗效指标包括完全缓解率及完全缓解时间组间比较均差异无统计学意义(P>0.05)。见表2。
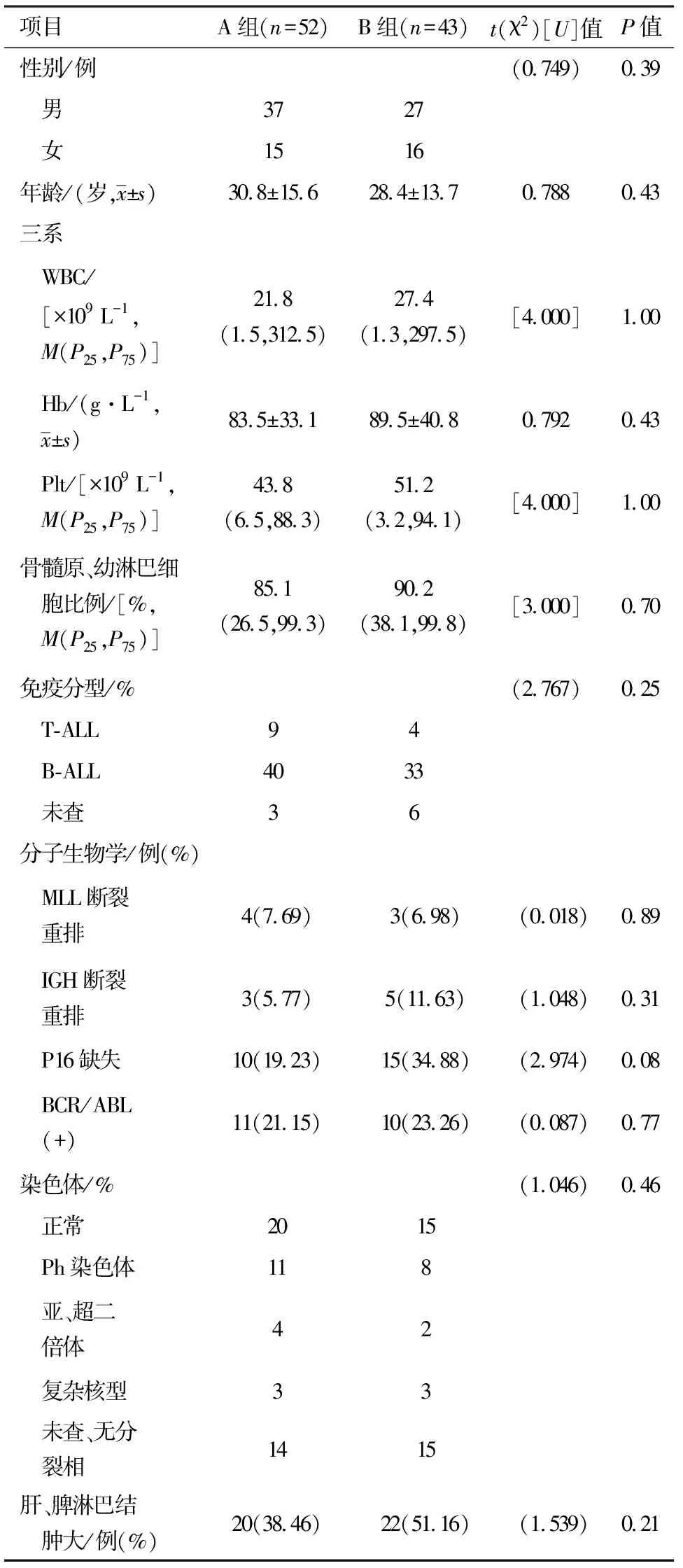
表1 两组基线资料及初发病情比较
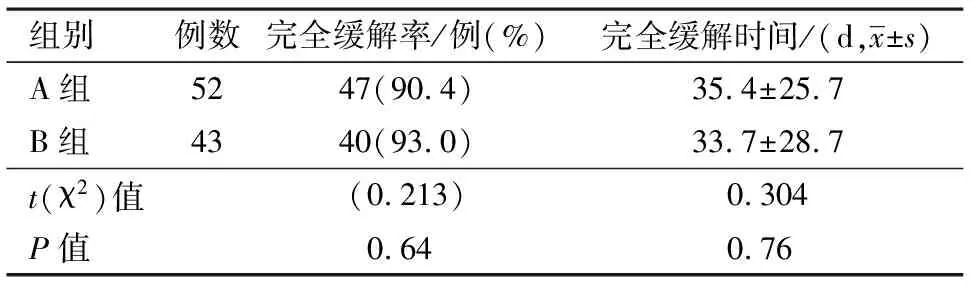
表2 两组近期疗效比较
2.3两组远期疗效比较两组OS及RFS曲线结果见图1和图2,log-rank比较分析提示两组5年OS(32.7% 比 37.2%;HR:1.146,95%CI:0.321~1.532;P=0.60)及RFS(26.9% 比 30.2%;HR:1.091,95%CI:0.668~1.781;P=0.73)比较均差异无统计学意义(P>0.05)。
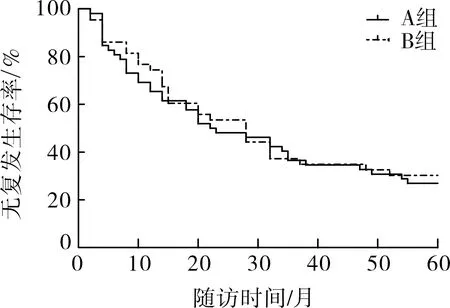
图2 两组RFS比较
2.4两组不良反应比较A组过敏反应发生率显著低于B组(P<0.05),而两组其余不良反应发生率均差异无统计学意义(P>0.05)。见表3。
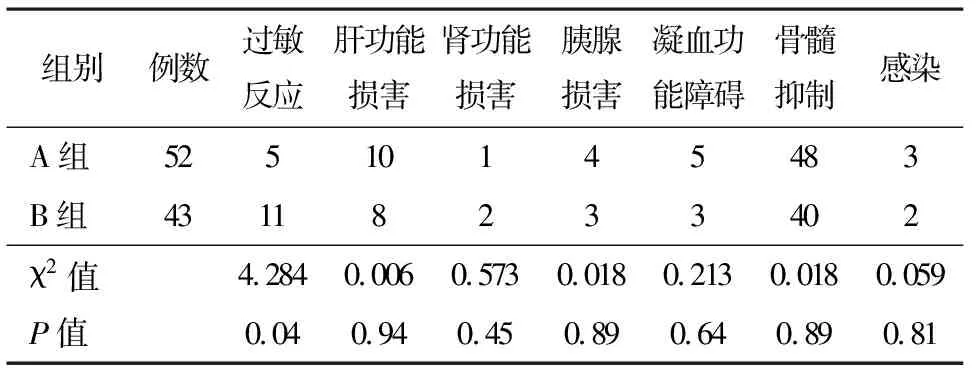
表3 两组不良反应比较/例
3 讨论
目前临床在MICM分型基础上的个体化综合诊治策略已极为有效地改善了ALL的治疗效果,患者总体生存率、无疾病进展生存率显著延长,预后明显改善[5]。临床上成人ALL的诱导缓解常用多种药物联合化疗,VDLP方案是其一线诱导方案[6]。近些年来很多研究表明门冬酰胺酶在恶性淋巴瘤、ALL中的疗效显著,采用门冬酰胺酶治疗的儿童、成人ALL患者预后明显改善,可提高儿童10%~15%的无疾病进展生存时间[7]。门冬酰胺酶的肿瘤细胞杀伤机制主要为促进细胞内门冬酰胺分解成门冬氨酸,进而对肿瘤细胞中的蛋白及核酸合成进行抑制[8]。
本研究比较了培门冬酶PEG-Asp和左旋门冬酰胺酶L-Asp两种不同门冬酰胺酶在ALL中的疗效。表1可见两组患者的基线资料、病情相关指标组间比较均差异无统计学意义,确保了两组患者具有可比性。我们比较了两组患者的近期治疗疗效,包括诱导缓解率和完全缓解时间,结果发现两组差异无统计学意义,提示两种门冬酰胺酶在ALL患者中的近期疗效差异无统计学意义。随后,我们比较了该两种门冬酰胺酶对ALL患者的远期疗效影响,图1和图2可见两组患者的5年总生存期OS和5年无疾病进展生存期RFS均差异无统计学意义,提示两种门冬酰胺酶对ALL患者的远期疗效影响也差异无统计学意义。最后,针对两种不同VDLP方案的安全性我们进行了比较,结果发现A组患者的过敏反应发生率明显更低,而肝损、肾损、凝血障碍、骨髓抑制等其他不良反应均差异无统计学意义。我们考虑这与L-Asp来源欧文氏菌或大肠杆菌未经修饰的酶,免疫原性较强有关[9]。有研究指出过敏反应可能导致机体门冬酰胺酶抗体增加,使得药物体内清除加快,故而可影响其抗肿瘤药效[10]。而PEG-Asp相较于L-Asp,免疫原性则明显降低,过敏反应发生率明显下降,此外,再加上PEG-Asp使用更为方便且作用时间更长[11],故而本研究建议ALL的诱导缓解治疗可首选PEG-Asp。但此结论还需大样本的临床及基础进一步研究来证实。
综上所述,本研究发现PEG-Asp及L-Asp两种不同VDLP方案在ALL患者中近期、远期疗效相当,但PEG-Asp过敏反应率更低,有较高的临床应用价值。

