肌壁大部切除-子宫重建术联合左炔诺孕酮宫内缓释系统治疗中重度子宫腺肌病的疗效及对卵巢功能的影响
王慧丽,范晓芳,张琳
(上海市普陀区妇婴保健院,上海 200062)
子宫腺肌病(Adenomyosis,ADE)是子宫内膜腺体和间质侵入子宫肌层形成弥漫或局限性的病变,发病率约10%,是妇科常见病。以痛经、经量多以及经期长为主要表现,严重影响患者的身心健康及生活质量[1]。传统的治疗方法是子宫全切术,但切除子宫对部分患者的生理、心理会有不同程度的影响。肌壁大部切除-子宫重建术(Major uterine wall resection and reconstruction of the uterus,MURU)联合左炔诺孕酮宫内缓释系统(商品名为曼月乐Mirena,MIR)是治疗ADE的新方法[2]。国外有研究表明,MURU联合MIR治疗ADE效果较好[3]。但MURU治疗ADE的同时切除了较多子宫组织,子宫组织的减少可能会影响子宫与卵巢之间的血液供应关系,从而影响卵巢的功能。因此,本文拟在探讨MURU联合MIR治疗中重度ADE的临床疗效的同时,研究MURU联合MIR对患者卵巢功能产生的影响,为MURU联合MIR的推广运用提供科学依据。
1 资料与方法
1.1一般资料研究对象为2014年1月至2016年1月在上海市普陀区妇婴保健院治疗的中、重度ADE患者60例。患者均为女性;年龄(38.14±9.13)岁,年龄范围为30~48岁。按照随机数字表法,60例患者被随机分为观察组和对照组,各30例。纳入标准:妇科检查、阴道彩超及血清糖类抗原125(CA125)水平检测确诊为ADE,且患者均有痛经史。排除标准:恶性肿瘤患者;无法随访者;按彩超所测腺肌瘤最大直径或子宫单侧肌壁厚度将ADE患者分为轻、中、重度。轻度ADE:肌壁厚度或腺肌瘤最大直径<35 mm;中度ADE:肌壁厚度或腺肌瘤最大直径为35~49 mm;重度ADE:肌壁厚度或腺肌瘤最大直径≥50 mm[4]。两组患者在性别、年龄、病情等基本资料方面,均差异无统计学意义(P>0.05)。此次研究经医院伦理委员会审核批准,所有受试对象知情同意。
1.2治疗方法观察组行MURU+ MIR(德国拜耳制药公司,生产批号TU00RH1),手术过程参考文献[4],对照组行MURU+术后注射醋酸亮丙瑞林微球(促性腺激素释放激素激动剂,GnRHa,上海丽珠制药有限公司,生产批号140402)。 MURU手术方法同样参考文献[4],醋酸亮丙瑞林微球注射方法:在月经第1天前臂皮下注射,每次3.75 mg,每28天注射1次,连续3个周期。治疗后定期随访。
1.3观察指标分别于术前、术后6月、12月时评估患者的痛经症状、经量评分、CA125、子宫体积、血清抗缪勒氏管激素(anti-Mullerian hormone,AMH)值。
1.3.1痛经症状 痛经评分采用视觉模拟评分法(visual analogue scale,VAS) 评分标准[5]。在纸上划一条10 cm的横线,横线的一端为0,表示无痛;另一端为10,表示剧痛;中间部分表示不同程度的疼痛。让患者根据自我感觉在横线上划一记号,表示疼痛的程度,分数越高表示越疼痛。
1.3.2经量评分 月经量采用月经失血图法(pictorial blood loss assessment chart,PBAC法)[6],轻度:血染面积占卫生巾面积的比例<1/3,中度:血染面积占卫生巾面积的比例为1/3~3/5,重度:血染整个卫生巾;轻度、中度、重度的评分依次为1分、5分、20分。记录每张卫生巾的评分、数量及天数后计算PBAC评分,评分越髙表明月经量越多。
1.3.3CA125与子宫体积 采用放射免疫分析法检测患者的CA125。根据公式V=π/6×a×b×c计算子宫体积,V表示体积,a、b、c为超声所测的子宫长径、横径、厚度。
1.3.4血清AMH 抽取观察组和对照组术前、术后6月、12月静脉血约5 mL,运用离心机离心(3 000 r·min-1离心11 min),提取上层血清后置-70 ℃条件下备用,采用酶联免疫吸附测定法(ELISA)检测AMH水平。

2 结果
2.1两组痛经评分及经量评分比较观察组与对照组术后6月、12月痛经评分及经量评分均比术前降低,均差异有统计学意义(均P<0.05);两组的痛经评分及经量评分术前比较,均差异无统计学意义(均P>0.05)。两组术后6月、12月痛经评分均为0分,观察组术后6月、12月的经量评分均比对照组的评分低,均差异有统计学意义(均P<0.05)。见表1。
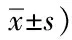
表1 两组痛经评分及经量评分比较/(分,
注:整体分析为两因素重复测量方差分析。组间比较为成组t检验,两组比,aP<0.05。时间两两比较为Dunnett-t检验,和术前比,bP<0.05
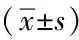
表2 两组术前术后CA125、子宫体积及血清AMH比较
注:整体分析为两因素重复测量方差分析。组间比较为成组t检验,两组比,aP<0.05。时间两两比较为Dunnett-t检验,和术前比,bP<0.05
2.2两组CA125与子宫体积比较观察组与对照组术后6月、12月CA125与子宫体积均比术前降低,均差异有统计学意义(均P<0.05);两组的CA125与子宫体积术前比较,均差异无统计学意义(均P>0.05)。观察组术后6月、12月的CA125与子宫体积均比对照组低,均差异有统计学意义(均P<0.05)。见表2。
2.3两组患者血清AMH比较观察组与对照组自身术前与术后6月、12月血清AMH比较,均差异无统计学意义(均P>0.05)。分别将两组患者血清AMH比较,观察组血清AMH术前、术后6月、术后12月分别与对照组血清AHM术前、术后6月、术后12月比较,均差异无统计学意义(均P>0.05)。见表2。
3 讨论
对ADE患者的治疗,传统的治疗方法是子宫全切术,但切除子宫对部分患者的生理、心理会有不同程度的影响。临床上也有药物保守疗法,但存在治疗不彻底和易复发的问题。近几年,国内外有研究表明[3,7],MURU联合MIR治疗ADE效果较好。
本研究中,观察组与对照组术后6月、12月痛经评分及经量评分均比术前降低(均P<0.05);两组术后6月、12月痛经评分均为0分,且观察组术后6月、12月的经量评分均比对照组的评分低(均P<0.05)。与陈小媚等[8]的研究结果一致。ADE患者有痛经症状是由于子宫病灶的反复出血和纤维化,而经量增多主要是因为内膜面积增大和肌壁对血管的钳闭作用减弱或消失[9]。本研究中观察组与对照组经过MURU后,痛经症状消失,经量减少,主要是因为MURU切除了病灶缩小了宫腔。观察组MURU联合MIR后比对照组MURU联合术后注射GnRHa经量减少更明显,其原因可能是MIR中的左炔诺孕酮也可以减少经量[10],它在患者子宫中维持较高的浓度,持续作用于子宫内膜,从而缓解子宫内膜的病理状态[11]。虽然GnRHa通过刺激黄体生成素和促卵泡激素的释放,从而使卵巢激素水平明显下降,出现暂时性闭经,缩小子宫体积,缓解痛经。但此药物不能在患者体内一直维持较高浓度,且停止药物注射后,患者症状有可能反弹[12]。本研究中,观察组与对照组术后6月、12月CA125与子宫体积均比术前降低(均P<0.05);观察组术后6月、12月的CA125与子宫体积均比对照组低(均P<0.05)。与赵菁等[7]的研究结果相似。观察组与对照组经MURU后,子宫体积均变小。但观察组子宫体积比对照组的下降更多,其可能原因是,MURU切除范围较广,在切除子宫内膜病灶时,可能有肉眼不易发现的病灶残留,而MIR在宫内可缩小子宫残留病灶的体积[13]。
虽然MURU并未破坏子宫的滋养血管,但切除了较多子宫组织,这可能会导致子宫内部血流的重新分配,进而可能会影响子宫与卵巢之间的血液供应关系,从而影响卵巢的功能。因此,本文在探讨MURU联合MIR治疗中重度ADE的临床疗效的同时,研究MURU联合MIR对患者卵巢功能产生的影响。AMH是一种单糖蛋白,研究表明[14],血清 AMH 可较好的反映卵巢功能,且不受卵巢周期性变化的影响。由于其可以比FSH、LH等预测指标更好的诊断早期卵巢衰竭,故此次研究采用AMH值反映卵巢功能。本研究中发现,观察组与对照组自身术前与术后6月、12月血清AMH比较,均差异无统计学意义(均P>0.05)。观察组血清AMH术前、术后6月、术后12月分别与对照组血清AHM术前、术后6月、术后12月比较,均差异无统计学意义(均P>0.05)。表明MURU联合MIR不会影响患者卵巢功能,与牟萌[15]的研究结果一致。MUEU并未对卵巢造成直接的物理性损伤;且手术虽然改变了子宫内部解剖结构,使血流重新分配,但子宫与卵巢之间存在大量的侧支循环。所以,MURU虽然改变了子宫与卵巢间的血流平衡,但不会使卵巢因缺血而影响其功能[16]。有研究也表明,宫内放置MIR不影响卵巢功能[17]。
综上所述,MURU联合MIR治疗中重度ADE的临床疗效好,且MURU联合MIR短期内不影响患者的卵巢功能。

