脑缺血后处理通过调控细胞周期改善大鼠缺血性脑卒中损伤
刘 瑶 韩 影 赵雅宁 周 娜 (华北理工大学护理与康复学院,河北 唐山 063000)
缺血性脑卒中是临床的常见病和多发病。脑缺血后处理(CIP)是指在缺血再灌注后一定时间内,给予1次或多次短暂性缺血再灌注,使组织对缺血产生耐受性〔1〕。CIP是缺血再灌注损伤较有力的内源性保护机制,在临床上缺血性心、脑及外周血管疾病的防治具有良好的应用前景。细胞周期指连续分裂的细胞从上一次有丝分裂结束开始到下一次有丝分裂结束为止所经历的整个序列过程。张贵斌等〔2〕在脑缺血再灌注大鼠模型中发现细胞周期参与神经元坏死的过程。已有研究发现CIP可通过调节细胞周期调控因子的表达,修复损伤的心肌组织〔3〕。但CIP对中枢神经系统的保护作用是否与调控细胞周期有关,目前报道甚少。细胞周期蛋白(Cyclins)和细胞周期蛋白依赖激酶(CDKs)是细胞周期调控的关键成分,CyclinD1和CDK4的表达是评估缺血神经元是否进入病理状态细胞周期的关键指标〔4〕。本文通过检测 CyclinD1和CDK4的表达,探究CIP脑保护的作用,为缺血性脑卒中的治疗提供理论依据和实验基础。
1 材料与方法
1.1 动物与分组 清洁级健康雄性SD大鼠96只,体质量300~350 g,购自北京维通利华实验动物中心,于华北理工大学医学实验中心饲养。在模型制造之前让大鼠适应7 d环境,自由进食饮水,温度22~26℃,湿度40%~70%,空气压力梯度20 Pa。将96只大鼠采用随机数字法分为假手术组(Sham组)、脑缺血再灌注模型组(CIR组)、CIP组。
1.2 主要试剂 CyclinD1兔抗鼠多克隆抗体、CDK4兔抗鼠多克隆抗体和二抗(山羊抗兔)由武汉博士德生物工程有限公司提供,Nikon摄影生物光学显微镜购自日本株式会社尼康,伯乐电泳转印系统、凝胶成像系统来自美国Bio-Rad公司。
1.3 动物模型制作 使用四血管闭塞法(4-VO)〔5〕制作全脑缺血再灌注模型。动物常规麻醉,颈正中切口,分离双侧颈总动脉,并分别置线标记备用。其后将大鼠枕后部正中切开,暴露双侧第一颈椎横突翼孔,热凝其下通过的椎动脉,电凝每次时间2~4 s,将翼小孔后双侧椎动脉永久闭塞。常规消毒缝合伤口,单独放回笼中,造模后24 h,在大鼠清醒状态下夹闭两侧的颈动脉20 min,实行再灌注,最后完成缝合。CIP组大鼠首先同CIR组大鼠采用改良的Pulsinelli 4-VO制作大鼠全脑缺血模型,实现永久再灌注之前,进行松开动脉夹15 s,再夹闭15 s,如此进行3次缺血/再灌注循环,实现CIP。Sham组分离暴露血管,但不电凝椎动脉、不夹闭颈总动脉。缺血再灌注后6、24、48、72 h进行苏木素-伊红(HE)染色免疫组化染色及Western印迹检测。
1.4 水迷宫检测 Morris水迷宫是检测空间学习记忆功能的一种常用方法。需要对大鼠进行训练,每日2~3次,连续3 d,每次训练将大鼠面向池壁依次从4个象限的固定入水点放入水中,训练其通过空间标志物寻找平台的能力。正式试验时往水池内注水使平台藏于水面下方,再从某一个象限放大鼠进水池。电脑追踪记录大鼠从入水到登上站台所需要的时间(潜伏期)和穿过平台的次数以观察其对平台的记忆。设定1次游泳时间90 s,如果大鼠超过这个时间没有找到隐藏在水下的平台,将其引导至站台,熟悉30 s。根据计算机的记录仪记录大鼠游泳的轨迹、逃避潜伏期及穿台次数,并求各组均值。
1.5 HE染色 各组各时间点4只大鼠,规定时间以0.4%戊巴比妥钠麻醉大鼠后,开胸、暴露心脏,4%多聚甲醛行心脏灌流,断头取脑,4℃冰箱放置至少24 h。在视交叉后1~6 mm处冠状面切开,取中间块入4%多聚甲醛固定液固定,石蜡包埋,连续冠状切片,每只动物取5张海马区切片,片厚4 μm。切片常规脱蜡至水,HE染色。选用Motic-6.0图像采集及分析系统来计算每个视野的存活的神经元数,以平均细胞存活密度(存活细胞数量与总细胞数量比值)表示。
1.6 免疫组化染色 常规麻醉动物,开胸用4%多聚甲醛行心灌流,断头取脑,在视交叉后1和6 mm处冠状面切开,取中间块入4%多聚甲醛固定液固定,石蜡包埋,切片(片厚5 μm)。切片常规脱蜡至水,然后滴加一抗(CyclinD:1 ∶200;CDK4:1 ∶200),湿盒中 4℃过夜,滴加二抗,37℃恒温箱内孵育1 h;二氨基联苯胺(DAB)显色,脱水、透明、封片。光学显微镜(10×40倍)下观察并计数组织中阳性细胞数,每个标本取5张切片,每个切片随机选取不重复的视野3~5个,计数各个视野下的阳性细胞数量。
1.7 Western印迹检测 处死大鼠后,迅速取双侧海马区组织,4℃磷酸盐缓冲液(PBS)充分洗涤,加入单去污剂裂解液(含PMSF)提取蛋白,4℃、12 000 r/min离心15min取上清。二喹啉甲酸(BCA)法测定蛋白浓度,将蛋白标准配制液0.8 ml和BSA蛋白标准混合配制成浓度为25 mg/ml的蛋白标准液。根据电脑绘制的标准曲线计算待测蛋白的浓度。100 g/L十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,封闭液中封闭至少1 h,加入 CyclinD1、CDK4(1∶500)与actin(1∶1 000)的一抗,4℃孵育过夜,TBST洗膜,加二抗(1∶800),37℃ 孵育 1 h,TBST 洗膜,电化学发光(ECL)显色,采用数码成像分析系统软件分析各因子的平均灰度值,将目的因子和内参的平均灰度值的比值进行比较。
1.8 统计学方法 应用SPSS19.0软件进行单因素方差分析。
2 结果
2.1 各组水迷宫检测结果 与Sham组比较,CIR组在72 h的逃避潜伏期时间明显延长、穿台次数明显减少,差异有统计学意义(P<0.05);与CIR组比较,CIP组相应时间点的潜伏期明显缩短、穿台次数明显增加,差异有统计学意义(P<0.05)。见表1、图1。
表1 各组水迷宫潜伏期和穿台次数比较(,n=12)

表1 各组水迷宫潜伏期和穿台次数比较(,n=12)
与Sham组比较:1)P<0.05;与CIR组比较:1)P<0.05;下表同
组别 潜伏期(s) 穿台次数(次)Sham 组 20.02±0.24 12.87±1.30 CIR 组 62.03±1.421) 2.97±1.261)CIP 组 45.96±1.461)2) 6.59±0.671)2)
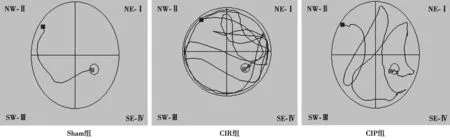
图1 水迷宫检测各组大鼠学习记忆功能
2.2 各组海马区神经元形态学变化 Sham组海马区神经元结构完好、胞质淡染而均匀;CIR组海马区神经元细胞核有明显的固缩、碎裂征象,间质水肿,与Sham组比较,CIR组各时间点神经细胞存活率显著降低(P<0.05);CIP组各时间点神经元形态损伤程度减轻,胞质淡染,细胞核变性减轻,与CIR组比较,CIP组在各时间点存活神经元细胞数量增多(P<0.05)。见表 2,图 2。
2.3 各组海马区CyclinD1免疫组化和Western印迹结果 免疫组化结果:CyclinD1阳性产物呈棕黄色染色,表达在细胞核中,Sham组偶见阳性细胞,CIR、CIP组有不同程度的阳性产物表达量,且随时间阳性细胞逐渐增多,72 h达高峰。与Sham组比较,CIR组在各时间点CyclinD1的阳性细胞数显著增加(P<0.05);与CIR组比较,CIP组相应时间点 CyclinD1阳性细胞数量显著降低(P<0.05)。见图3,表3。
表2 各组海马区神经元存活率比较(,%,n=12)

表2 各组海马区神经元存活率比较(,%,n=12)
组别 6 h 24 h 48 h 72 h Sham 组 98.41±1.00 98.10±1.22 97.60±1.48 97.59±1.47 CIR 组 76.25±1.131)69.14±1.631)61.99±1.611)54.19±1.751)CIP 组 87.06±0.911)2)79.63±1.531)2)70.10±1.681)2)63.98±1.361)2)

图2 各组24 h海马区神经元形态结构变化(HE,×400)

图3 各组24 h海马区CyclinD1免疫组化染色结果(DAB,×400)
表3 各组海马区CyclinD1阳性细胞数比较(,个/高倍镜视野,n=12)
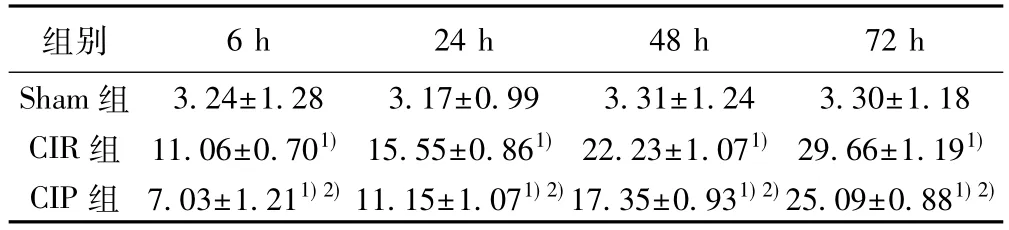
表3 各组海马区CyclinD1阳性细胞数比较(,个/高倍镜视野,n=12)
组别 6 h 24 h 48 h 72 h Sham 组 3.24±1.28 3.17±0.99 3.31±1.24 3.30±1.18 CIR 组 11.06±0.701)15.55±0.861)22.23±1.071)29.66±1.191)CIP 组 7.03±1.211)2)11.15±1.071)2)17.35±0.931)2)25.09±0.881)2)
Western印迹分析结果:Sham组CyclinD1蛋白表达量较低,而CIR、CIP组随时间延长表达量逐渐增加,72 h达高峰。与Sham组比较,CIR组在各时间点CyclinD1蛋白表达显著增加(P<0.05);与CIR组比较,CIP组在相应时间点CyclinD1蛋白表达显著降低(P<0.05)。见表 4,图 4。
表4 各组海马区CyclinD1蛋白水平比较(,n=12)

表4 各组海马区CyclinD1蛋白水平比较(,n=12)
组别 6 h 24 h 48 h 72 h Sham 组 0.26±0.04 0.27±0.05 0.26±0.07 0.27±0.06 CIR 组 0.58±0.061) 0.75±0.091) 0.84±0.081) 0.89±0.091)CIP 组 0.35±0.081)2)0.43±0.091)2)0.56±0.061)2)0.63±0.071)2)
2.4 各组海马区CDK4免疫组化和Western印迹结果
免疫组化结果:CDK4阳性产物表达在细胞核中,呈棕黄色染色,Sham组偶见阳性细胞,CIR、CIP组有不同程度的阳性产物表达量,且随时间延长阳性细胞逐渐增多,72 h达高峰。与Sham组比较,CIR组在各时间点CDK4阳性细胞数量明显增加(P<0.05);与CIR组比较,CIP组相应时间点CDK4阳性细胞数量明显降低(P<0.05)。见表 5,图 5。
图4 Western印迹检测各组基底动脉CyclinD1的表达
Western印迹分析结果:Sham组CDK4蛋白量较少,而CIR、CIP组随时间延长表达量逐渐增加,72 h达高峰。与sham组比较,CIR组在各时间点CDK4蛋白表达显著增加(P<0.05);与CIR组比较,CIP组相应时间点CDK4蛋白表达水平显著降低(P<0.05)。见表 6,图 6。
表5 各组大鼠海马区CDK4阳性细胞数比较(,个/高倍镜视野,n=12)

表5 各组大鼠海马区CDK4阳性细胞数比较(,个/高倍镜视野,n=12)
组别 6 h 24 h 48 h 72 h Sham 组 3.30±0.73 3.25±1.41 3.40±1.76 3.45±1.57 CIR 组 10.10±1.551)16.45±1.261)23.60±1.311)29.60±2.081)CIP 组 5.80±1.421)2)11.40±1.351)2)19.25±1.031)2)25.45±1.251)2)

图5 各组24 h海马区CDK4免疫组化染色结果(DAB,×400)
表6 各组大鼠海马区CDK4蛋白水平比较(,n=12)

表6 各组大鼠海马区CDK4蛋白水平比较(,n=12)
组别 6 h 24 h 48 h 72 h Sham 组 0.20±0.04 0.23±0.03 0.22±0.04 0.22±0.06 CIR 组 0.50±0.091) 0.65±0.051) 0.73±0.071) 0.86±0.091)CIP 组 0.29±0.071)2)0.38±0.061)2)0.42±0.091)2)0.51±0.081)2)

图6 Western印迹检测各组基底动脉CDK4的表达
3 讨论
CIP指在再灌注开始时对阻塞的血管进行短暂、重复的开通及再闭,随后恢复血管血流的再通。CIP在心血管领域的研究已表明可以减少缺损面积,并已尝试将其应用于临床工作〔6〕。CIP的作用随着研究的不断深入在不同动物的肺、肾、肝等均得到证实〔7~9〕。2006年Zhao等〔10〕发现CIP具有促进神经功能恢复,保护脑功能的作用。本研究结果说明CIP对缺血性脑卒中起到了良好的保护作用。CIP作为一种内源性保护机制,脑保护作用机制广泛而复杂,对其机制研究已在多个水平上进行了相当多的工作,已发现CIP与避免氧自由基的过度产生、线粒体钙超载、细胞外信号调节蛋白激酶信号通路等有关〔11~13〕。但是否还可以通过诱导细胞增殖,修复受损的海马组织尚不清楚。
细胞周期分为G1期、S期、G2期、M期。细胞的发生发育有赖于细胞周期的正常运行,细胞周期是细胞分化与增殖的内在组分。细胞周期的进程主要是通过Cyclins和CDKs的调控而实现〔14〕。Cyclins在脑缺血中均有异常表达,而CDK4在脑缺血损伤中具有重要作用,抑制它的活性具有显著的神经保护作用。Trimsit等〔4〕研究发现脑缺血后半暗带神经元内 CyclinD1和CDK4的表达是评估缺血神经元是否再次进入细胞周期的关键标志。目前认为,CyclinD1/CDK4主要参与以非兴奋性毒性为主的缺血/缺氧引起的神经死亡过程。CyclinD是联系细胞微环境和细胞周期的纽带。CDK具有催化底物磷酸化的活性,其主要作用是调控细胞周期的不同时相,从G1、S、G2到M期,完成循环。Katchanov等〔15〕研究发现在脑缺血再灌注大鼠模型中,内源性CDKI p16INK4a的缺失可导致纹状体神经元迟发性死亡;表明细胞周期与神经元损伤之间存在联系。本研究结果说明CIP可能是通过降低全脑缺血大鼠海马区CyclinD1、CDK4的表达从而起到调控细胞周期而保护神经元的作用。缺血性脑卒中后细胞周期出现紊乱,与产生大量氧自由基、出现氧化应激有关。刘静〔16〕对人胃黏膜细胞(GES)-1细胞加用抗氧化剂后,细胞内活性氧减少,氧化应激降低同时缓解了细胞周期阻滞现象。而缺血后处理的重要保护机制抑制即为氧自由基的堆积,维持活性氧清除系统的平衡〔17〕。本研究结果提示,CIP可能是通过抑制氧化应激而下调细胞周期因子CyclinD1和CDK4蛋白的表达,从而实现对细胞周期的调控。
综上,CIP在脑缺血再灌注损伤后加速神经细胞再生修复的机制可能与影响Cyclin及CDKs的表达有关,从促进细胞周期进展进而加快神经细胞再生修复的途径切入,为脑缺血再灌注损伤的防治提供新思路。

