老年脑恶性胶质瘤患者血清TGF-β和GFAP的表达及与临床预后的关系
张极星 张淑荣 赵 亮 黄丽娟 王占强 高凤全 (齐齐哈尔医学院附属第三医院神经外科,黑龙江 齐齐哈尔 6000)
脑胶质瘤约占颅脑肿瘤的60%,在颅脑各部位均可能发生。近年来老年患者的发病率逐年增加,且老年患者身体各项功能下降明显,化疗耐受力较差,常出现意识障碍、高热、肺部感染等并发症,预后较差〔1〕。根据世界卫生组织(WHO)分级将脑胶质瘤分为Ⅰ~Ⅳ级,其中Ⅲ~Ⅳ级为脑恶性胶质瘤〔2〕。手术是临床治疗脑恶性胶质瘤的关键,手术后同步进行放化疗具有较好的临床疗效,能有效改善患者的预后〔3〕。治疗后应及时随访患者的情况,观察是否存在复发的风险,进而及早进行干预延长患者的生命〔4〕。然而,术后病理组织取材较麻烦,因此寻找血清学标志物来监测患者的预后具有重要意义。血清胶质纤维酸性蛋白(GFAP)是一种星形胶质细胞的标志蛋白,当中枢神经系统损伤时会表达升高,脑胶质瘤患者GFAP也会明显升高,且具有较高的特异性〔5〕。转化生长因子(TGF)-β与多种肿瘤发生和发展存在较大关系,与脑恶性胶质瘤的发生、发展也存在一定关系〔6,7〕。本研究旨在分析脑恶性胶质瘤患者血清TGF-β和GFAP的表达及其与临床预后的关系。
1 资料与方法
1.1 一般资料 2011年1月至2014年1月选取齐齐哈尔医学院第三附属医院进行治疗的老年脑胶质瘤患者70例作为研究组。纳入标准:①年龄≥60岁;②均经病理确诊为脑胶质瘤;③分级为Ⅲ~Ⅳ级;④患者及家属均知情同意。排除标准:①不能耐受手术者;②术后未接受放化疗者;③存在其他部位恶性肿瘤者。研究组男37例,女33例,年龄60~78岁,平均(67.3±3.5)岁,随访3年,根据患者生存期分为预后良好组25例(生存期≥3年)和预后不良组45例(生存期<3年)。另选取健康体检者60例为对照组,其中男32例,女28例,年龄61~78岁,平均(66.9±3.2)岁。各组一般资料比较差异均无统计学意义(均P>0.05)。本研究经医学伦理委员会批准。
1.2 方法 所有患者行手术治疗,手术后2~4 w开始进行放化疗治疗,放化疗前行CT检查定位,根据手术残留肿瘤及术前水肿情况进行放疗治疗,给予电子直线加速器6MVX进行曲线60 Gy/30 F 95%剂量照射,2 Gy/次,每天1次,每周照射5 d,连续治疗6 w;放疗2 w后进行序贯化疗,口服替莫唑胺(江苏天士力帝益药业有限公司,国药准字H20040637,规格:50 mg)150~200 mg/m2,每天 1次,每周治疗5 d,4 w 为 1个疗程,共化疗6个疗程。
1.3 疗效评价标准 近期疗效采用WHO制定的实体瘤疗效评价标准进行判定,完全缓解(CR):病灶消失且无新的病灶出现,维持时间超过4 w;部分缓解(PR):病灶缩小50%以上且无新的病灶出现,维持时间超过4 w;稳定(SD):病灶缩小不足50%或增大不足25%,且无新的病灶出现;进展(PD):病灶增大超过25%或有新的病灶出现。
1.4 观察指标 术前、术后1 w、放化疗后清晨抽取两组空腹静脉血3 ml,3 000 r/min离心10 min,分离血清后放置在-20℃环境中待用。血清TGF-β、GFAP水平采用双抗体夹心法检测,应用上海生物技术有限公司提供的试剂,严格根据试剂说明进行操作。比较各组TGF-β、GFAP水平。放化疗结束后1个月分析不同疗效等级患者血清TGF-β、GFAP的差异。
1.5 统计学方法 应用SPSS17.0软件进行t检验、单因素方差分析。
2 结果
2.1 两组TGF-β、GFAP水平比较 研究组术前TGF-β、GFAP水平均明显高于对照组,差异有统计学意义(P<0.05),见表1。
2.2 研究组不同时期TGF-β、GFAP水平比较 术后1 w TGF-β、GFAP水平显著低于术前,放化疗后显著低于术后1 w(P<0.05),见表1。
2.3 不同预后患者TGF-β、GFAP水平比较 预后良好组TGF-β、GFAP水平显著低于预后不良组,差异有统计学意义(P<0.05),见表2。
2.4 不同疗效等级患者血清TGF-β、GFAP水平比较研究组CR 30例,PR 15例,SD 14例,PD 11例。不同疗效等级患者血清TGF-β、GFAP水平整体比较差异有统计学意义(P<0.05);CR、PR、SD、PD患者血清TGF-β、GFAP水平呈增高趋势,两两比较差异均有统计学意义(P<0.05),见表3。
表1 两组TGF-β、GFAP水平比较(ng/L,)
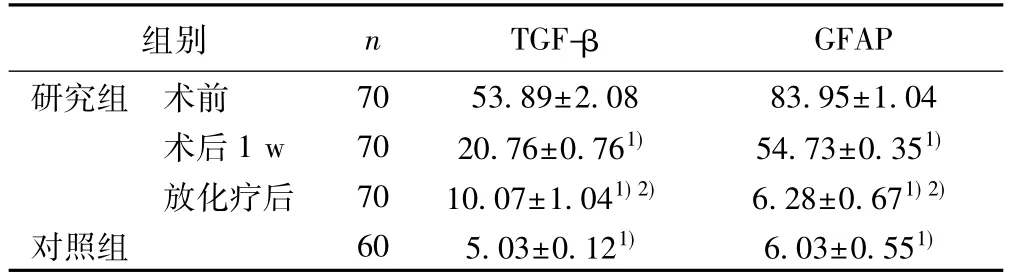
表1 两组TGF-β、GFAP水平比较(ng/L,)
与研究组术前比较:1)P<0.05;与术后1 w比较:2)P<0.05
组别 n TGF-β GFAP研究组 术前 70 53.89±2.08 83.95±1.04术后 1 w 70 20.76±0.761) 54.73±0.351)放化疗后 70 10.07±1.041)2) 6.28±0.671)2)对照组 60 5.03±0.121) 6.03±0.551)
表2 不同预后患者TGF-β、GFAP水平比较(ng/L,)
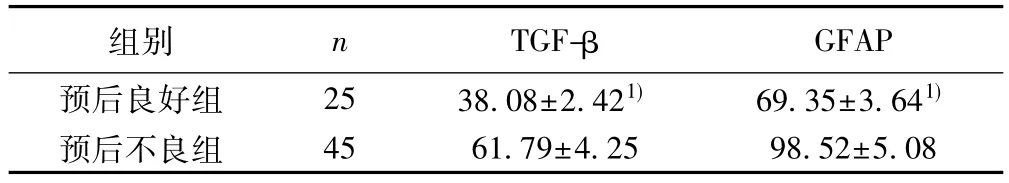
表2 不同预后患者TGF-β、GFAP水平比较(ng/L,)
与预后不良组比较:1)P<0.05
组别 n TGF-β GFAP预后良好组 25 38.08±2.421) 69.35±3.641)预后不良组 45 61.79±4.25 98.52±5.08
表3 不同疗效等级患者血清TGF-β、GFAP比较(ng/L,)
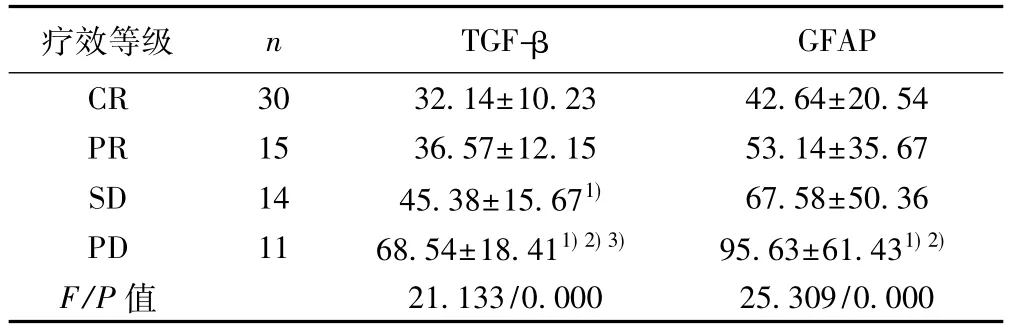
表3 不同疗效等级患者血清TGF-β、GFAP比较(ng/L,)
与CR比较:1)P<0.05;与 PR比较:2)P<0.05;与 SD比较:3)P<0.05
疗效等级 n TGF-β GFAP CR 30 32.14±10.23 42.64±20.54 PR 15 36.57±12.15 53.14±35.67 SD 14 45.38±15.671) 67.58±50.36 PD 11 68.54±18.411)2)3) 95.63±61.431)2)F/P值 21.133/0.000 25.309/0.000
3 讨论
脑恶性胶质瘤的生长生物学特征呈侵袭性,和正常的脑部组织较难区分,也无明显的差别,尤其是某些位置比较重要的肿瘤〔8〕。手术是临床上治疗脑恶性胶质瘤的重要方法,但是对于重要部位肿瘤较难完全切除,手术治疗效果较差,尤其对于老年患者。因此,手术后多给予放化疗综合治疗,以巩固术后治疗效果。且放化疗后需要密切监测患者的情况,降低肿瘤转移和复发的可能性,但是脑恶性胶质瘤术后病理取材较复杂,需要寻求重要的血清学指标来评价治疗效果,并观察患者的预后〔9〕。GFAP是星形胶质细胞的重要成分之一,主要由天冬氨酸和谷氨酸组成,于1971年首次从星形胶质细胞中分离,并逐渐被人们认知了解,作为星形胶质细胞的特异性标志物〔10,11〕。
近年来研究显示〔12〕,脑组织缺血损伤时GFAP水平升高,与脑组织缺血损伤后星形胶质细胞出现破坏有关。星形胶质细胞破坏后GFAP会被大量释放,导致脑积液中GFAP水平升高,通过血脑屏障进入血液,导致血清中GFAP水平升高〔13〕。脑恶性胶质瘤患者星型胶质细胞水平明显升高,GFAP水平也会明显升高,因此GFAP对脑恶性胶质细胞瘤具有诊断作用。TGF-β与血管生成具有较大关系,肿瘤形成和发展过程中会出现新生血管生成,肿瘤转移也会存在血管生成。检测TGF-β水平或可观察肿瘤发生和发展情况。本研究说明脑恶性胶质瘤患者血清中会出现TGF-β、GFAP水平升高,分析其原因为:脑恶性胶质瘤患者会出现星形胶质细胞大量增殖,而GFAP是星形胶质细胞的标志性物质,因此也会随之明显升高,脑恶性胶质瘤在发生和发展过程中会出现血管增殖,而TGF-β与血管增殖有关,因此脑恶性胶质瘤患者会出现TGF-β水平升高〔14,15〕。同时,本研究说明脑恶性胶质瘤患者治疗后会出现TGF-β、GFAP水平降低。在行手术或放化疗治疗后,肿瘤细胞会明显减少,且治疗效果越好,肿瘤缩小程度越大甚至可完全消失,因此GFAP作为星形胶质细胞标志性物质也会减少,肿瘤细胞减少血管也会随着减少,TGF-β水平也随之降低,且TGF-β、GFAP减少的程度与治疗效果有关。本研究还说明TGF-β、GFAP水平与脑恶性胶质瘤患者的预后有关,分析其原因为:脑恶性胶质瘤患者恶性程度较高,生长和转移速度也较快,患者预后也较差,生长和转移速度快患者 TGF-β、GFAP水平也会升高〔16〕,因此预后不良者TGF-β、GFAP水平明显高于预后良好者。另外本研究说明TGF-β、GFAP的表达与患者的近期疗效有关,进一步证明TGF-β、GFAP参与了脑恶性胶质瘤的发生、发展,但其具体机制仍需进一步研究明确。

