薄皮甜瓜‘花雷’再生体系的建立
武云鹏 ,张若纬 ,彭冬秀 ,张秀婷
(1.天津市蔬菜遗传育种企业重点实验室·蔬菜种质创新国家重点实验室·天津科润农业科技股份有限公司蔬菜研究所 天津 300381; 2.天津生物工程职业技术学院 天津 300462)
甜瓜(Cucumis meloL.)是葫芦科黄瓜属一年生蔓生植物,其香气怡人,肉质酥脆多汁,并富含维生素、蛋白质等,深受消费者喜爱。随着人们生活水平的提高,对高品质甜瓜的需求逐年增加。但是,常规育种周期长,易受环境因素影响,制约了育种进程。近年来,随着基因工程等先进的技术在育种工作中的应用,将目的基因导入甜瓜,加快甜瓜种质资源的创新,改善甜瓜品质,已成为甜瓜育种的新途径。基因工程等技术的应用,需建立高效的再生体系。笔者以甜瓜子叶、胚轴、真叶为外植体,总结出适合甜瓜离体培养的激素种类、浓度,并制定一套完整的甜瓜高效离体再生体系,为甜瓜基因工程提供技术保障。
1 材料与方法
1.1 材料
试验于2016—2018年在天津科润农业科技股份有限公司蔬菜研究所实验室进行,‘花雷’甜瓜种子由天津科润蔬菜研究所提,IAA、6-BA、IBA由Solarbio提供,分析软件为SPSS。
1.2 方法
1.2.1 无菌苗的获得 将甜瓜种子放入无菌水中浸泡4 h后剥去种壳,无菌条件下放入75%(φ)酒精中浸泡30 s,无菌蒸馏水冲洗4~5次,再次浸泡在2%NaClO溶液15 min,无菌蒸馏水冲洗4~5次,用无菌滤纸吸干水分后,然后接种于MS培养基上(蔗糖30 g·L-1,琼脂 7 g·L-1,pH 值 5.8),置于恒温 26 ℃、光强1 600 lx、光照16 h、黑暗8 h的环境中生长。
1.2.2 愈伤组织和不定芽诱导 将7 d苗龄的无菌苗子叶在无菌条件下切成5 mm×5 mm小块,胚轴切成5 mm小段,15 d苗龄的真叶切成5 mm×5 mm小块,分别接种于表2的9组培养基中,每种外植体接种10瓶,每瓶4个外植体。30 d后统计外植体出愈率和出芽率。
1.2.3 不定芽分化 切取1.2.2获得的绿色、疏松不定芽接种于16组分化培养基中,每个不定芽接种10瓶,每瓶4个不定芽。30 d后统计不定芽分化频率。
1.2.4 生根培养 丛生芽生长至1.5~2 cm时,从基部切下,转至生根培养基中生根培养。
2 结果与分析
2.1 最佳外植体确定
由表1可知,子叶、胚轴、真叶均可诱导出愈伤组织,子叶、胚轴诱导率 100%,真叶诱导率仅为40%。其中,子叶在接种5 d后明显膨大至原来3倍左右(图1),同时发生卷曲,叶脉处颜色变淡,接种30 d后愈伤组织大量紧密,有许多绿色凸起;胚轴接种10 d后两端变钝,颜色逐渐变浅,接种30 d后形成疏松淡黄色愈伤组织;真叶接种后膨大缓慢并且颜色变浅,接种30 d后呈现淡黄色愈伤组织,继续培养10 d后,愈伤组织褐化。说明子叶在这3种外植体中诱导愈伤组织速度快,长出的愈伤组织紧密、绿色,最适合组织离体培养。

表1 不同外植体出愈情况

图1 子叶接种诱导培养基5 d
2.2 诱导子叶的最佳培养基
将子叶接种于诱导培养基中,由表2可知,当IAA 浓度较低时(1、2、3号培养基),随着 6-BA 浓度的增加,愈伤组织的质量逐渐下降;当6-BA浓度较低时(1、4、7号培养基),随着IAA浓度的增加,愈伤组织结构发生改变,由紧密变为疏松,颜色变化较大,当 IAA 质量浓度较高时(2.0 mg·L-1),愈伤组织已经发生褐化。由此可见,当子叶接种于低浓度6-BA、IAA的诱导培养基中时(1号培养基),其愈伤组织发生最快且组织结构紧密,颜色为绿色,并有许多凸起。

表2 子叶在9种愈伤组织和不定芽诱导培养基中的生长情况
子叶在诱导培养基上培养约10 d后,其表面产生许多小突起,20 d后小突起形成丛生芽(图2),30 d后统计愈伤组织表面丛生芽的数量,结果如表2所示。对诱导的平均芽数进行单因素方差分析,结果表明,由于培养基中生长调节剂不同造成分生芽数量差异显著。这说明生长调节剂种类和浓度差异是影响不定芽分化的关键因素。从出芽率和平均每块愈伤的出芽数等因素综合考虑,选择MS+0.5 mg·L-16-BA+0.5 mg·L-1IAA 为诱导子叶愈伤组织和不定芽的最佳培养基。
图2 子叶诱导产生不定芽
2.3 不定芽分化的最佳培养基
切取愈伤组织上的不定芽,接种在分化培养基中(表3)10 d后,不定芽开始分化,30 d后统计不定芽分化数量(图3)。当6-BA浓度一定时,随着IBA浓度的增加,部分不定芽产生不定根;而当IBA浓度很小时,随着6-BA浓度的增加,不定芽停止分化,但玻璃化随之加重,当6-BA质量浓度为2.0 mg·L-1时,不定芽褐化。利用SPSS软件进行单因素方差分析,由于生长调节剂浓度不同,导致不定芽分化数量差异显著。因此,综合出芽率等因素考虑,MS+0.5 mg·L-16-BA+0.2 mg·L-1IBA 为芽分化最佳培养基,这与赵燕[1]等人的研究成果相一致。
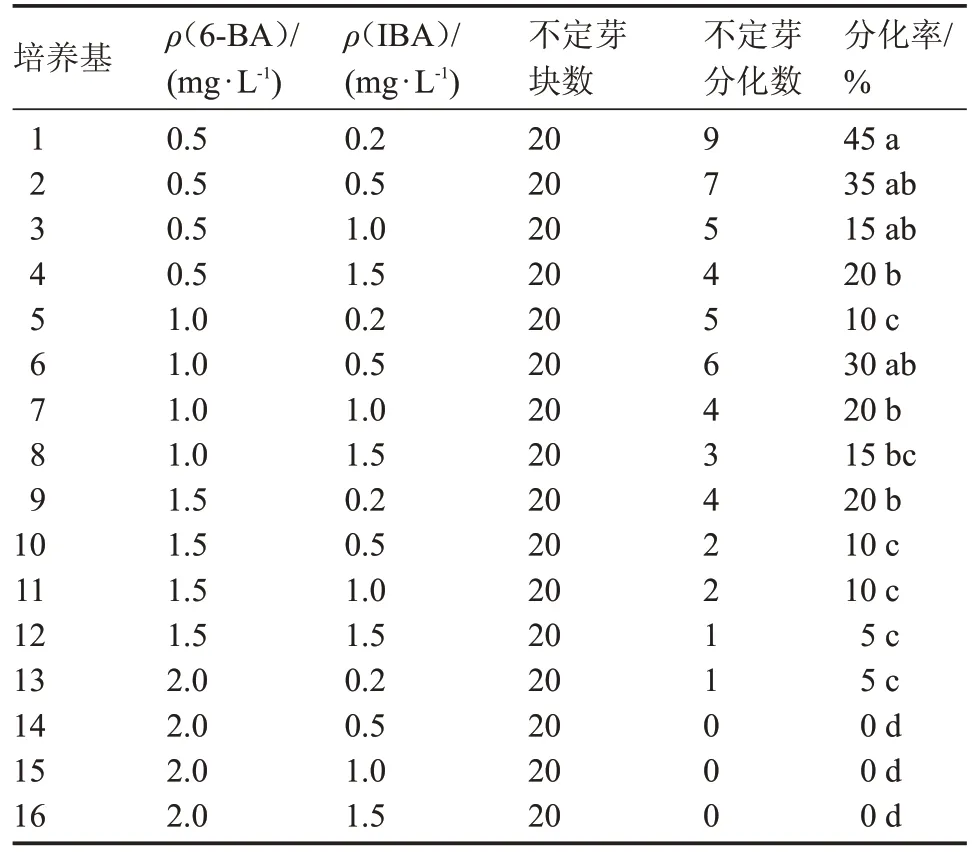
表3 16组分化培养基对不定芽分化的影响

图3 不定芽分化
2.4 生根培养
由表4可知,当MS培养基中不添加任何激素时,在不定芽茎基部产生少量愈伤组织,因此,添加一定量的IBA有利于根的发生。随着IBA浓度的增高,不定根数量随之增多,当IBA浓度为0.2 mg·L-1时,最有利于根的生长(图4)。

表4 不同浓度生根培养基对生根影响

图4 不定芽生根
3 讨论
3.1 外植体的选择
笔者对薄皮甜瓜‘花雷’的子叶、胚轴、真叶进行了愈伤组织诱导对比,在接种30 d后3种外植体均能诱导出愈伤组织,子叶出愈速度快,组织紧密、绿色,有许多凸起;胚轴出愈速度慢,组织疏松、浅黄色;而真叶出愈速度最慢,且褐化严重。因此子叶被作为诱导甜瓜不定芽发生的首选外植体[2],这与乔永旭[3]、魏晓明等[4]的研究结果一致。
3.2 植物生长调节剂的影响
培养基中细胞分裂素和生长素的配比是影响甜瓜子叶再生频率的关键因素之一,在不同浓度组合的6-BA与IAA的诱导培养基上,子叶的再生频率和平均再生芽数差异很大,本试验结果表明,适合甜瓜子叶诱导愈伤组织的最佳培养基为MS+0.5 mg·L-16-BA+0.5 mg·L-1IAA,这与付秋实等[5]的试验结果不相符,有可能是由于不同甜瓜品种内源生长调节剂含量不同导致的结果不一致。在不定芽分化过程中,当6-BA浓度很低时,随着6-BA浓度的增加,不定芽分化率变化较大,反之变化较小,所以正如前人研究所述,6-BA对甜瓜不定芽的分化起决定性作用[1]。在生根培养过程中,培养基添加了IBA,因为IBA主要用于促进扦插生根,其引起的不定根多而细长。试验证明,生根培养基以培养基MS+0.2 mg·L-1IBA为最佳组合。张慧君等[6]在生根培养时选择不添加任何激素的MS培养基,生根率 100%;施先锋等[7]认为,在 1/2MS+0.1 mg·L-1IAA的培养基中最易生根,盛慧等[8]认为,生根培养基最佳组合为1/2MS+NAA 0.5 mg·L-1。由于试验条件所限,未能对生根培养基进行更深一步研究,因此,在今后试验过程中,尝试不同生根培养基,以求更高效地培养出再生苗。

