黄瓜贴接苗砧木子叶淀粉代谢的动态变化特征
濮 丹,张静亚,雷 蕾,尚庆茂,董春娟
(中国农业科学院蔬菜花卉研究所,农业农村部园艺作物生物学与种质创制重点实验室,北京 100081)
黄瓜(CucumissativusL.)是世界上最主要的蔬菜种类之一,也是中国种植面积最大、产量最高的果菜类蔬菜之一。联合国粮食及农业组织(FAO)数据显示,2020年中国黄瓜种植面积126.04万hm2,产量7 283.30万t,分别占全世界的56.61%和79.81%,面积和产量均位居世界第一。嫁接在黄瓜栽培生产中已广泛应用,选择合适的南瓜砧木进行嫁接,可以有效克服土壤连作障碍、增强黄瓜嫁接苗的耐逆性和抗病性、提高果实产量和品质[1-2]。国内外常用的黄瓜嫁接方法包括靠接法、插接法和单子叶贴接法等[3-4]。采用单子叶贴接法进行嫁接时,用刀片沿一定角度切去砧木一个子叶和生长点,接穗在子叶下方约1 cm处以相同角度斜切下胚轴,之后将砧木和接穗沿切面紧贴对齐,用嫁接夹固定[3]。单子叶贴接法因操作工序简单,对幼苗标准化程度要求低,更利于机械化嫁接操作,且嫁接成活后萌蘖少,在黄瓜嫁接中已广泛推广应用[5]。
黄瓜和南瓜均属于双子叶植物,子叶对其生长具有重要作用。随着生长发育,子叶从单纯的贮存器官转变为幼苗生长初期最主要的光合器官,子叶中贮存的以及光合产生的碳水化合物是植物早期生长所需的主要能量来源[6]。在黄瓜中,将5 d龄幼苗的1片子叶去除,幼苗干质量减少50%以上,而将2片子叶全部去除,幼苗干质量将减少约70%[7-9]。在单子叶贴接中往往会保留一片砧木子叶,从而为嫁接接合部提供激素和能量物质,促进细胞分裂形成愈伤组织,进而促进嫁接愈合和嫁接苗生长[10-11]。然而,近年来穴盘育苗已成为黄瓜育苗的主要方式。南瓜砧木子叶较大,而穴盘育苗空间有限,在育苗时常会导致砧木子叶相互遮挡、堆叠,影响叶片光合效率,并易引发叶部病害,因此生产中多采用将砧木子叶部分剪除以减少不利影响[12],但是砧木子叶的去留如何影响黄瓜嫁接苗生长,目前仍鲜见报道。
糖在黄瓜嫁接愈合和嫁接苗生长发育过程中十分关键[10-11]。淀粉是叶片中糖的主要贮存形式[13]。淀粉合成是通过一系列酶促反应,把淀粉合成的前体物质ADP-葡萄糖(ADP-glucose,ADPG)转变为淀粉的过程,ADPG焦磷酸化酶(ADP glucose pyrophosphorylase,AGPase)、颗粒结合态淀粉合成酶(granule bound starch synthase,GBSS)、淀粉合成酶(starch synthase,SS)、淀粉分支酶(starch branching enzyme,SBE)和淀粉去分支酶(debranching enzyme,DBE)是淀粉合成过程的关键酶,其中AGPase负责合成前体物质ADPG,GBSS参与直链淀粉合成,SS、SBE和DBE参与支链淀粉的合成[14-17]。淀粉还可在β-淀粉酶(β-Amylase,β-AL)等酶的作用下水解形成麦芽糖,并运输到细胞质,为植物生长提供碳源[18]。在单子叶贴接的嫁接苗中,砧木子叶是重要的贮存性器官,淀粉作为其中糖的主要贮存形式,其代谢如何变化,对嫁接苗生长如何影响,目前尚无相关报道。本研究测定了黄瓜单子叶贴接嫁接苗砧木子叶的形态指标和淀粉代谢变化,分析了嫁接后去除砧木子叶对黄瓜嫁接苗生长的影响,明确了砧木子叶淀粉代谢在黄瓜嫁接苗生长中的作用,为黄瓜嫁接苗的壮苗培育提供科学依据。
1 材料和方法
1.1 试验材料
供试黄瓜品种‘中农18号’购自中蔬种业(北京)有限公司,南瓜品种‘京欣砧5号’购自京研益农(北京)种业科技有限公司。播种用平盘规格为540 mm×270 mm×60 mm(长×宽×高),购自台州隆基塑业有限公司;育苗营养钵上口径70 mm,下口径50 mm,高55 mm,购自北京顺莉科技有限公司。蛭石和珍珠岩为园艺级,粒径3~5 mm,购自河北灵寿县腾达矿产品加工厂;石英砂为20~40目,购自青岛绿生生物科技有限公司。
1.2 幼苗培养与嫁接
试验所需幼苗在中国农业科学院蔬菜花卉研究所南区玻璃温室中进行培养。选取饱满一致的黄瓜和南瓜种子,5% NaClO消毒10 min,蒸馏水充分冲洗后,置于30 ℃恒温箱中催芽。待种子露白后,挑选萌发一致的种子,接穗种子播于装有蛭石和珍珠岩(1∶1,V/V)混合基质的育苗平盘中,每盘播种约150粒;砧木种子播于装有蛭石和石英砂(5∶1,V/V)混合基质的育苗营养钵中,每钵1粒,播种后覆盖1.5 cm厚的蛭石,充分浇水至平盘或营养钵底部排水孔有水滴出现。待接穗幼苗长至子叶平展、砧木幼苗长至第一片真叶露心时,进行嫁接。
嫁接试验设置2个砧穗组合,分别为黄瓜/南瓜(C/P)和南瓜/南瓜(P/P),以不嫁接的南瓜自根苗(P)和去除一片子叶的南瓜苗(-/P)为对照。采用单子叶贴接法进行嫁接。选取长势整齐一致的幼苗,将砧木幼苗轴向30°切去生长点及一片子叶,接穗在子叶下方1 cm处以相同角度斜切,切面长约0.5 cm,将两切面紧贴对齐,用嫁接夹固定。嫁接后将幼苗立即移入人工气候培养箱中培养,愈合期环境设置参照赵加欣等进行分段设置[11]。嫁接后8 d(the 8 days after grafting,8 dag,下同)将幼苗移入玻璃温室自然温光条件下培养至25 dag。幼苗培养过程用1/2 Hoagland营养液进行灌溉。每处理3次重复,每重复至少100株嫁接苗。
为了分析砧木子叶去留对嫁接苗生长发育的影响,分别于0、1、3、5、7、10、13、18 dag上午10:00去除C/P和P/P嫁接苗的砧木子叶,嫁接苗继续培养至25 dag,培养条件同上,以不去除砧木子叶的C/P和P/P嫁接苗为对照。
1.3 嫁接苗生长指标测定
1.3.1 砧木子叶面积和鲜质量分别于0、1、3、5、7、10、13、18、25 dag下午14:00取砧木子叶,称量、记录子叶鲜质量,对子叶进行扫描,采用万深LA-S植物图像分析软件计算子叶面积。每处理3次生物学重复,每重复12株。
1.3.2 接穗和砧木生长指标于25 dag选取嫁接苗,分为接穗和砧木两个部分,参照褚群等[11]的方法,分别测定接穗部分鲜质量、干质量、叶片面积,以及根系鲜质量和干质量。每处理3次生物学重复,每重复12株。
1.4 根系活力测定
根系活力采用氯化三苯基四氮唑(TTC)还原法测定[19]。将幼苗根系清洗并吸干水分后放入含有5 mL 0.4% TTC、5 mL磷酸盐缓冲液(0.06 mol·L-1,pH 7.0)混合溶液中,使根系完全浸没,37 ℃黑暗孵育1.5 h后,加入2 mL硫酸溶液(1 mol·L-1)终止反应,将根系清洗后在无水乙醇中充分浸提3 h,浸提液于波长490 nm下比色,测定三苯基甲臜(TTF)含量,以单位时间内还原产生的TTF量表示根系活力(mg·g-1·h-1)。每处理3次生物学重复,每重复12株。
1.5 砧木子叶淀粉和可溶性糖含量测定
砧木子叶中淀粉采用酸水解法提取,淀粉含量测定采用蒽酮-硫酸法[11]。根系中可溶性糖含量采用蒽酮-硫酸法测定[11]。每处理3次生物学重复,每重复12株。
1.6 砧木子叶淀粉代谢相关酶的提取和活性测定
选取0、3、7、10、25 dag的砧木子叶冻存样品,用于淀粉合成酶(starch synthase,SS)、淀粉分支酶(starch branching enzyme,SBE)和β-淀粉水解酶(β-amylase,β-AL)的活性测定。SS的活性采用可溶性淀粉合成酶(SSS)活性检测试剂盒(索莱宝)进行测定,以每克样品在反应体系中每分钟催化产生1 nmol NADPH定义为1个酶活性单位(U·g-1);SBE的活性采用淀粉分支酶检测试剂盒(索莱宝)进行测定,以波长660 nm的吸光度下降百分率表示,每克样品在反应体系中每降低1% 碘蓝值为1个酶活性单位(U·g-1);β-AL的活性采用β-水解酶活性检测试剂盒(索莱宝)进行测定,以每克样品在反应体系中每分钟催化产生1 mg还原糖为1个酶活力单位(U·g-1)。每处理3次生物学重复,每重复12株。
1.7 根系RNA提取和基因表达水平测定
根系总RNA采用EasyPure Plant RNA Kit(全式金,北京)试剂盒提取,用1% 琼脂糖凝胶电泳检测RNA完整性,用Nano Drop One(Thermo Scientific,USA)测定RNA浓度。采用TransScript®All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)试剂盒(全式金,北京)进行反转录和cDNA第一链合成。所得cDNA用于Real-time PCR定量分析,试剂盒为Transstart®Top Green qPCR Kit(全式金,北京),仪器为LightCycler®96实时荧光定量PCR仪(Roche,瑞典)。
Real-time PCR反应体系(15 μL)为:cDNA模板0.8 μL,TransStart®Top Green qPCR SuperMix 7.5 μL,基因上、下游引物(10 μmol·L-1)各0.3 μL,ddH2O 6.1 μL。反应程序设置为:95 ℃ 180 s;95 ℃ 5 s,54 ℃ 10 s,72 ℃ 10 s,共50个循环。以南瓜持家基因CmoActin作为Real-time PCR的内参基因[20],基因相对表达水平采用2-ΔΔCt法计算[21],设定目标基因在0 dag的表达水平为1.0。待测目的基因及内参基因特异性扩增引物序列见表1。每个样品3次重复,每次重复15株幼苗。
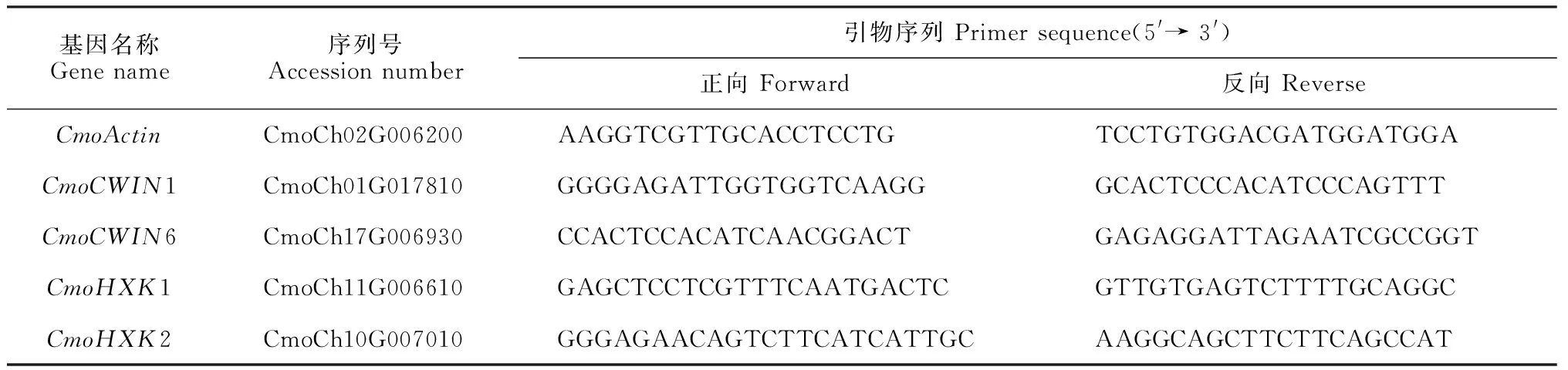
表1 Real-time PCR所用引物序列
1.8 数据处理与统计分析
试验结果采用3次独立生物学重复的平均值±标准差(mean±SD)表示,采用Microsoft Excel 2019 软件处理数据并作图,采用SPS 26 软件最小差异法进行显著性差异分析(α= 0.05)。
2 结果与分析
2.1 C/P和P/P嫁接苗砧木子叶生长动态
图1,A、B显示,相较于南瓜自根苗P,单子叶贴接的黄瓜/南瓜嫁接苗(C/P)和南瓜/南瓜嫁接苗(P/P)中砧木子叶的面积和鲜质量均显著增加,且C/P嫁接苗的增加量显著高于P/P;在嫁接后25 d,C/P砧木子叶的鲜质量和面积分别是P/P的1.29倍和1.12倍;去除一片子叶的南瓜幼苗(-/P)的子叶面积和鲜质量均增加,且增加量显著高于C/P和P/P嫁接苗。
同时,图1,C、D进一步比较了砧木子叶在嫁接后不同时期鲜质量和面积的净增长量。其中,C/P砧木子叶的鲜质量主要在嫁接愈合期1~7 dag显著增长,占总增长量的73.70%,此外其在10~18 dag期间也有增长;P/P砧木子叶的鲜质量在嫁接愈合期0~1 dag的增长占总增长量的49.08%;而-/P幼苗的子叶除在0~3 dag期间显著增长外,在生长后期(10~25 dag)还有一个更大幅度的增长;P幼苗的子叶则仅在0~1 dag时快速增长(图1,C)。各砧木子叶面积的增长模式与其鲜质量增加模式略有差异,所有处理在0~1 dag时均有一个快速增大的过程(图1,D);此外,C/P嫁接苗的砧木子叶面积在1~7 dag、10~18 dag有显著增大,P/P嫁接苗的砧木子叶面积仅在3~7 dag时显著增大;-/P幼苗子叶面积有两个增大期(1~7 dag、10~25 dag),而P幼苗的子叶面积有一个增大期(1~3 dag)。
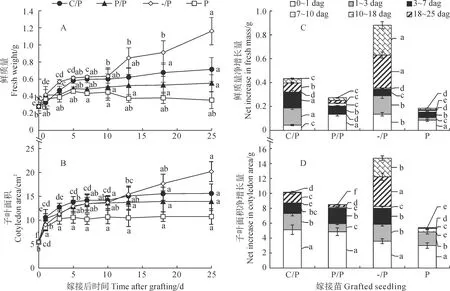
C/P. 黄瓜/南瓜嫁接苗;P/P. 南瓜/南瓜嫁接苗;-/P. 去除一片子叶和生长点的南瓜自根苗;P. 南瓜自根苗;dag. 嫁接后天数。同一处理内不同小写字母表示生长不同时期间差异显著(P < 0.05);下同图1 C/P和P/P嫁接苗砧木子叶的生长情况C/P. Cucumber/pumpkin grafted seedling;P/P. Pumpkin/pumpkin grafted seedling;-/P. Pumpkin seedling with one cotyledon and apical meristem removed;P. Intact pumpkin seedling. dag. Days after grafting. Different normal letters within each treatment indicate the significant differences among various times at 0.05 level (P < 0.05); The same as belowFig.1 Growth of rootstock cotyledon in C/P and P/P grafted seedlings
上述结果表明,在单子叶贴接后,各嫁接苗的砧木子叶均迅速生长,并以C/P嫁接苗砧木子叶的增长量高于P/P嫁接苗,且两者增长时期分布也存在差异,C/P的砧木子叶在嫁接后的早期和后期均有增加,而P/P的砧木子叶仅在嫁接后早期有显著增加。
2.2 C/P和P/P嫁接苗砧木子叶的淀粉含量变化
淀粉是叶片光合作用产物的主要贮存形式[22]。图2显示,C/P嫁接苗砧木子叶淀粉含量在1 dag和3 dag时下降,之后逐渐升高,至愈合期结束时(7 dag)是嫁接前(0 dag)的2.36倍,并在10 dag和13 dag时达到最高,之后随着幼苗生长迅速降低。与C/P嫁接苗表现类似,P/P嫁接苗砧木子叶中淀粉含量在嫁接愈合期1~5 dag时显著降低,并在7 dag和10 dag时达到最高,7 dag时较0 dag显著升高约70%,之后随着幼苗生长逐渐降低;P/P嫁接苗砧木子叶淀粉含量几乎始终低于同期C/P嫁接苗。与嫁接苗不同,自根苗P和-/P的子叶淀粉含量随着幼苗生长呈先升高后降低的趋势,P幼苗子叶淀粉在10~13 dag时达到最高,而-/P幼苗子叶淀粉含量在18 dag时达到最高。
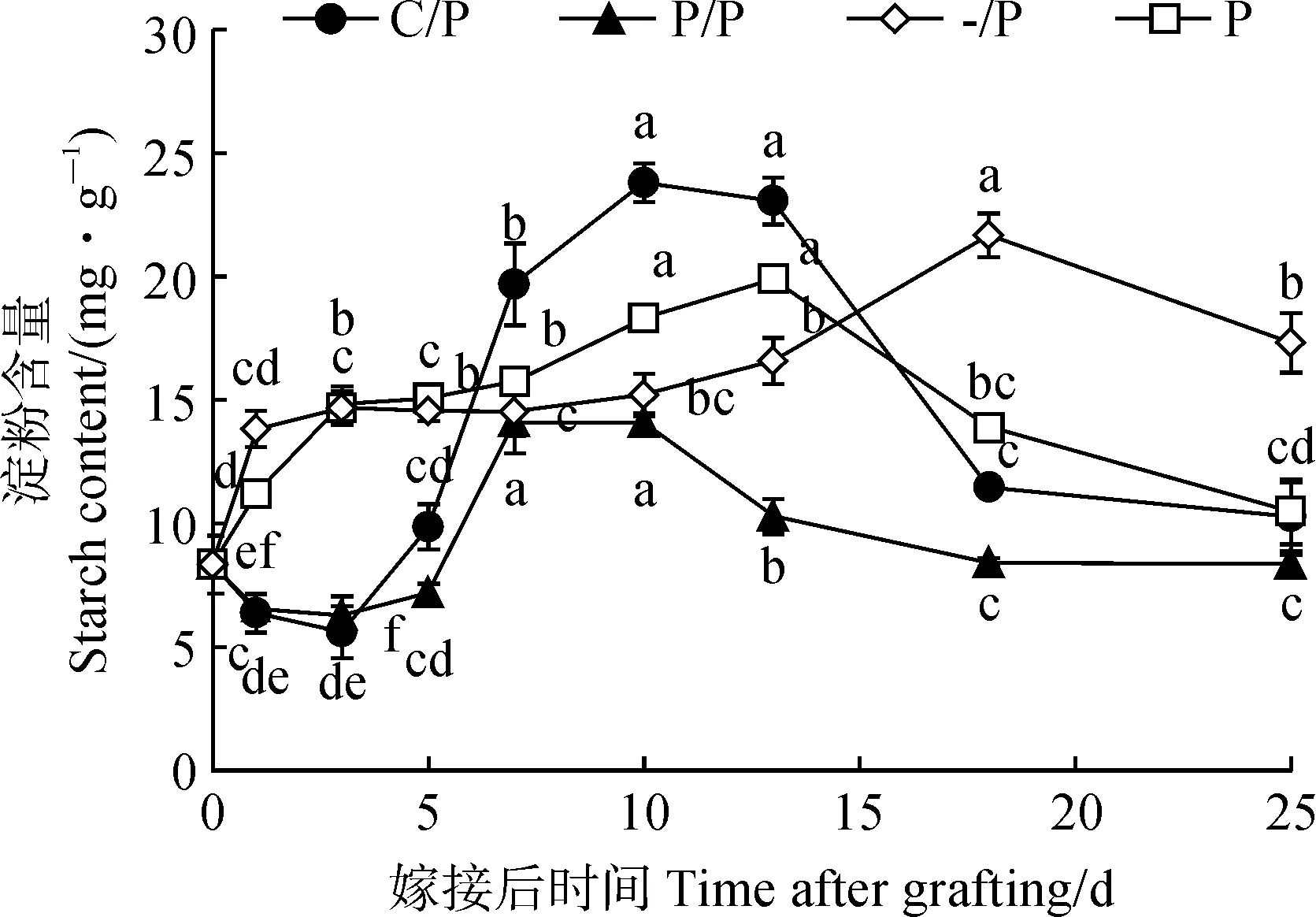
图2 C/P和P/P嫁接苗砧木子叶中淀粉含量随生长的变化Fig.2 Changes of starch content in cotyledons during growth of C/P and P/P grafted seedlings
2.3 C/P和P/P嫁接苗砧木子叶中淀粉代谢相关酶的活性变化
首先,C/P嫁接苗砧木子叶中可溶性淀粉合成酶(SSS)的活性在0 dag时最高,之后逐渐降低,至7 dag时达到最低,在10 dag时有所升高,并于25 dag时再次降低;P/P嫁接苗砧木和-/P自根苗子叶中SSS活性变化规律与C/P类似,但在7 dag时SSS活性高于C/P;P自根苗子叶中SSS活性呈持续降低的趋势,在25 dag时活性最低,只有0 dag时的15.13%(图3,A)。
其次,C/P嫁接苗砧木子叶中淀粉分支酶(SBE)活性在3 dag时降低,并在7 dag时升高,至10 dag时达到最高,但在25 dag时再次明显降低;P/P嫁接苗砧木子叶中SBE活性在3~7 dag时维持在较低水平,在10 dag时有所升高,但仍显著低于同期C/P嫁接苗;-/P自根苗子叶中SBE活性在3~7 dag时逐渐降低,而在10~25 dag时逐渐升高;P自根苗子叶中SBE活性在0~10 dag时相对稳定,但在25 dag时显著降低,只有0 dag时的44.04%(图3,B)。
另外,C/P和P/P嫁接苗砧木子叶的β-淀粉酶(β-AL)活性变化规律相似,均在3 dag时升高,并在7 dag时降低,在25 dag时活性最低,只有0 dag时的约53.86%;在10 dag时,C/P砧木子叶中β-AL活性有一个显著升高的过程,且显著高于同期P/P嫁接苗。-/P自根苗子叶中β-AL活性在3 dag时迅速降低,之后维持在27.11 U·g-1左右,而自根苗P子叶中β-AL活性在0~7 dag时比较稳定,在10 dag时显著降低(图3,C)。
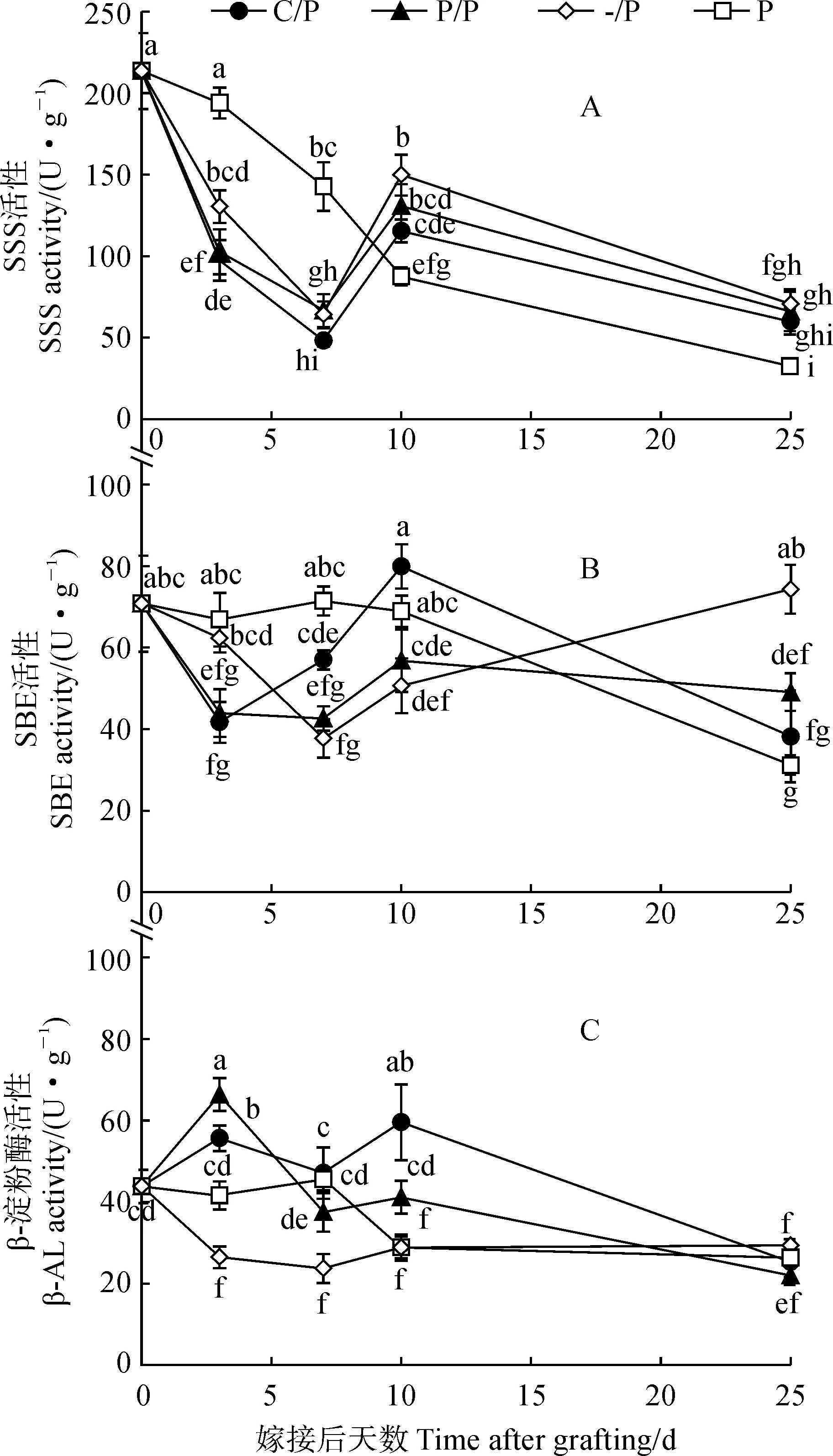
图3 C/P和P/P嫁接苗砧木子叶中淀粉代谢相关酶活性变化Fig.3 Enzyme activities related to starch metabolism in the rootstock cotyledon of C/P and P/P grafted seedlings
2.4 去除砧木子叶对C/P和P/P嫁接苗生长以及根系活力和相关基因表达的影响
2.4.1 生长指标通过单子叶贴接的C/P和P/P嫁接苗,分别在嫁接后不同时间去除砧木子叶,进一步观测砧木子叶去留对嫁接苗(25 dag)生长发育的影响。结果(表2)显示,P/P嫁接苗接穗和根系的生长(生物量、总叶面积)受到砧木子叶去留的影响较小,而C/P嫁接苗生长受到嫁接后砧木子叶去留的影响较大,尤其是嫁接后早期去除砧木子叶显著抑制嫁接苗接穗和根系生长,并以0 dag去除砧木子叶的抑制作用最强。其中,与对照(保留砧木子叶)相比,C/P嫁接苗接穗部分的鲜质量在0~3dag、干质量在0~5 dag、叶片总面积在0~13 dag均显著降低,降幅分别为17.99%~21.08%、18.44%~23.15%、12.46%~36.57%,而其砧木部分的鲜质量在0~13 dag、干质量在0~5 dag均显著降低,降幅分别为32.0%~42.0%、28.80%~39.16%。
2.4.2 根系活力及其可溶性糖含量嫁接后去除砧木子叶对各嫁接苗(25 dag)根系活力有不同的影响(图4)。其中,各个时期去除砧木子叶对P/P嫁接苗的根系活力均无显著影响,而对于C/P嫁接苗根系活力产生不同影响,且去除时间越早受到影响越严重。C/P嫁接苗根系活力以对照最高,在0~10 dag去除砧木子叶均会导致嫁接苗根系活力显著降低,并以0 dag时去除子叶的影响最大(根系活力只有对照的30.64%);在1~10 dag时去除砧木子叶根系活力降低了约45%;在13~18 dag时去除砧木子叶对根系活力的影响较小,根系活力降低不到10%。
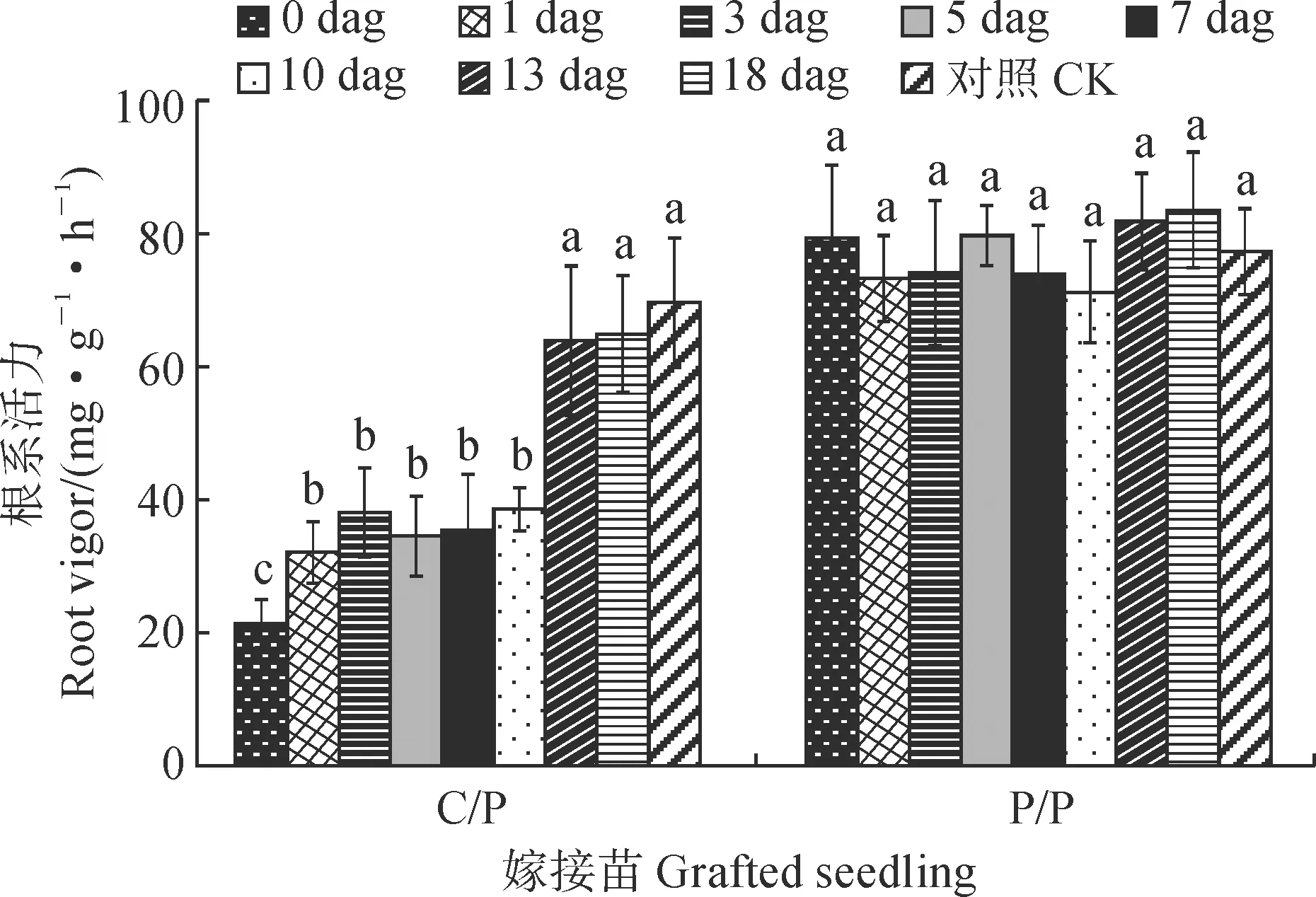
不同小写字母表示处理时间之间在0.05 水平差异显著(P < 0.05);下同图4 嫁接后去除砧木子叶对C/P和P/P嫁接苗根系活力的影响Different normal letters indicate the significant differences in different treatment times at 0.05 level (P < 0.05);The same as belowFig.4 Effects of removing rootstock cotyledon on root vigor of C/P and P/P grafted seedlings
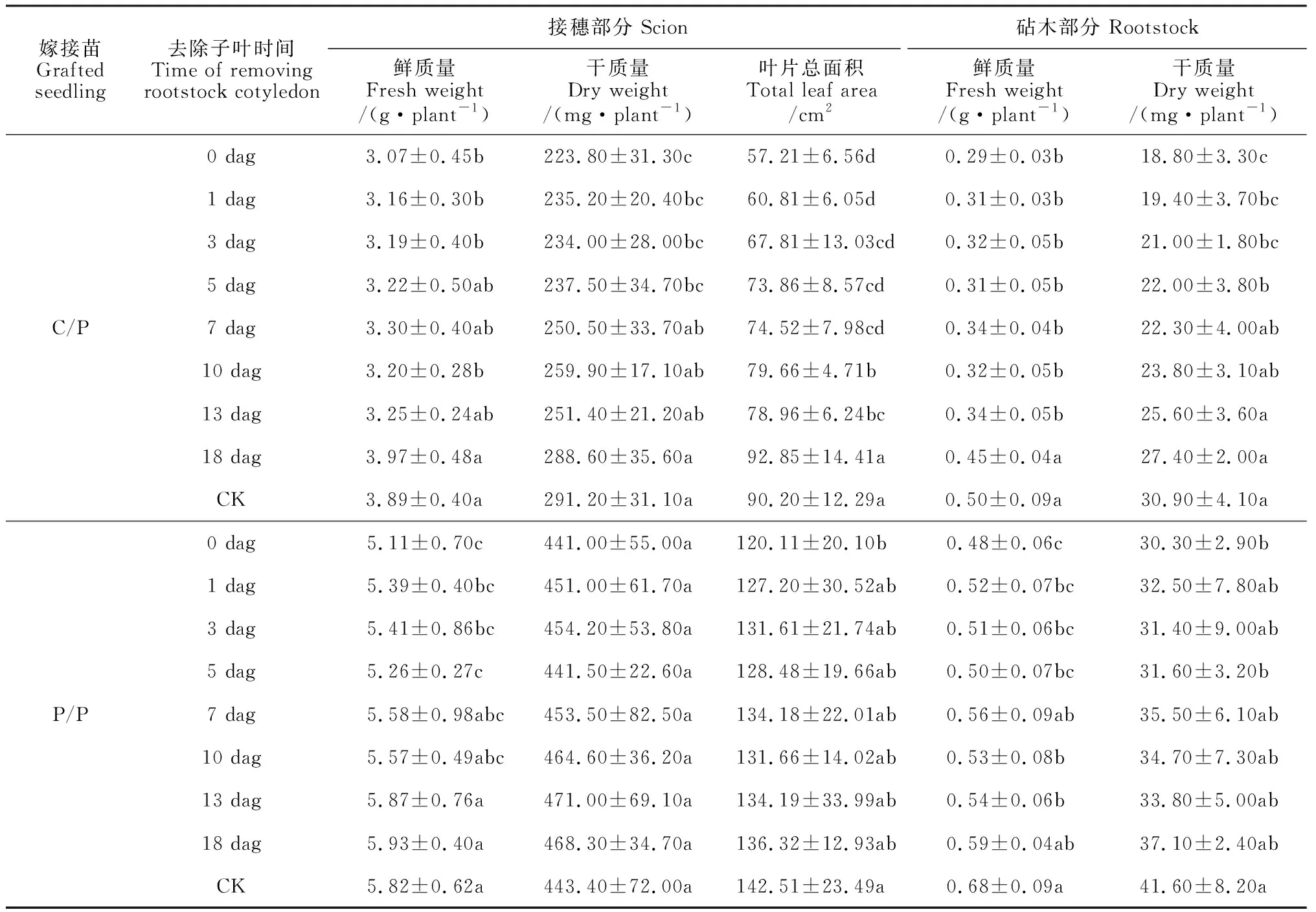
表2 嫁接后不同时间去除砧木子叶对C/P和P/P嫁接苗生长指标的影响
同时,嫁接后去除砧木子叶对嫁接苗根系可溶性糖含量也有相似的影响(图5)。其中,各时期去除砧木子叶对P/P嫁接苗根系中可溶性糖含量均无显著影响,而对于C/P嫁接苗根系可溶性糖含量产生不同影响,并在0~10 dag时去除砧木子叶均引起显著降低,此时根系可溶性糖含量约为对照的66%左右,而在18 dag时去除砧木子叶根系可溶性糖含量与对照无显著差异。
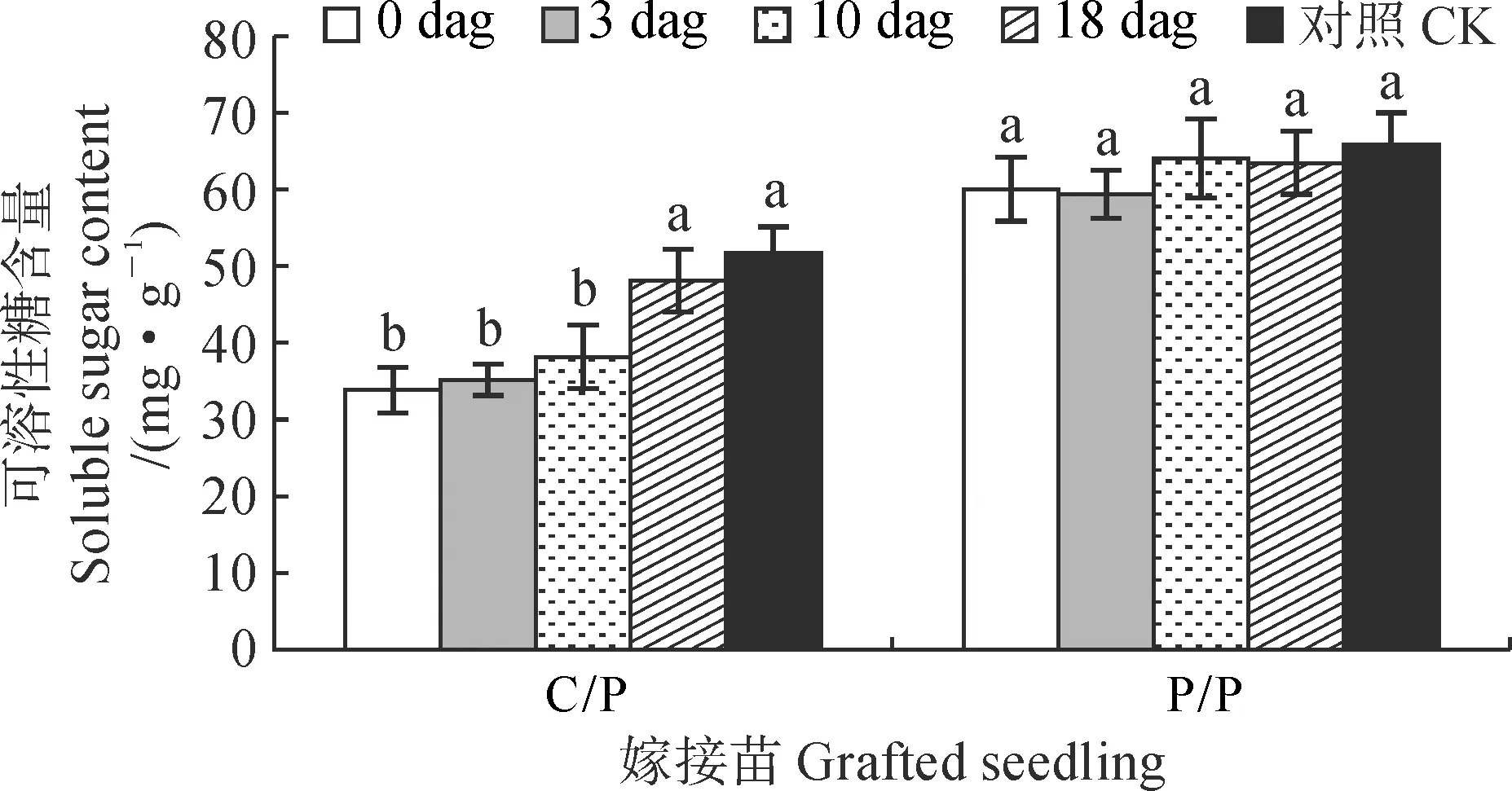
图5 嫁接后去除砧木子叶对C/P和P/P嫁接苗根系可溶性糖含量的影响Fig.5 Effects of removing rootstock cotyledon on the soluble sugar content in roots of C/P and P/P grafted seedlings
2.4.3 根系CWIN和HXK基因表达水平比较去除砧木子叶嫁接苗根系CWIN和HXK基因表达水平(图6)发现,P/P嫁接苗根中CmoCWIN1、CmoCWIN6和CmoHXK2基因表达水平在去除砧木子叶后均未受到显著影响,仅嫁接苗根系CmoHXK1的表达水平在3 dag去除砧木子叶处理中略有降低;而C/P嫁接苗根中CmoCWIN1、CmoCWIN6、CmoHXK1和CmoHXK2基因的表达水平在嫁接后各时期去除砧木子叶后均不同程度降低,并均以0 dag时去除砧木子叶处理的表达水平最低,分别比对照显著降低52.35%、46.51%、23.76%和46.50%。以上结果说明在C/P中和去除砧木子叶引起嫁接苗根系中糖代谢水平降低,导致根系活力降低。
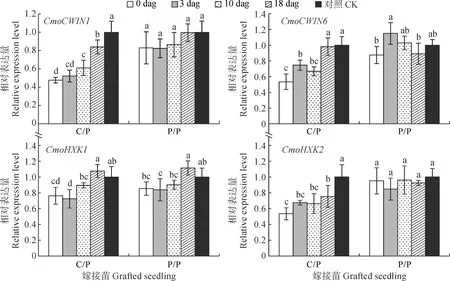
图6 嫁接后去除砧木子叶对C/P和P/P嫁接苗根系CWIN和HXK基因表达水平的影响Fig.6 Effects of removing rootstock cotyledon on CWIN and HXK genes expression in roots of C/P and P/P grafted seedlings
3 讨 论
黄瓜是重要的蔬菜作物,嫁接可以有效克服土壤连作障碍、增强抗逆性和抗病性,提高产量和品质[23-26]。单子叶贴接因其嫁接成活率高、便于机械化操作等优点,是黄瓜嫁接的主要方法之一[4]。嫁接砧穗间互作是当前的研究热点,包括砧木对地上部接穗的影响以及接穗对砧木的反馈调控[11, 27-28]。砧木子叶作为嫁接苗早期生长最主要的源器官,目前对其生长发育动态及其对接穗和根系生长的影响仍缺乏了解。
本研究发现,-/P自根苗以及C/P和P/P嫁接苗中,砧木子叶的面积和鲜质量迅速增大,且子叶增加量表现为-/P > C/P > P/P > P。黄瓜和南瓜均为双子叶植物,子叶是早期幼苗进行光合作用的主要场所,较大的叶表面积可以最大限度地接受光照、增加光合效率[29],去除其中一片子叶,植物为提高源器官的强度,势必会引起另一片子叶显著增大,这与Mayoral等[30]的报道一致。在本研究中,对于不同砧穗组合的幼苗砧木子叶增大的时期不同。对于南瓜自根苗P,子叶在0~1 dag时期明显增大,表明南瓜幼苗子叶在此时(即出苗后5~6 d)生长基本完成;对于自根苗-/P,子叶在早期(0~7 dag)和后期(10~25 dag)都有显著增大;嫁接苗P/P砧木子叶随时间的增长模式与P自根苗相似,而C/P嫁接苗砧木子叶的增长模式则介于P/P和-/P之间,这可能与异源嫁接苗的愈合速率慢于自体嫁接苗有关[31]。这些结果表明,单子叶贴接后,嫁接苗砧木子叶显著增长,且增长幅度与时期因接穗不同而异。
淀粉作为植物中碳水化合物的一种主要贮存形式,在调节植物源-库关系中起重要作用[13]。本研究中C/P和P/P嫁接苗砧木子叶中淀粉含量在嫁接愈合期(1~7 dag)显著降低。在嫁接愈合初期,砧穗间尚未连通,砧木子叶是嫁接苗最主要的源器官,子叶中淀粉水解可为嫁接愈合提供所需的能量[10]。砧木子叶中淀粉的减少与淀粉合成酶SSS和SBE活性降低、淀粉水解酶β-AL活性升高一致。SSS和SBE协同负责淀粉的合成[32]。嫁接愈合期弱光、高湿的环境引起SSS和SBE活性显著降低,这与已有研究报道一致。在木薯、大豆等植物中,遮荫和弱光处理可显著抑制叶片中SS、SBE等淀粉合成相关基因的表达和酶活性[33-35]。β-AL负责从淀粉分子的非还原性末端依次切割α-1,4-糖苷键,产生β-麦芽糖,是植物叶片中淀粉水解的关键酶[36]。水分胁迫可促进黄瓜子叶中β-AL活性升高,增加子叶中蔗糖含量,蔗糖作为渗透调节物质,保护子叶细胞免受胁迫伤害[37]。β-AL的基因表达和酶活性也受糖信号诱导。对拟南芥莲叶片施加蔗糖、葡萄糖或果糖后,β-AL基因表达和活性都有显著升高[38]。在嫁接愈合期,切削引起砧木子叶失水导致β-AL活性升高,而嫁接愈合的高能量需求引起蔗糖、葡萄糖等升高,进一步促进了β-AL基因表达和活性升高。
随着嫁接伤口逐渐愈合,能量需求降低,且维管束逐渐连通,接穗叶片补充成为新的源器官,砧木子叶中的光合产物以淀粉形式逐渐积累,淀粉含量迅速升高,且C/P砧木子叶淀粉含量显著高于P/P。嫁接愈合期结束后,接穗叶片逐渐成为主要的源器官,接穗新叶和根系是嫁接苗的主要库器官,由于C/P嫁接苗接穗和根系的生长(即库的强度)均弱于P/P嫁接苗,C/P砧木子叶中更多的光合产物用于合成淀粉,并贮存在子叶中。与此相一致,砧木子叶中SSS和SBE活性升高,且C/P砧木子叶中SBE活性显著高于P/P。之后嫁接苗快速生长,砧木子叶中贮存的淀粉逐渐水解,供接穗和根系生长所需。综合上述结果,在黄瓜单子叶贴接苗中,砧木子叶可作为一个贮存器官,在嫁接愈合期子叶淀粉水解为接口愈合提供能量,在愈合期结束后及幼苗生长早期,子叶中多余的光合产物以淀粉形式储存起来,并在幼苗生长后期水解,为嫁接苗接穗和根系的快速生长提供碳源。
为验证上述结论,进一步分析了嫁接后不同时期去除砧木子叶对嫁接苗生长的影响。研究发现,嫁接后去除砧木子叶对P/P嫁接苗的生长和根系活力无显著影响,而对于C/P嫁接苗在13 dag之前去除砧木子叶均可显著抑制嫁接苗生长和根系活力,并以0 dag时去除砧木子叶的抑制作用最强。分析其原因,去除砧木子叶后导致子叶中贮存的淀粉无法为C/P嫁接苗接穗和根系生长提供碳源,生长受到显著抑制,而在生长后期砧木子叶的淀粉已经基本被水解利用,因此去除子叶对生长的抑制作用消失。与此结果一致,去除砧木子叶引起C/P嫁接苗根系可溶性糖含量以及CmoCWIN1、CmoCWIN6、CmoHXK1和CmoHXK2等基因的表达水平降低。在嫁接后早期去除砧木子叶对生长的抑制效果更加显著,这是由于在早期嫁接苗需要消耗大量能量用于嫁接愈合[10, 39],而去除砧木子叶需要消耗下胚轴等其他部位的碳源,进一步导致供应接穗和根系生长的碳源减少,抑制生长的效果加剧。对于P/P嫁接苗,砧木子叶大小和淀粉积累量均显著低于C/P嫁接苗,砧木子叶中淀粉作为贮存性碳源的作用不显著,且同源嫁接砧穗愈合更快,南瓜作为接穗,其叶片光合面积大,去除砧木子叶对嫁接苗生长的影响不显著。
综上所述,C/P单子叶贴接苗的砧木子叶可作为重要的缓冲器官,在嫁接后早期将光合作用产物以淀粉形式贮存起来,并在后期逐渐水解成葡萄糖等单糖,为嫁接苗接穗和根系的快速生长提供碳源,在嫁接后早期去除砧木子叶在一定程度上会抑制嫁接苗的生长。但是C/P嫁接苗的砧木子叶中为何会积累更多的淀粉?受哪些信号调控?这些信号在接穗和砧木间如何传递?这些问题将是下一步研究的重点。

