D⁃半乳糖诱导小鼠原代皮肤成纤维细胞衰老模型的建立*
张 鑫,黎 静,鲁 晴,黄华生,林毓君,唐春女,潘璐璐,莫书荣(广西医科大学生理教研室,广西南宁 530021)
随着我国人口数量的不断增加,人口老龄化问题逐渐突出,因此衰老性疾病和亚健康的衰老性疾病等随之而来。抗衰老研究及如何预防和延缓年龄相关疾病的发生和发展将有利于提高人们的生活质量,减少其家庭的经济负担,已逐渐成为医学界关注的热点。衰老最先表现为皮肤衰老,皮肤是人体最大的器官,由表皮、真皮和皮下组织构成,其中真皮为皮肤提供各种营养物质,成纤维细胞是真皮的主要细胞组成,维系着皮肤正常的生理结构和功能[1]。衰老的皮肤在结构和功能上将发生改变[2-3]。因此,皮肤成纤维细胞衰老模型在研究衰老机制、表现及筛选延缓衰老药物起着重要作用。本研究旨在建立成纤维细胞(MSF)衰老模型,为开展皮肤衰老及老年相关疾病的研究提供实验基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取5~7 d昆明乳鼠,购自广西医科大学实验动物中心。
1.1.2 主要试剂 高糖DMEM培养基(美国Gibco公司)、Ⅰ型胶原酶(美国Invitrogen公司)、β-半乳糖苷酶细胞衰老染色试剂盒(上海碧云天公司)、鼠抗Vimentin单克隆抗体(武汉博士德公司)、鼠抗Sirt1单克隆抗体(SANTA CRUZ公司)、逆转试剂盒(Thermo公司)、液体DAB酶底物显色试剂盒(福州迈新生物技术有限公司)。4,6-二脒基-苯基吲哚(DAPI)(Solarbio公司)
1.2 方法
1.2.1 MSF的培养 取5~7 d的昆明乳鼠,用75%乙醇浸泡消毒30 min,用消毒过的手术剪分离乳鼠的背部皮肤5 cm×3 cm,将分离下来的皮肤置于10 cm的培养皿中,用含1%青霉素-链霉素的去离水磷酸盐缓冲液(DPBS)清洗 2次,吸净DPBS,去除血管脂肪,用手术剪将皮肤组织剪碎并将组织碎块转移到15 mL离心管内,然后加入10 mL的0.1%Ⅰ型胶原酶(无血清的高糖DMEM培养基),并吹打使得皮肤组织碎块分散,将离心管放入到CO2细胞培养箱中消化90 min,并且每隔30 min振荡摇晃离心管1 min。消化完后离心机以1 500 r∕min速率离心5 min,弃上清,用含10%胎牛血清的高糖DMEM清洗2次,以1 000 r∕min离心速率离心3 min,弃上清,再用含15%胎牛血清的高糖DMEM重悬组织块并用70 μm的滤筛过滤,将滤液转移到培养瓶,并放入二氧化碳(CO2)细胞培养箱中培养,隔天换液。
1.2.2 MSF的鉴定 采用形态学观察法观察MSF的形态特征;Vimentin蛋白采用细胞免疫组化法分析MSF,具体方法如下,将培养板中长好MSF的玻片用PBS洗3次,用4%多聚甲醛固定爬片15 min,PBS清洗3次;0.5%Triton X-100室温通透20 min;加滴一抗波形蛋白抗体。用PBS清洗,滴加生物素标记的二抗,PBS冲洗。滴加链亲和素-过氧化酶溶液孵育。DAB显色,用苏木素复染,用中性树胶封固,在显微镜下采集图像。
1.2.3 D-半乳糖诱导细胞衰老 将生长状态良好的MSF接种于6孔板,用高糖DMEM培养基、37℃CO2培养箱培养。待细胞融合70%~80%,给予含有不同浓度 D-半乳糖(10、20、30 g∕L)的完全培养基,分别培养0、24、48 h。
1.2.4 β-半乳糖苷酶染色实验 按照β-半乳糖苷酶染色试剂盒说明书进行实验操作,具体方法如下:吸弃旧的培养基,用DPBS清洗1次,加入1 mL染色固定液,室温固定15 min;吸弃固定液,用DPBS清洗3次,每次3 min;吸弃DPBS,每孔加入1 mL染色工作液,用保鲜膜盖住6孔板,然后放置于37℃恒温箱中孵育过夜。甘油封闭镜下观察,各组随机计数400个细胞中的阳性细胞数,计算阳性细胞率(%)。
1.2.5 逆转录-聚合酶链反应(RT-PCR)法检测p53基因表达 D-半乳糖(20 g∕L)分别诱导 MSF 0、24、48 h,采用Trizol法提取细胞总RNA并进行RT-PCR,采用荧光定量染料法检测p53 mRNA表达水平(上游引物:AGTCCTTTGCCCTGAACTGC,下游引物:GCGGATCTT GAGGGTGAAAT),每个样本重复测量3次,以GAPDH(上游引物:CGGAGTCAACGGATTTGGTCGTAT,下游引物:AGCCTTCTCCA TGGTGGTGAAGAC)为内参参照标准,按照2-△△Ct计算p53基因相对表达量。
1.2.6 细胞免疫荧光观察Sirt1基因在MSF中的表达 D-半乳糖(20 g∕L)分别诱导 MSF 0、48 h,将培养板中爬好MSF的玻片用PBS清洗3次,每次3 min;4%多聚甲醛固定爬片15 min,用PBS清洗3次,每次3 min;0.5%Triton X-100室温通透20 min;用PBS清洗3次,吸水纸吸干PBS,在玻片上滴加山羊血清室温封闭30 min;吸水纸吸掉封闭液,并滴入足量稀释好的一抗小鼠单克隆抗体Sirt1,放入湿盒,在4℃孵育过夜;用PBST浸洗爬片3次,并吸干液体,滴入稀释好的荧光二抗,黑暗条件下20~37℃湿盒孵育1 h,PBST洗3次,每次3 min;滴加DAPI避光孵育5 min,对标本进行染核,用PBST清洗;用含抗荧光淬灭剂的封片液封闭,在荧光显微镜下采集图像。
1.3 统计学处理 所有实验均重复3次,计量资料以表示,应用SPSS17.0统计软件进行数据分析。多组间比较应用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 倒置相差显微镜观察MSF形态学变化 光镜下可见细胞胞体较大,胞核较大呈椭圆形,染色质疏松着色浅,核仁明显,为多突的梭形或星形的扁平细胞,具有突起,符合皮肤MSF的形态学特征。见图1。
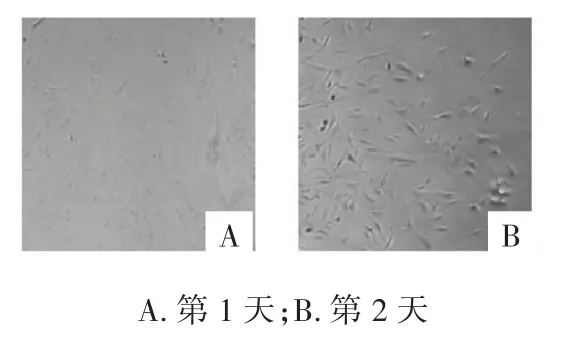
图1 原代成纤维细胞形态及鉴定(4×)
2.2 Vimentin蛋白免疫组织化学分析 Vimentin蛋白免疫组织化学结果显示,原代培养细胞中Vimentin蛋白呈阳性表达。见图2。
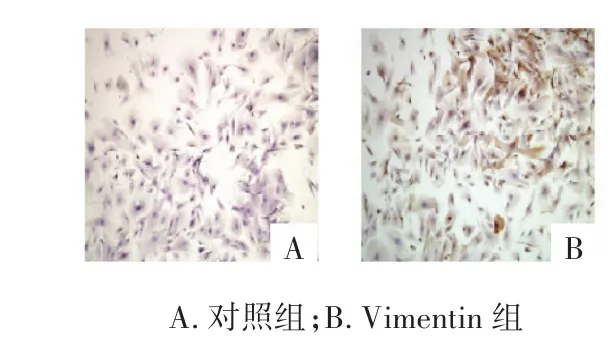
图2 MSF Vimentin蛋白免疫组化分析(4×)
2.3 β-半乳糖苷酶染色分析 β-半乳糖苷酶染色后,衰老细胞呈蓝色,阴性细胞无着色。不同浓度D-半乳糖诱导MSF 0、24、48 h后,阳性细胞的百分比均显著高于0 g∕L,并且呈现一定的时间和浓度依赖性。见图3、4。
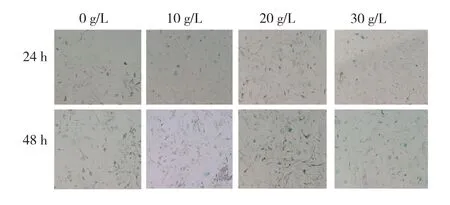
图3 不同浓度D-半乳糖诱导MSF后β-半乳糖苷酶染色情况(100×)
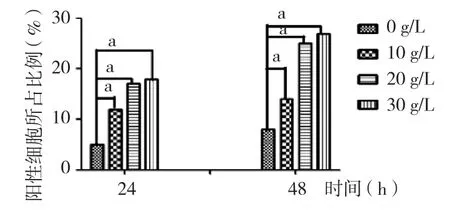
图4 不同浓度D-半乳糖诱导MSF后β-半乳糖苷酶染色阳性细胞数分析
2.4 p53基因表达水平检测 D-半乳糖诱导24、48 h后MSF p53 mRNA表达较0 h时表达显著升高(P<0.01)。见图5。
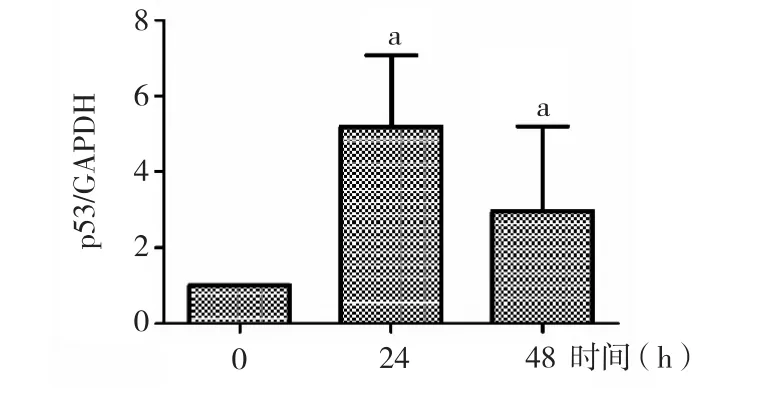
图5 D-半乳糖诱导衰老后MSF中p53基因表达变化情况
2.5 Sirt1细胞免疫荧光检测 细胞免疫荧光分析细胞Sirt1蛋白表达,Sirt1标记为绿色,DAPI标记细胞核为蓝色荧光,融合后,发生重叠,Sirt1主要表达在细胞核,但是D-半乳糖诱导48 h后Sirt1的表达明显降低。见图6。
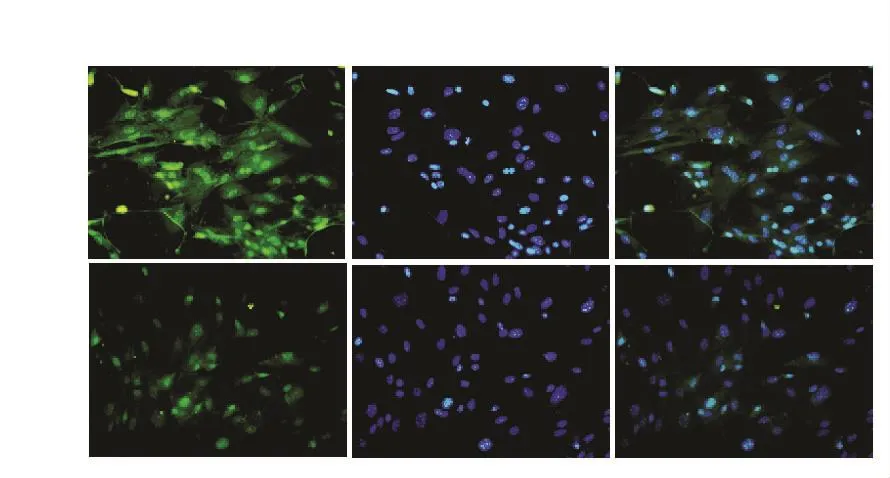
图6 皮肤MSF Sirt1免疫荧光染色结果(200×)
3 讨 论
细胞衰老是指细胞在执行生命活动过程中随着时间的推移,细胞增殖分化能力和生理功能逐渐发生衰退的变化过程,是正常细胞的必然归宿[4]。衰老细胞虽然仍保留一些细胞的基本代谢活性,但在细胞形态和功能上都已发生了很多根本性的改变。例如,细胞皱缩,膜通透性、脆性增加,核膜内折,细胞器数量减少,胞内出现脂褐素等异常物质沉积。衰老细胞同样拥有一些共同特点,主要表现在细胞增殖抑制、细胞周期阻滞、β-半乳糖苷酶活性增高等细胞功能的一系列变化[5]。目前,有研究表明,D-半乳糖所致衰老与自然衰老变化相似[6]。D-半乳糖是体内正常的营养成分,能够通过转变为葡萄糖,参与正常能量的代谢,如果D-半乳糖摄入过量则会导致机体多器官功能代谢紊乱,甚至产生对基因的表达和调控情况[7]。D-半乳糖使机体产生大量自由基,抗氧化能力减弱,脂质水平增加,从而导致机体引起亚急性衰老[8]。D-半乳糖衰老模型的涉及领域较广,不仅涵盖器官、组织和细胞形态学改变,还在信号通路的蛋白基因水平上均有研究[9],已成为研究衰老的经典细胞模型。
p53基因是一种与细胞生长、凋亡、衰老和DNA修复相关的重要基因。有研究发现,抑制p53基因的表达可以减少皮肤细胞的凋亡,并且延缓皮肤的衰老[10-12]。Sirt1基因是酵母长寿基因Sirt2的同源基因,参与了基因转录、能量代谢及细胞衰老等生理功能调节,Sirt1通过与蛋白的相互作用可抑制p53基因表达来调控细胞的凋亡进程,从而发挥对基因的调控作用[13]。在衰老过程中,Sirt1表达水平的降低可以增强p53的表达,从而加速细胞的凋亡和衰老[14]。
在衰老过程中,MSF的功能、形态和增殖潜力等方面发生了显著变化,并对皮肤的功能及稳态具有重要影响[15]。本研究采用Ⅰ型胶原酶消化法原代分离获得MSF,在倒置显微镜下观察细胞呈纺锤形或星形的扁平细胞,符合皮肤成纤维细胞的形态学特征。同时,原代培养细胞中Vimentin蛋白呈阳性表达,进一步提示原代分离培养的细胞为MSF。本研究通过D-半乳糖法建立细胞衰老模型,结果表明,D-半乳糖作用MSF后,可使MSF β-半乳糖苷酶阳性染色细胞数量明显增多、p53基因表达增强、Sirt1基因表达降低等细胞衰老的相关表现。
综上所述,本实验通过Ⅰ型胶原酶消化法建立了MSF培养方法,并通过D-半乳糖诱导法建立了MSF衰老模型,为开展皮肤衰老及老年相关疾病的研究提供了实验基础。

