丹参酮ⅡA配伍DAPT对UUO大鼠肾间质纤维化的影响
徐静雅,李 均,付 旭
(1.遵义医学院珠海校区 中药应用与基础研究重点实验室,广东 珠海 519000; 2.淄博市中心医院 肾内科,山东 淄博 255000)
肾脏纤维化是慢性肾脏疾病(chronickidneydisease,CKD)发展至终末期肾病(end-stage renal disease ,ESRD)的共同通路[1],包括肾小管间质纤维化、肾内血管硬化及肾小球硬化。课题组前期研究及相关文献证实丹参水溶性成分丹酚酸B、C可下调单侧输尿管梗阻(unilateral ureteral obstruction,UUO)大鼠肾组织α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、Ⅰ型胶原(Collagen I,ColⅠ)表达,抑制肾小管上皮细胞转分化,减缓肾纤维化进程[2]。丹参脂溶性成分丹参酮ⅡA具有较强抗炎、抗氧化作用,能有效清除氧自由基和改善微循环[3],并在抗肾纤维化过程中具有一定的防治作用[4]。Notch信号通路通过调控多种细胞增殖、分化在器官组织发育和发展平衡中发挥重要作用;γ-分泌酶抑制剂(γ-secretase inhibitor,DAPT)作为该通路内调节因子可有效抑制γ-分泌酶复合体阻断Notch通路传导作用[5]。查阅文献发现中西医分子药物之间配伍抗肾纤维化的研究少见报道,未发现DAPT配伍中药有效成分在防治肾纤维化方面的相关研究。据此课题组采用目前成熟应用于研究肾间质纤维化的UUO动物模型[6],观察丹参脂溶性活性成分丹参酮ⅡA配伍西药DAPT对UUO模型大鼠肾脏α-SMA、ColⅠ表达的影响,探索中西药物结合对肾脏纤维化的干预作用,以期为丹参酮ⅡA配伍DAPT防治肾间质纤维化提供实验依据。
1 材料与方法
1.1 动物 SPF级清洁健康SD雄性大鼠40只,10~12周,体重(200±20) g。由广东省医学实验动物中心提供,许可证号:SCXK(粤)2013-0002。
1.2 药物与试剂 丹参酮ⅡA (大连美仑生物科技公司,M1205A),DAPT(Solarbio,330A031),尿微量白蛋白(urine micro-albumin,UMA) 试剂盒和N-乙酰-β-D-氨基葡萄糖苷酶(N-Acety-β-D-Glucosaminidase,NAG)试剂盒(上海科华生物工程股份有限公司,编号 20170112、20170522),兔抗鼠α-SMA单克隆抗体(sigma,产品编号A5228),兔抗鼠Ⅰ型胶原多克隆抗体(博奥森生物公司,bs-10423R)。
1.3 仪器 日立7020全自动生化分析仪(日本株式会社日立),BX43奥林巴斯生物显微镜(OLYMPS,日本),Multiskan GO全波长酶标仪(Thermo Fisher Scientific,美国)。
1.4 方法
1.4.1 动物模型建立及分组 给药根据文献建立单侧输尿管梗阻大鼠肾间质纤维化模型[7]。3%戊巴比妥钠腹腔注射麻醉后,右侧腹部肾脏位置剃毛,消毒,切开皮肤,分离筋膜肌肉层,暴露右侧肾脏及肾门,正常组缝合关腹,造模组于紧贴肾门处结扎输尿管,再于输尿管远离肾门处二次结扎,在两结扎点间剪断输尿管以防逆行性感染。依次缝合肌肉、皮下组织及皮肤。40只大鼠随机分为正常组、模型组、丹参酮ⅡA组(丹参酮ⅡA 25 mg/kg)、DAPT组(DAPT 12 mg/kg)和丹参酮ⅡA+DAPT组(丹参酮ⅡA和DAPT分别为25、12 mg/kg),每组8只。依据文献查询及预实验不同剂量干预结果,干预组取最佳给药剂量。药物用0.5%羧甲基纤维素钠配制成相应浓度,给药体积为10 mL/kg,于造模第2天起给药,14 d后结束(ig,qd),正常组及模型组给予0.5%羧甲基纤维素钠溶液10 mL/kg。
1.4.2 观察检测指标
1.4.2.1 尿NAG和微量白蛋白含量测定 末次给药后用代谢笼收集过夜尿液,采用全自动生化分析仪检测尿液NAG、微量白蛋白。
1.4.2.2 肾组织病理,右侧肾脏取出后由4%多聚甲醛溶液固定24 h,经脱水、透明、浸蜡、包埋过程制成3 μm石蜡切片。①常规HE染色,每组大鼠制片8张,随机选取10个互不重叠视野,光镜下观察大鼠肾小管和肾间质病变情况;按Banff分级进行半定量计分,即0分:正常;1分:小管间质病变范围<25%;2分:病变范围26%~50%;3分:病变范围>50%。②Masson染色,每组8张切片在400倍镜视野下观察10个互不重叠间质视野,根据纤维染色阳性面积比例进行半定量分析,评分标准:0分:正常;1分:阳性面积<1/4;2分:阳性面积在1/4~1/2之间;3分:阳性面积>1/2。
1.4.2.3 大鼠肾组织α-SMA及ColⅠ表达检测3 μm切片经脱蜡水化,枸橼酸微波炉高温抗原修复后按免疫组织化学SP法步骤操作。应用Image-Pro-Plus6.0图像分析软件,在400倍镜视野下计算单位面积平均光密度,每组实验动物8只,每只采集3张切片,每组随机选取12张。
2 结果
2.1 丹参酮ⅡA配伍DAPT对UUO大鼠肾组织病理改变的影响
2.1.1 HE染色评分 正常组大鼠肾小球肾小管结构正常,大小均匀,排列紧密,无炎性细胞浸润;模型组肾小管代偿性扩张、萎缩,排列稀疏,小管间质明显增宽,间质内大量炎性细胞弥漫性浸润,纤维化明显。丹参酮ⅡA组大鼠肾小管扩张成囊状,部分萎缩。DAPT组大鼠肾小管部分基底膜断裂,肾间质大量炎性细胞浸润。丹参酮ⅡA+DAPT组大鼠仅见少量肾小管部分扩张,肾间质未见明显炎性细胞浸润。各干预组HE评分均较模型组降低(P<0.05),丹参酮ⅡA+DAPT组评分明显低于丹参酮ⅡA组和DAPT组(P<0.05,见图1)。

A:正常组;B:模型组;C:丹参酮ⅡA25 mg/kg组; D:DAPT12 mg/kg组;E:丹参酮ⅡA+DAPT组 25 mg/kg+12 mg/kg;F:肾间质损伤评分。黑色箭头所指为肾小管,红色箭头所指为炎症细胞。*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05;▼表示与丹参酮ⅡA +DAPT组比较,染色,×400。图1 丹参酮ⅡA配伍DAPT对UUO大鼠肾组织病理改变的影响
2.1.2 Masson评分 正常组大鼠肾脏胶原无或仅少量呈丝状沉积。模型组肾脏胶原沉积于肾小管上皮,间质呈弥漫性分布,胶原染色呈蓝色。丹参酮ⅡA组大鼠肾间质有部分胶原沉积。DAPT组肾间质有部分胶原沉积。丹参酮ⅡA+DAPT组大鼠肾组织胶原仅有少量呈丝状沉积。模型组及各干预组较正常组均显著升高(P<0.05),说明UUO大鼠肾组织纤维化严重。各干预组较模型组均显著下降(P<0.05),表明丹参酮Ⅱ、DAPT单一用药与配伍用药均可一定程度上改善大鼠胶原沉积(P<0.05)。各干预组间比较,丹参酮ⅡA+DAPT组评分下降明显,其中 DAPT组与丹参酮ⅡA+DAPT组比较有显著性差异(P<0.05,见图2)。
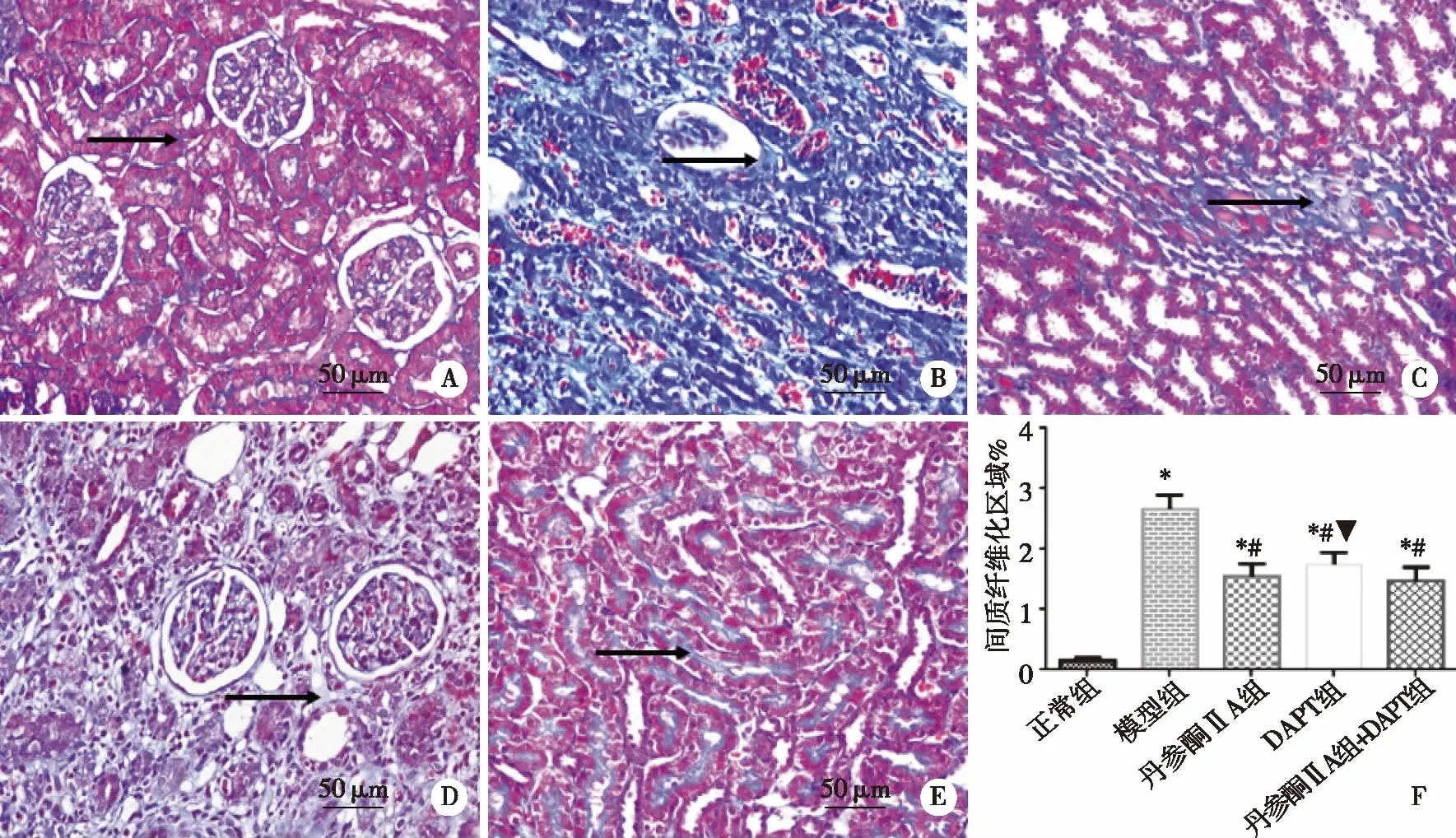
A:正常组;B:模型组;C:丹参酮ⅡA25 mg/kg组; D:DAPT12 mg/kg组;E:丹参酮ⅡA+DAPT组 25 mg/kg+12 mg/kg;F:间质纤维化评分。黑色箭头所指为胶原纤维沉积。*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05;▼表示与丹参酮ⅡA +DAPT组比较,染色,×400。图2 丹参酮ⅡA配伍DAPT对UUO大鼠肾间质纤维化的影响
2.2 尿NAG及微量白蛋白水平 模型组尿NAG、微量白蛋白水平与正常组比较明显升高(P<0.05);各干预组与模型组比较微量白蛋白丹参酮ⅡA组、丹参酮ⅡA +DAPT组水平均降低(P<0.05)。各干预组与模型组比较,尿NAG有升高趋势,但无统计学意义(见表1)。
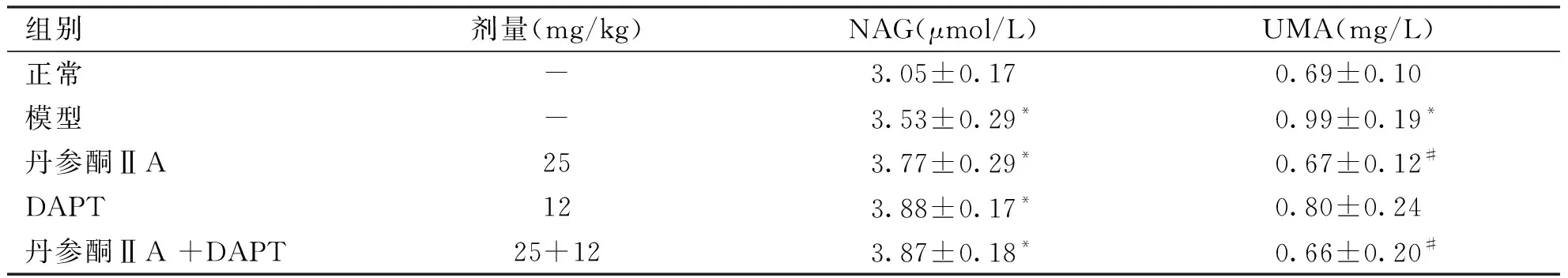
组别剂量(mg/kg)NAG(μmol/L)UMA(mg/L)正常-3.05±0.170.69±0.10模型-3.53±0.29*0.99±0.19*丹参酮ⅡA253.77±0.29*0.67±0.12#DAPT123.88±0.17*0.80±0.24丹参酮ⅡA +DAPT25+123.87±0.18*0.66±0.20#
*:表示与正常组比较,P<0.05;#:表示与模型组比较,P<0.05。
2.3 检测肾组织α-SMA及ColⅠ
2.3.1 α-SMA表达的变化 模型组α-SMA平均光密度较正常组升高(P<0.05);各干预组α-SMA平均光密度较模型组降低(P<0.05);各干预组间比较,丹参酮ⅡA+DAPT组α-SMA平均光密度低于丹参酮ⅡA与DAPT组(P<0.05,见表2)。正常组肾间质及基膜仅见极少量棕黄色颗粒分布;模型组肾间质以及基底膜中,棕黄色颗粒弥漫分布;丹参酮ⅡA组部分肾间质和肾小管基膜有较密集的棕黄色颗粒沉积;DAPT组肾间质、肾小管基膜可见棕黄色沉积;丹参酮ⅡA+DAPT组棕黄色颗粒与肾间质少量分布(见图3)。
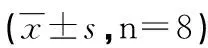
组别剂量(mg/kg)α-SMA(平均光密度值×10-2)Col Ⅰ(平均光密度值×10-2)正常-1.519 1±0.359 62.716 0±0.352 3模型-9.880 9±0.559 4*13.037 3±0.983 8*丹参酮ⅡA257.311 3±0.770 0*#▼4.624 2±0.570 8*#DAPT126.020 4±1.518 8*#▼8.952 2±1.307 5*#▼丹参酮ⅡA+DAPT12+253.608 7±0.351 8*#3.697 3±0.234 9*#
*:表示与正常组比较,P<0.05;#:表示与模型组比较,P<0.05,▼:表示与丹参酮ⅡA +DAPT组比较,P<0.05。
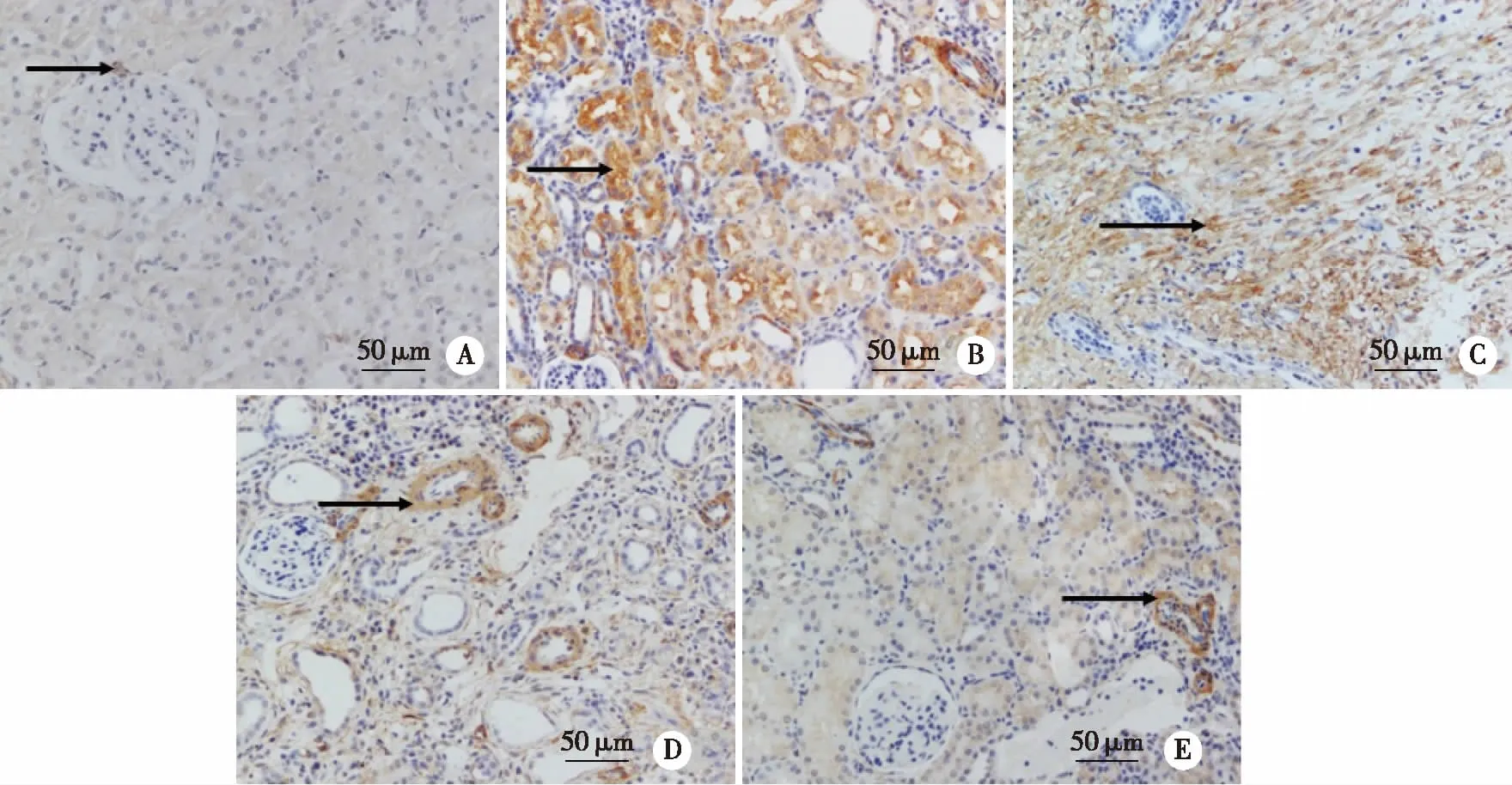
A:正常组;B:模型组;C:丹参酮ⅡA25 mg/kg组; D:DAPT12 mg/kg组;E:丹参酮ⅡA+DAPT组 25 mg/kg+12 mg/kg;黑色箭头所指为α-SMA表达的棕黄色颗粒沉积免疫组化染色,×400。图3 丹参酮ⅡA配伍DAPT对UUO大鼠肾组织α-SMA表达的影响
2.3.2 Col Ⅰ表达的变化 模型组Col Ⅰ平均光密度较正常组升高(P<0.05);各干预组Col Ⅰ平均光密度较模型组均降低(P<0.05);其中丹参酮ⅡA+DAPT组Col Ⅰ平均光密度治疗作用最为显著(见表2)。正常组肾组织毛细管旁有少量棕黄色颗粒分布;模型组肾小球肾间质及基底膜可见致密棕黄色颗粒沉积;丹参酮ⅡA棕黄色颗粒散在分布;DAPT组肾组织可见大量棕黄色沉积;丹参酮ⅡA+DAPT组病变较其余治疗组效果最为明显,仅有少量棕黄色颗粒沉积(见图4)。
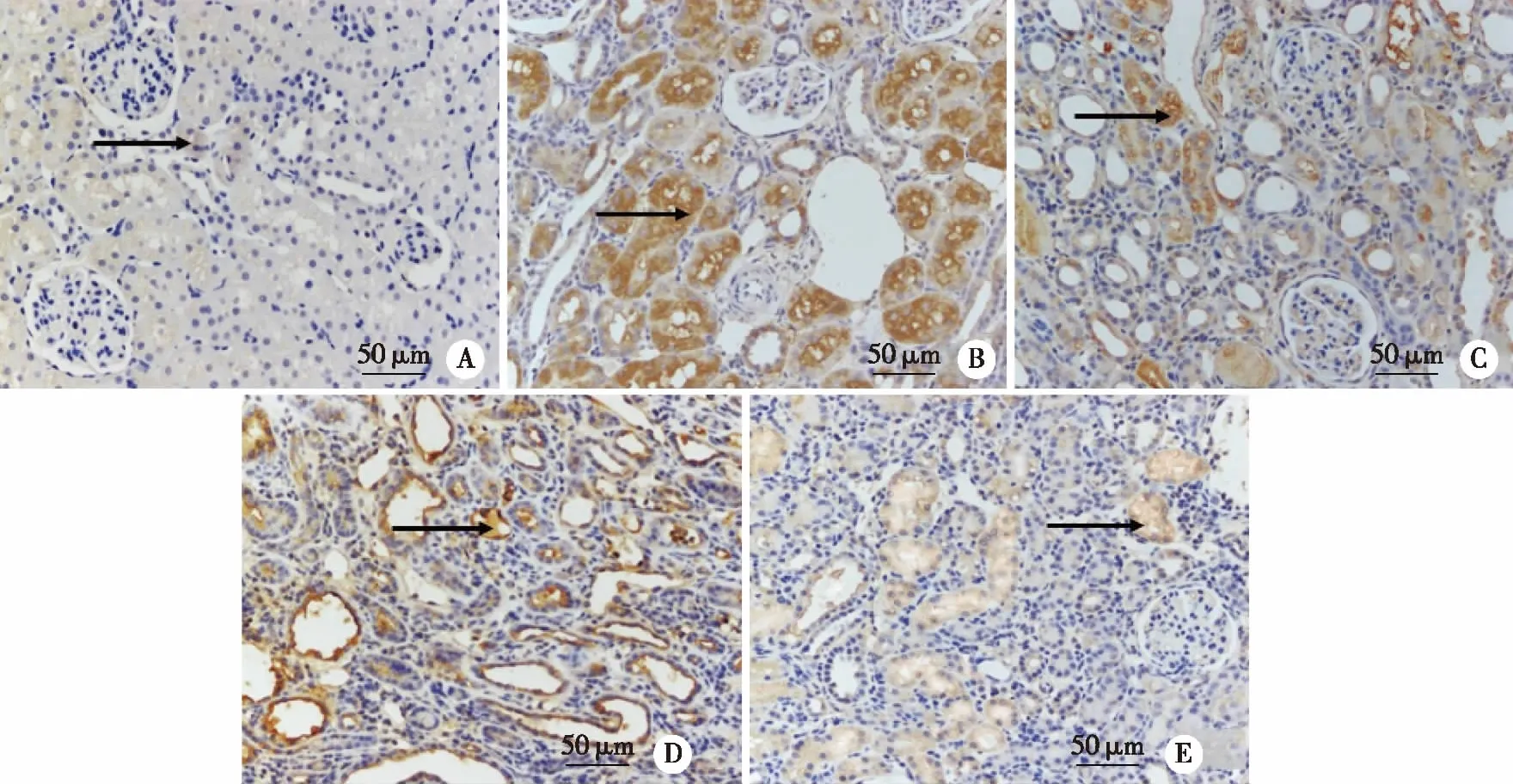
A:正常组;B:模型组;C:丹参酮ⅡA25 mg/kg组; D:DAPT12 mg/kg组;E:丹参酮ⅡA+DAPT组 25 mg/kg+12 mg/kg;黑色箭头所指为Col Ⅰ表达的棕黄色颗粒沉积免疫组化染色,×400。图4 丹参酮ⅡA配伍DAPT对UUO大鼠肾组织Col Ⅰ表达的影响
3 讨论
慢性肾病具有高发病率、高死亡率的特点,成为日渐重要的全球公共卫生问题[8]。肾脏纤维化的病理改变主要为细胞外基质(extra cellular matrixc,ECM )的沉积,如纤维连接蛋白和胶原蛋白,以及肾脏固有细胞向肌成纤维细胞转分化[9]。在间质组织稳态中,胶原蛋白的产生与沉积取决于基质中胶原降解与重塑的平衡[10]。目前研究表明胶原酶抑制剂可阻碍胶原蛋白降解过程,导致I型胶原蛋白异常表达,引起细胞外基质过度沉积[11],其中I型胶原蛋白在纤维沉积过程中占据主导地位,另有研究发现I型胶原可诱导间充质细胞向肌成纤维细胞转分化,成为评估疾病预后有价值的指标[12-13]。肌成纤维细胞(myofibroblast,MF)是合成ECM的重要细胞,特异性表达α-SMA,与组织纤维化的发展密切相关。在正常大鼠肾脏组织中,α-SMA仅在动脉平滑肌细胞中表达。Picard等[14]研究发现,UUO术后第 1 天,肾间质中便可见α-SMA异常表达,肾间质中固有成纤维细胞转分化在UUO术后早期即可启动,随着病变时间持续,肾间质中α-SMA 的表达呈进行性增加。因此,I型胶原蛋白与α-SMA参与了纤维化过程,在肾纤维化机制研究中具有重要作用。
丹参为唇形科植物,具有活血祛瘀、凉血消痈的功效。研究提示:确定中药方剂中的有效成分及其配伍规律,是目前中医药基础研究的趋势与热点[15]。课题组前期重点研究了丹参黄芪药对配伍以及丹参水溶性成分丹酚酸A、B、C分子药对配伍防治肾纤维化的效应,阐释了丹参水溶性有效成分配伍在防治慢性肾脏病的部分机制[16-17]。新近基础研究显示,丹参脂溶性成分丹参酮ⅡA可显著降低大鼠肾组织间充质标志性细胞α-SMA的表达[4],维持人肾小管上皮细胞(HK-2)形态稳定,抑制转化生长因子-β(transforming growth factor-β,TGF-β)的诱导,减少I型胶原蛋白的分泌[19],丹参酮ⅡA在肾纤维化病理进程中的防治作用同样不可忽视。Notch信号通路在肌成纤维转分化过程中具有诱导作用,其特异性抑制剂DAPT可靶向阻断Notch信号通路,下调TGF-β的表达和释放,抑制上皮细胞转分化和胶原的累积[19]。Bielesz等[5]在叶酸诱导小鼠肾纤维化模型及UUO模型中,证实DAPT可缓解肾间质纤维化的进展,抑制I型胶原蛋白合成;由此可见DAPT可能成为延缓肾纤维化的治疗手段。虽然丹参酮ⅡA与DAPT在肾纤维化进展中均具有一定防治作用,但二者中西药物结合联用后是否产生更好的防治属性鲜见研究报道。因此课题组通过建立UUO大鼠模型,研究丹参酮ⅡA配伍DAPT对肾纤维化的影响,为中西分子药对配伍抗肾纤维化提供新的模式,深入研究抗肾纤维化的分子机制。实验结果显示,丹参酮ⅡA、DAPT 及其配伍可阻碍肾间质胶原纤维沉积及肾组织损伤,有效下调α-SMA的表达,其中丹参酮ⅡA+DAPT 组效果最佳;各干预组均可有效下调ColⅠ的表达,其中丹参酮ⅡA+DAPT组与丹参酮ⅡA组比较ColⅠ有下降趋势但无统计学意义,表明丹参酮ⅡA配伍DAPT的协同作用对ColⅠ表达的下调作用不明显,但二者配伍是否通过其他类型胶原在纤维化进展中发挥协同作用需进一步深入研究。
Notch信号分子在肾脏发育阶段起主导作用[20-21],并在成人急性肾损伤后修复阶段对肾小球存活、增殖和分化起重要作用,其中非选择性Notch活化剂DLL4可促进肾功能的恢复,其作用机制可能与Notch不同受体作用相关[22],虽尚未有详细研究,但有实验数据表明Notch2对急性肾损伤后肾小球细胞的再生和增殖十分关键[23]。肾小球滤过功能受损是蛋白尿形成的主要原因,本实验结果显示,丹参酮ⅡA组及配伍组可有效减轻尿微量白蛋白形成,DAPT组与模型组比较虽有下降趋势但无统计学意义,其结果可能由DAPT组早期即对notch信号阻断导致,一定程度上抑制了早期肾小球细胞的再生修复,加重损害肾小球滤过功能。尿NAG是广泛应用于临床早期检测肾小管损伤的标记物,Sinha等[24]研究发现在肾损伤动物模型中,NAG于第六天升高达最高峰,随着肾小管形态学改变呈重度时,NAG升高趋势较前相比有所下降。肾纤维化是慢性肾脏病发展至终末期的表现,本实验形态学结果显示,模型组肾小管损伤严重、纤维化弥漫分布,各干预组较模型组的肾组织形态均有明显改善,本研究造模周期为14 d,实验结果显示,各干预组与模型组比较,尿NAG有升高趋势但无统计学意义,表明模型组终末期肾小管重度损伤NAG回降,干预组经药物干预肾组织损伤程度仍处于早中期升高阶段。
综上,丹参酮ⅡA配伍DAPT对UUO大鼠肾脏纤维化具有一定防护作用,可能成为今后延缓肾间质纤维化进展新的药对配伍之一。但两者协同作用机制以及是否通过协同干预Notch信号通路发挥抗肾纤维化作用值得深入研究。

