下腔静脉节段性切除术在肾癌伴下腔静脉癌栓中的应用
刘 茁,王国良,田晓军,张树栋,张洪宪,赵 磊,侯小飞,黄 毅,马潞林
(北京大学第三医院泌尿外科,北京 100083)
肾癌是常见的泌尿系统恶性肿瘤,肾癌中有4%~10%合并下腔静脉癌栓[1]。对局部进展期肾癌患者行根治性肾切除+下腔静脉瘤栓取出术能有效改善预后,其5年肿瘤特异性生存率为40%~65%[2]。肾癌合并下腔静脉癌栓的外科治疗目标是完全切除所有肿瘤负荷,下腔静脉壁受侵是疾病复发、预后不良的危险因素,如癌栓侵犯下腔静脉壁,未切除者的5年生存率为26%,切除者的5年生存率可达57%[3]。因此,对有下腔静脉管壁侵犯者,有必要切除被侵犯的血管壁[4]。癌栓侵犯下腔静脉壁范围较广时,需要行下腔静脉节段性切除术。但根治性肾切除术+下腔静脉癌栓取出术+下腔静脉节段性切除术的手术风险较高,术后并发症不可忽视。本文回顾性分析2016年1月至2017年6月北京大学第三医院泌尿外科收治的10例肾癌合并下腔静脉癌栓而行下腔静脉节段性切除术患者的临床资料。以探讨下腔静脉节段性切除术在治疗该类患者的安全性和有效性。
1 资料与方法
1.1临床资料患者行下腔静脉节段性切除术的手术指征为:①癌栓浸润性侵犯下静脉壁,且粘连较重者;②癌栓侵犯下静脉壁的范围达到周长的2/3以上;③癌栓已在下腔静脉内完全梗阻者。所有患者术前均行泌尿系B超以评估肾脏占位,包括侧别、位置、直径、与肾脏血管及集合系统的关系等。对碘过敏试验阴性、无相关禁忌证者行胸部CT平扫、腹部CT平扫+增强扫描进行肾脏肿瘤临床TNM分期[依据2010年国际抗癌联盟(International Union Against Cancer,UICC)推荐方法]。对CT检查提示下腔静脉癌栓(inferior vena cava tumor thrombus,IVCTT)者行腹部磁共振成像(magnetic resonance imaging,MRI)扫描以明确癌栓长度、癌栓是否侵犯腔静脉壁等。术前腹部MRI扫描提示癌栓浸润性侵犯下静脉壁的表现包括:①下腔静脉管壁毛糙、不光滑,有“毛刺征”;②下腔静脉增粗,超过正常下腔静脉直径的1.5倍(正常下腔静脉宽度为肝段以上近心房处下腔静脉的宽度);③下腔静脉管壁外侧可见水肿带。④下腔静脉内癌栓形态不规则。行超声心动图明确心脏功能及是否合并心房癌栓等。术前检查未发现远处转移。术前除外合并出血性疾病、心肺功能不全、不能耐受麻醉及手术等手术禁忌者。
采用美国麻醉医师协会(The American Society of Anesthesiologists,ASA)分级方法根据患者体质状况和手术危险性进行分类。本组10例肾癌患者中,合并Ⅱ级者5例,Ⅲ级者4例,Ⅳ级者1例。10例患者中,男性9例,女性1例。年龄31~73岁,平均(53.9±10.9)岁。体质指数(body mass index,BMI)为20.3~29.1 kg/m2,平均(24.3±2.9)kg/m2。肿瘤位于右侧6例,位于左侧4例。肿瘤直径5.8~20 cm,平均(11.0±5.1)cm。术前资料见表1。
1.2手术方法腹腔镜下根治性肾切除+下腔静脉癌栓取出术[5-6]:建立后腹腔空间;显露患侧肾门血管,以Hem-o-lok三重夹闭患侧肾动脉后切断;切断肾蒂周围淋巴管,清扫肾门淋巴结,游离出患侧肾静脉;沿肾周筋膜外游离肾脏;游离出输尿管后切断。
对于右侧肾肿瘤合并MayoⅡ级下腔静脉癌栓患者(编号1),术中切开下腔静脉壁,可见癌栓充满并完全阻塞下腔静脉,肿瘤侵犯下腔静脉管壁。癌栓下方可见机化血栓,与癌栓分界不清。遂行下腔静脉节段性切除术。因左肾静脉末端入下腔静脉入口处可见癌栓侵犯,遂节段切除左肾静脉,仅依靠左肾静脉属支回流血液。下腔静脉断端使用4-0 Prolene血管线缝扎。
对于左侧肾肿瘤合并MayoⅡ级下腔静脉癌栓患者(编号9),采用经后腹腔途径联合经腹腔途径下手术[5]。经后腹腔途径,将左侧肾脏除左肾静脉外完全游离。联合经腹腔途径游离下腔静脉。术中发现本例患者有3支右肾静脉,偏向右肾上极的1支肾静脉可见癌栓侵犯,遂节段切除此支右肾静脉。而其余2支右肾静脉未见癌栓侵犯,故保留此2支右肾静脉流出道。
开放癌根治性肾切除+下腔静脉癌栓取出术[5]采用右侧肋缘下2 cm处自剑突至腋中线,并向左侧肋缘下延长约5 cm,呈“人”字形切口。
对于右侧肾肿瘤合并MayoⅡ级下腔静脉癌栓患者(编号8),手术步骤同腹腔镜手术,行下腔静脉节段性切除术。左肾静脉末端未见癌栓侵犯,故保留左肾静脉流出道,因左肾静脉流出道汇入的下腔静脉管腔较细,故取下段部分下腔静脉管壁进行左肾静脉成形术,确保管腔通畅。
对于左侧肾肿瘤合并MayoⅡ级下腔静脉癌栓患者[5]:患者编号7采用开放根治性肾切除+下腔静脉癌栓取出术+下腔静脉节段性切除术;患者编号10先采用经后腹腔途径联合经腹腔途径下手术,术中探查左肾肿瘤与周围组织粘连较重,肾门处粘连尤重,血管分离困难,遂中转开放手术。此2例术中发现右肾静脉未见癌栓侵犯,故采用斜形截断下腔静脉,保留右肾静脉流出道回流至肝下腔静脉。
对于右侧肾肿瘤合并Mayo Ⅲ级下腔静脉癌栓患者(编号3、4、5),需充分显露肝后下腔静脉及肝静脉[7]。依次阻断肾静脉下方癌栓远端下腔静脉、健侧肾静脉、肝十二指肠动脉和门静脉、近端下腔静脉。行肝下下腔静脉节段性切除术。用4-0 Prolene血管线缝合下腔静脉上下两处断端及左肾静脉断端。仅依靠左肾静脉属支回流血液。
对于左侧肾肿瘤合并Mayo Ⅲ级下腔静脉癌栓患者(编号6),行下腔静脉节段性切除术。术中发现右肾静脉未见癌栓侵犯,故采用斜形截断下腔静脉,保留右肾静脉流出道。
对于右侧肾肿瘤合并MayoⅣ级下腔静脉癌栓患者(编号2)[8-9],术中采用经食道超声检查发现癌栓顶端位于下腔静脉入右心房处。取胸部正中切口开胸,打开心包。同时取右腹股沟2 cm纵行切口游离出股静脉,建立体外循环。行肝下下腔静脉节段性切除术。用4-0 Prolene血管线缝合下腔静脉上下两处断端。节段切除左肾静脉,仅依靠左肾静脉属支回流血液。
1.3术后并发症及严重并发症诊断标准采用改良Clavien分级系统[10]评估术后并发症,≥Ⅲ级并发症定义为严重并发症[11]。
1.4随访方法首次随访在术后1月进行,之后每3~6月随访一次,2年后每年随访一次。随访检查主要内容包括生化(肾功能)、腹部B超和/或泌尿系增强CT、胸片或胸部增强CT等,以除外局部复发或转移。
2 结 果
本组10例肾癌合并下腔静脉癌栓患者,术中均因癌栓侵犯下腔静脉壁范围较广而行下腔静脉节段性切除术。手术均顺利完成,无术中死亡病例。7例患者行开放途径手术,2例行腹腔镜下手术。1例患者先采用腹腔镜途径,后中转开放手术。术中资料见表2,术后资料见表3。
手术时间288~556 min,平均(399.2±91.5) min。术中出血量300~4 000 mL,平均(1 450.0±1 136.5)mL。术中输注悬浮红细胞者7例,输血量600~2 800 mL,平均(1 342.9±718.5)mL。术中输注血浆者4例,输血浆量400~1 000 mL。术后住院时间8~39 d,平均(16.7±9.6)d。10例患者术前血肌酐值85~958 μmol/L,平均(188.0±270.8)μmol/L。术后1周血肌酐值63~1 013 μmol/L,平均(260.4±327.9)μmol/L。
本组10例患者中,6例发生术后早期并发症。ClavienⅡ级并发症4例,其中发生双下肢水肿合并下肢静脉血栓者2例,发生单纯下肢静脉血栓者1例,均予低分子肝素治疗后好转;发生肠梗阻1例,予禁食补液后好转。Clavien Ⅳa级并发症2例,表现为肾功能不全。10例患者均获随访,随访时间2~14个月,中位随访时间8个月。10例患者中发生远处转移1例,为骨转移合并肺转移。1例(10%)出现肿瘤特异性死亡。

表2 下腔静脉癌栓患者术中资料(n=10)
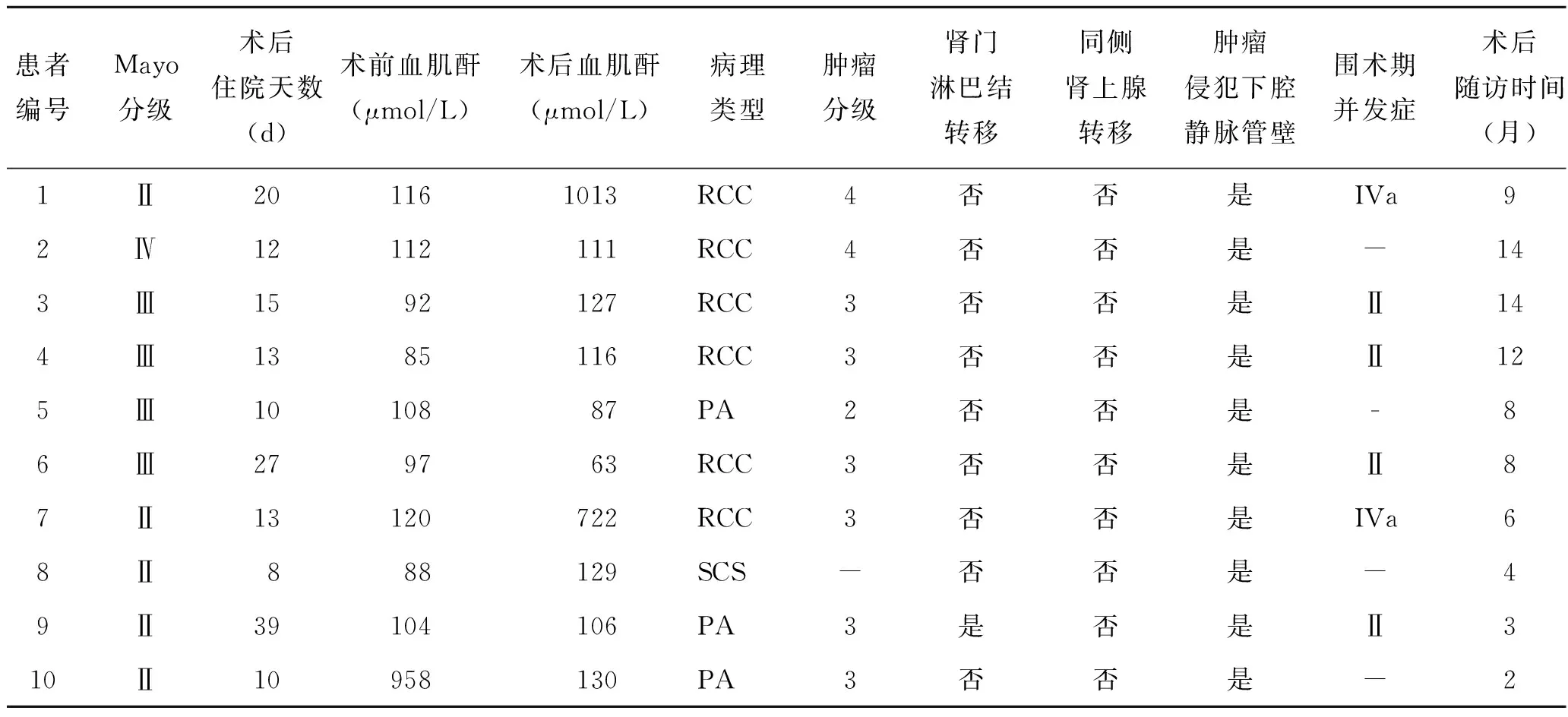
表3 下腔静脉癌栓患者术后资料(n=10)
RCC:肾透明细胞癌;PA:肾乳头状腺癌;SCS:梭形细胞肉瘤。
3 讨 论
根治性肾切除+下腔静脉瘤栓取出术能有效改善局部进展期肾癌患者的预后。对有下腔静脉管壁侵犯者,有必要切除被侵犯的血管壁,以达到完全切除所有肿瘤负荷的外科治疗目标。癌栓侵犯下腔静脉壁范围较广时,需要行下腔静脉节段性切除术。而对于其他下腔静脉壁受侵范围不大的患者,切开下腔静脉取出癌栓,切除受侵的部分下腔静脉血管管壁后,直接采用4-0 Prolene血管线连续缝合下腔静脉壁即可。下腔静脉节段性切除术在解剖学上存在可行性。肾静脉至髂总静脉分叉的下腔静脉周围侧支血管可保证盆腔脏器和下肢的静脉回流。肾下段的下腔静脉侧支循环的沟通主要依靠:腹壁下静脉、腰静脉侧支、椎静脉丛、奇静脉系统及腹壁浅静脉等血管。
对于下腔静脉癌栓广泛侵犯下腔静脉管壁的患者,可出现下肢水肿、单纯右侧精索静脉曲张、腹壁表浅静脉曲张等。但是当癌栓造成下腔静脉完全梗阻时,人体可以代偿形成侧支循环,可没有下腔静脉梗阻的症状和体征。下腔静脉MRI扫描可以用于明确癌栓长度,判断癌栓是否侵犯下腔静脉壁等。MRI检查诊断癌栓浸润下腔静脉壁的敏感性、特异性及准确率分别为100%、89%和92%[11]。GOHJI等[12]回顾性分析了18例行下腔静脉癌栓切除术的患者资料后认为,术前腹部CT中下腔静脉直径大于40 mm是下腔静脉管壁被癌栓侵犯的危险因素。ZINI等[13]在一项32例下腔静脉癌栓切除术的研究中发现,术前MRI中下腔静脉的前后径>18 mm或肾静脉入下腔静脉开口处直径>14 mm是下腔静脉管壁被癌栓侵犯的危险因素,且此种方法预测下腔静脉管壁受侵的敏感性达到90%。SOHAIB等[14]认为MRI对下腔静脉管壁受侵的敏感性为92%,作者总结了一些癌栓侵犯下腔静脉管壁的特征表现:在下腔静脉血管壁内外侧可探及肿瘤的信号;下腔静脉血管壁内外侧探及炎症水肿的信号;T1加权像上低信号的血管壁连续性中断等。尽管术前影像学检查可一定程度上判断癌栓是否侵犯下腔静脉壁,术中视诊仍是一种准确有效的方法。术中判断癌栓侵犯下腔静脉壁的征象为:术中切开下腔静脉壁后可见血管壁毛糙、不光滑,颜色变白;触诊质地较硬,血管弹性差。
下腔静脉造影可判断下腔静脉内癌栓的梗阻情况,并显示静脉侧支循环的建立,从而在术前判断是否可行下腔静脉离断瘤栓切除术。国内现有文献中只有不到15%的癌栓病例会使用下腔静脉造影,而国外的学者认为该检查存在一定假阳性或假阴性可能,同时存在引起癌栓脱落致肺栓塞或癌栓脱落扩散的风险。但是也有学者认为随着造影技术的进步,其安全性已经大大提高。因此,下腔静脉造影的使用存在争议。
肾癌合并下腔静脉癌栓的外科治疗目标是完全切除所有肿瘤负荷。如癌栓侵犯下腔静脉管壁,应彻底切除受累的腔静脉壁,使外科手术切缘达到阴性,以提高患者术后存活率。如癌栓侵犯下腔静脉壁,未切除与切除受侵的下腔静脉壁者的5年生存率分别为26%,57%[6],说明是否切除受侵的下腔静脉壁对预后影响很大。不同侧别的肾癌患者,行下腔静脉节段性切除术后肾功能恢复具有差异。右肾癌伴下腔静脉癌栓可行下腔静脉节段性切除术,多数情况下不影响左肾功能,个别患者需透析治疗2~4周肾功能即可恢复,因为左肾静脉接受性腺静脉、肾上腺静脉、腰静脉的回流,容易建立侧支循环。如左肾静脉末端入下腔静脉入口处可见癌栓侵犯,则可节段切除左肾静脉,断端使用4-0 Prolene血管线缝扎。如左肾静脉末端未见癌栓侵犯,则可保留左肾静脉流出道,通过肾下段的下腔静脉(肾静脉以下至髂总静脉分叉处)回流。如术中发现左肾静脉流出道汇入的下腔静脉管腔较细,可取下段部分下腔静脉管壁进行左肾静脉成形术,确保回流的血管管腔通畅。我们认为,右肾癌伴下腔静脉癌栓行下腔静脉节段性切除术安全有效,下腔静脉均可单纯结扎或切除而无需血管重建。左肾癌合并下腔静脉癌栓需节段性性切除下腔静脉时,因右肾静脉分支小且少,无法建立足够的侧支循环,须行自体肾移植或静脉分流术。具体方法为:①用右肾静脉与肾下段的下腔静脉(肾静脉以下至髂总静脉分叉处)做端侧吻合的分流术。通过腹壁下静脉、腰静脉侧支、椎静脉丛等侧枝循环回流。②如果术中发现右肾静脉开口未见癌栓侵犯,可采用斜形截断下腔静脉,保留右肾静脉流出道。③如患者右肾有多支静脉,可节段切除癌栓侵犯的右肾静脉,而保留未被癌栓侵犯的右肾静脉流出道。
本研究存在的不足:本研究是回顾性研究,随访时间短,需要更多病例数的长期随访研究。在手术记录中未精确测量下腔静脉切除长度。根治性肾切除术+下腔静脉癌栓取出术+下腔静脉节段性切除术存在发生术后早期并发症的可能,但通过积极治疗多数可好转。下腔静脉节段性切除术在治疗肾癌伴下腔静脉癌栓患者中较为安全有效。

