HLA-A基因多态性与陕西地区回族非梗阻性无精症的相关性研究
孙亚丽,雷建园,吕茉琦,葛 攀,李意新,王世捷
(1.陕西省人民医院病理科,陕西西安 710068;2.西安交通大学医学部病理系,陕西西安 710061;3.西安交通大学医学部生殖医学中心,陕西西安 710061)
统计数据显示,全球10%~15%已婚夫妇患有不孕不育,其中男性原因引起的不育约占50%[1]。而50%~65%的男性不育病因和发病机制不明,称为特发性男性不育症[2]。非梗阻性无精症(non-obstructive azoospermia,NOA)是特发性男性不育的重要类型之一,由于病因不明,给临床诊疗带来了很大困难,目前尚缺乏根本有效的预防和治疗手段[3]。
关于NOA的病因和发病机制有很多学说,其中遗传学说是科学家关注的焦点之一[2-3]。人类白细胞抗原(human leukocyte antigen,HLA)是一种高度多态性的人类基因系统,定位于第6染色体短臂。研究显示HLA基因的多态性不仅和人类进化、亲缘关系密切有关,而且其高度复杂性和多态性也使其与多种疾病的易感性密切相关[4-5]。HLA-A属于HLA I类基因,MIURA等[6]报道显示日本人群中HLA-A33基因高表达与日本男性NOA发生密切相关, 而ALEKSOVSKI等[7]研究显示HLA-A26、A28基因高表达与前南斯拉夫男性NOA发生密切相关。ZHOU等[8]也初探了HLA-A基因多态性与中华汉族NOA的相关性。
众所周知,基因的多态性常具有民族、人种和地域差异[8-9],回族是中国人口较多的一个少数民族,陕西回族又是回族的重要支脉。因此,本研究依托的陕西省特有的人口资源优势,利用先进的聚合酶链反应-直接测序(polymerase chain reaction sequence-based typing,PCR-SBT)技术,探索HLA-A基因在陕西回族NOA人群中的分布及其与NOA发病风险的相关性。
1 对象与方法
1.1研究对象NOA病例选自2012年1月至2017年5月期间在西北妇女儿童医院生殖中心、西安交通大学生殖医学中心以及西京医院生殖中心等地就诊的20~42岁男性不育患者,均系回族且排除隐睾、精索静脉曲张、梗阻性无精症、染色体异常以及全身性疾病等引起的继发性不育。对照组为有正常生育史的健康陕西回族男性,年龄20~40岁。本研究方案经西安交通大学医学伦理委员会审批通过,每位研究对象均被告知研究目的、方法和意义,并签署知情同意书。
本研究最终入选59例陕西回族NOA患者和61例陕西回族健康对照。其中NOA病例组平均年龄(31.63±3.92)岁,正常健康对照组年龄(30.75±3.97)岁,两组之间无明显年龄差异(P=0.228)。此外,HLA-A基因在NOA病例组(P=0.4777)和对照组(P=0.3562)人群中的分布均符合Hardy-Weinberg平衡。
1.2静脉血采集与全血基因组DNA提取采集病例组与对照组每人2 mL外周静脉血于乙二胺四乙酸(Ethylenediaminetetraacetic acid,EDTA)抗凝管中,-20℃冰箱内冻存备用。 全血基因组DNA提取过程严格参照全血DNA提取试剂盒说明书(北京鼎国生物技术有限公司)进行。
1.3PCR-SBT方法进行HLA-A位点基因分型应用PCR-SBT对HLA-A位点进行基因多态性检测。具体方法为:首先对HLA-A基因的第2 外显子和第3外显子进行基因扩增,整个基因扩增过程严格按照试剂盒说明书进行(SeCoreTM, Invitrogen);其次将得到的PCR产物纯化;然后利用 ABI-3730XL DNA测序仪进行序列测定。
1.4统计学分析采用Arlequin 3.5软件(Laurent Excoffier,Zoological Institute,University of Bern,Switzerland)对HLA-A基因位点进行Hardy-Weinberg平衡检测。采用PowerStat Version 1.2软件 (Promega Corporation,Madison,WI,USA)计算HLA-A位点的多项基因学参数包括期望杂合度(heterozygotes,Het)、观察纯合度(homozygotes,Hom)、多态信息量(polymorphism information content,PIC)、个体识别率(power of discrimination,PD) 和非父排除率(probability of paternity exclusion,PPE)等。采用SPSS 17.0 for Windows 软件计算HLA-A位点的等位基因频率。采用χ2检验和Fisher’s检验检测病例组与对照组HLA-A位点的基因频率差异。最后,通过计算比值比(odds ratio,OR)及95%可信区间(95% confidence interval,CI)评估基因易感性风险。以P<0.05为差异有统计学意义。
2 结 果
2.1HLA-A基因位点的多态性参数杂合度(Ho)、期望杂合度(He)、PIC、PD和PPE,这些基因参数信息用来评估基因多态性。当PIC值>0.5, PD值>0.8以及PPE值>0.5,均表明此基因是高度多态性的。
由表1可见,HLA-A基因在NOA病例和对照组人群中的PIC、PD和PPE值均高于临界值,说明HLA-A基因在NOA病例组和对照组人群中分别呈高度多态性。
表1HLA-A基因在NOA病例和健康对照人群中的基因多态性参数
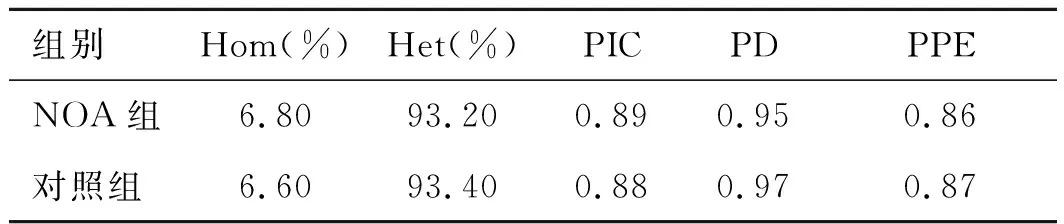
组别Hom(%)Het(%)PICPDPPENOA组6.8093.200.890.950.86对照组6.6093.400.880.970.87
2.2HLA-A基因型在NOA病例组和对照组的分布情况由表2可见,病例组和对照组均检测到19种HLA-A基因型。其中基因型频率>5%者:病例组有9种,从高到低依次分别为HLA-A*11∶01 (20.3%),A*24∶02 (14.4%),A*26∶01 (10.2%),A*02∶01 (9.3%),A*01∶01 (7.6%),A*03∶01(5.9%),A*02∶06(5.1%),A*02∶07(5.1%) 和A*31∶01 (5.1%);对照组有7种,从高到低依次分别为HLA-A*11∶01 (22.1%),A*02∶01 (13.9%),A*24∶02 (12.3%),A*02∶07(7.4%),A*02∶06(6.6%),A*01∶01 (5.7%)和A*31∶01 (5.7%)。
2.3HLA-A基因型分布与NOA易感性之间的关系多数HLA-A位点的等位基因频率在NOA病例与对照组中未见明显差异。但HLA-A*26∶01 等位基因在NOA组的频率明显高于对照组(表2),即HLA-A*26∶01 基因型具有较高的NOA患病风险(OR=3.340,95%CI:1.045~10.670)。此外,为了和以前的研究对比,我们依据SCHREUDER等[10]的研究方法把高分辨率HLA-A基因型转换成为血清型分型,最终21种不同类型的HLA-A高分辨率基因型分转换成12种血清型,如表3所示,大多血清型在病例组和对照组之间没有差异,但A26血清型具有较高的患病风险(OR=3.340,95%CI:1.045~10.670)。
表2高分辨率HLA-A位点等位基因在NOA病例组与对照组中的分布
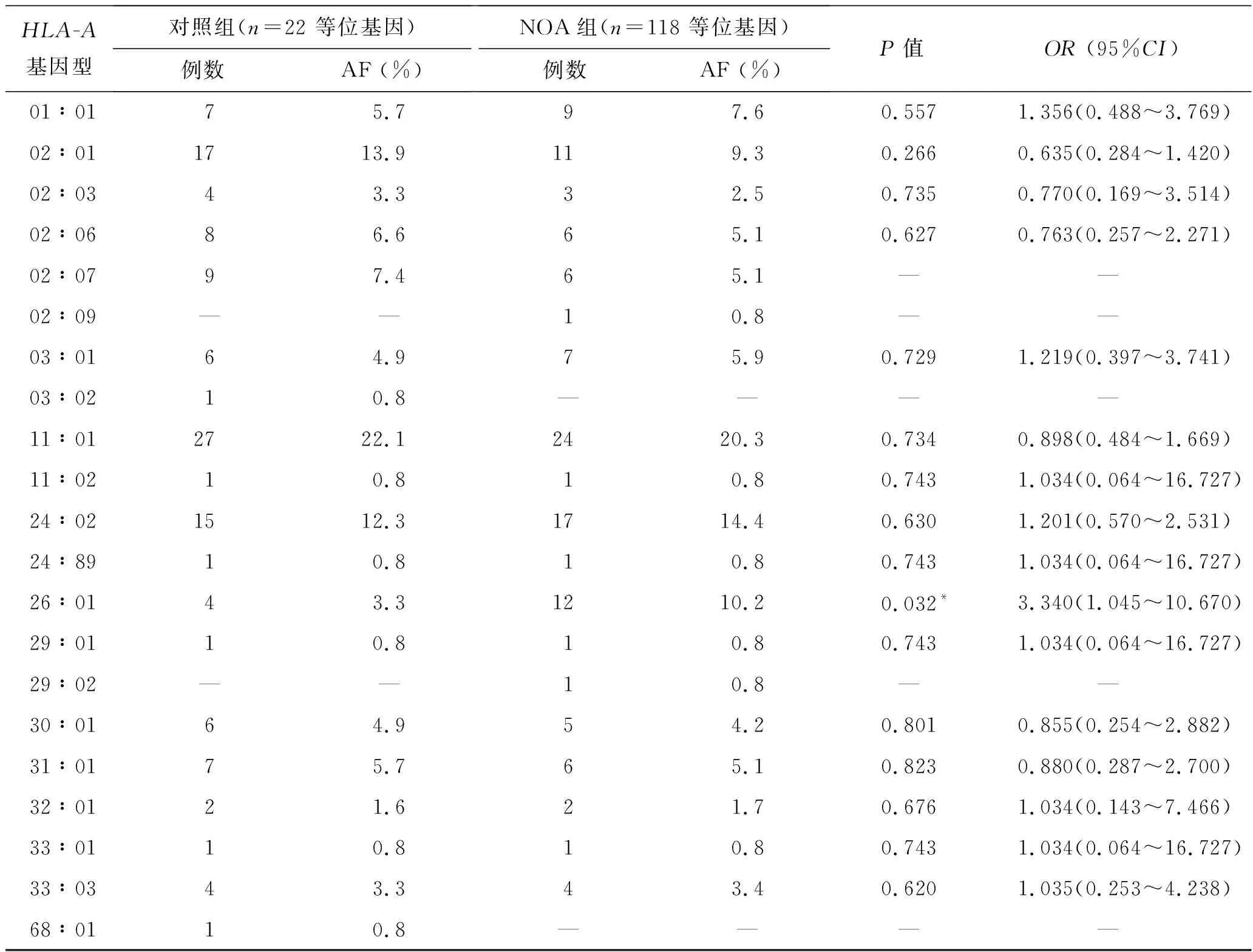
HLA-A基因型对照组(n=22 等位基因)例数AF (%)NOA组(n=118 等位基因)例数AF (%)P值OR (95%CI)01∶0175.797.60.5571.356(0.488~3.769)02∶011713.9119.30.2660.635(0.284~1.420)02∶0343.332.50.7350.770(0.169~3.514)02∶0686.665.10.6270.763(0.257~2.271)02∶0797.465.1— —02∶09——10.8— —03∶0164.975.90.7291.219(0.397~3.741)03∶0210.8——— —11∶012722.12420.30.7340.898(0.484~1.669)11∶0210.810.80.7431.034(0.064~16.727)24∶021512.31714.40.6301.201(0.570~2.531)24∶8910.810.80.7431.034(0.064~16.727)26∶0143.31210.20.032*3.340(1.045~10.670)29∶0110.810.80.7431.034(0.064~16.727)29∶02——10.8— —30∶0164.954.20.8010.855(0.254~2.882)31∶0175.765.10.8230.880(0.287~2.700)32∶0121.621.70.6761.034(0.143~7.466)33∶0110.810.80.7431.034(0.064~16.727)33∶0343.343.40.6201.035(0.253~4.238)68∶0110.8——— —
AF:等位基因频率;OR:比值比;CI:可信区间;*P<0.05,病例组和对照组有显著差异。
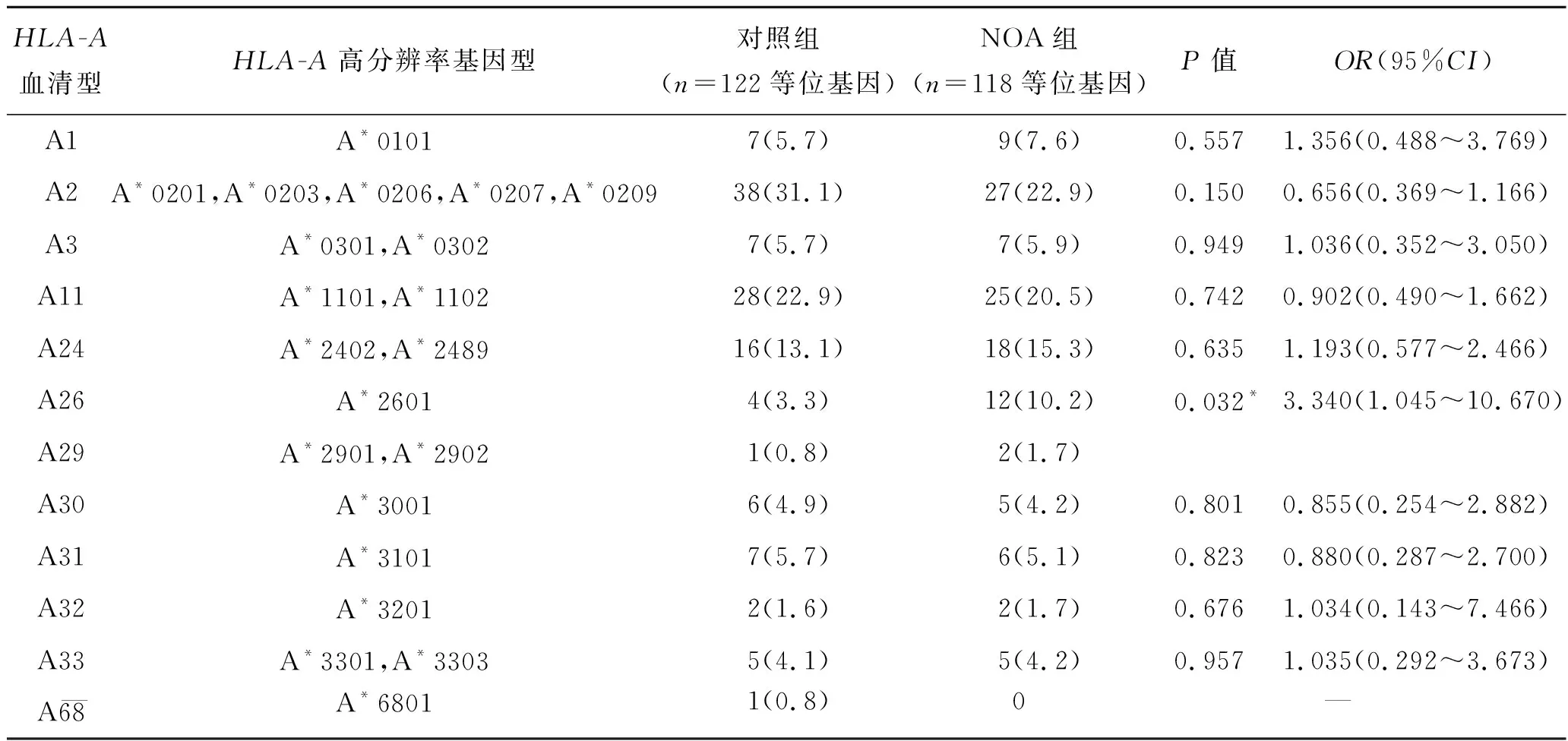
表3 HLA-A位点血清型分型在NOA病例组与对照组中的分布[例(%)]
OR:比值比;CI:可信区间。
3 讨 论
NOA即原发性无精症,是一种特殊类型的睾丸生殖病理损害。目前研究热点集中在从分子角度阐明NOA发病机制[11],从而达到防控NOA的目的。
本研究首次在陕西回族人群中利用先进的PCR-SBT技术探索HLA-A基因在NOA患者中的多态性分布及其与NOA之间的易感联系。研究结果显示:与对照组相比,HLA-A*26∶01 基因型在NOA组高表达,也就是说,HLA-A*26∶01 基因型与陕西回族人群NOA发病风险明显关联。此研究结果与ALEKSOVSKI等[7]在前南斯拉夫NOA患者中的研究结果一致;这一现象并没有在汉族NOA人群中发现[8]。目前关于HLA-A与男性不育相关性的研究结果并不一致:MIURA等[6]报道显示日本人群中HLA-A33基因高表达与日本男性NOA发生密切相关,而ALEKSOVSKI等[7]研究显示HLA-A26、A28基因高表达与前南斯拉夫男性NOA发生密切相关,ZHOU[8]、NORDLANDER[12]和MARTIN-VILLA等[13]的研究却没有发现HLA-A与男性不育易感有关。这些不一致的研究结果可能归因于HLA分型方法、样本尺寸、样本种族以及地域的差异。
HLA 分型方法有多种,HLA低分辨率分型(即血清型分型)的方法包括序列特异性寡核苷酸探针分型(PCR-SSOP,DNA amplification with specific oligonucleotide probes)以及序列特异性引物分型(PCR-SSP,DNA amplification with sequence-specific primers)。与以往实验中采用的低分辨率分型不同,我们这次采用PCR-SBT对 HLA等位基因进行高分辨率分型,是目前HLA 分型最直接和最准确的方法[8]。为了和以往的低分辨率研究做比较研究,我们利用SCHREUDER等[10]的研究方法把高分辨率HLA-A基因型转换成为低分辨率的血清型分型。不管是高分辨率基因分型还是低分辨率血清学分型,结果均显示HLA-A*26∶01 基因型(相当于HLA-A26血清型)与陕西回族人群NOA发病风险明显关联。
此外,本研究的基因参数如纯合度(Ho)、He、PIC、PD和PPE均显示HLA-A基因在NOA病例组和对照组呈现多态性分布,而且在两组中的分布均符合Hardy-Weinberg平衡。另一方面,本研究人群均排除了隐睾、精索静脉曲张、梗阻性无精症、染色体异常以及全身性疾病等引起的继发性不育,且病例组和对照组均选用在陕西地区居住的回族男性,进一步排除了种族差异和地理环境对实验结果的影响。
综上,本结果初步证实了HLA-A*26∶01 基因型(相当于血清型HLA-A26)与陕西回族人群NOA发病风险的相关性。然而,后续仍需要在更大的人群样本中进行验证,并且需要进一步探索其调控生精的分子机制,为阐明NOA发生发展机制提供有价值的线索和实验依据。

