不同麻醉状态对大鼠膀胱测压的影响
何育霖,李云龙,文一博,何翔飞,冯锦锦,马 源,汪熙正,邢 栋,李 琦,陈 燕,徐鹏超,翟荣群,文建国
(郑州大学第一附属医院泌尿外科,小儿尿动力学中心和河南省小儿尿动力国际联合实验室,河南郑州 450052)
动物实验为解决临床问题做出了巨大的贡献,很多疾病要通过动物实验研究其发生机制,从而指导药物的研发和疾病诊治[1]。随着泌尿外科学的不断发展,动物实验在泌尿系统疾病研究中的作用也越来越重要[2]。下尿路功能障碍是泌尿外科研究中的一个重要方向,比如膀胱过度活动症(overactive bladder,OAB)、下尿路症状(lower urinary tract symptoms,LUTS)、神经源性膀胱(neurogenic bladder,NB)等等[3-6]。以大鼠为研究对象的动物实验在这些疾病的发病机制及诊疗方法的研究中发挥着巨大的作用。而对这些疾病动物模型的研究,一个必不可少的膀胱功能检测方法就是大鼠的膀胱测压技术,因为它是目前检测膀胱功能的金标准[7-8]。目前常用的大鼠膀胱测压方法是麻醉状态下膀胱测压和清醒状态下膀胱测压[9-10]。但不同的麻醉状态(浅麻醉和深麻醉)对尿动力结果可能会有一定的影响,因此,了解大鼠在两种状态下膀胱测压结果的差异,对我们研究大鼠模型的膀胱功能十分重要,进而使动物模型更好地服务于临床。然而目前国内外关于不同麻醉状态对大鼠膀胱测压的影响及与清醒状态膀胱测压结果比较的研究较少,故本研究拟探讨不同麻醉状态下大鼠的膀胱测压结果与清醒状态膀胱测压结果的差异,为动物膀胱测压研究提供参考。
1 材料与方法
1.1研究对象18~24周龄SD雄性大鼠13只体重350~400 g,由河南省动物中心提供。
1.2材料和仪器膀胱测压导管:一次性使用。静脉输液针(苏云)后面的软管(外径2.5 mm,内径1.5 mm),软管的一端用火机烧成小领口(可以预防软管从膀胱脱出)。膀胱测压装置:BL-420/820生物机能实验系统(成都泰盟软件有限公司),微量注射泵(德国贝朗)。麻醉药物:水合氯醛(科密欧国药集团化学试剂有限公司产品)。
1.3大鼠麻醉状态评定应用ANTUNES等[11]报道的大鼠肢体反应麻醉评分法评定大鼠的麻醉深度(评分表见表1),1分为深麻醉状态,4分为浅麻醉状态。采用10%水合氯醛氯化钠水溶液0.3 mL/100 g麻醉大鼠,麻醉生效后,对大鼠行膀胱造瘘术,术后根据大鼠的肢体行为给大鼠进行麻醉评分,对于评分为1分的直接进行膀胱测压,大于1分的给大鼠适当追加麻醉药使其评分达到1分后再进行膀胱测压。深麻醉测压后继续观察大鼠,当大鼠恢复至评分为4分时再给大鼠进行浅麻醉状态膀胱测压。
1.4大鼠膀胱测压
1.4.1大鼠膀胱顶造瘘 麻醉(10%水合氯醛氯化钠水溶液0.3 mL/100 g麻醉)生效后,行下腹正中切口长约1~2 cm,显露膀胱顶部,先用4-0带线涤纶缝合针(上海浦东金环医疗用品辜负有限公司)在膀胱顶部先荷包式缝合一周,在荷包中间用4.5号针头于膀胱顶部刺穿膀胱后用显微镊尖扩张穿刺孔,将静脉输液针软管袖头通过穿刺孔插入膀胱,之后扎紧荷包,在剑突下1.5 cm处皮肤切开长约1 cm小口,用16号针头穿刺腹壁后将软管由穿刺孔从腹腔引出,并于穿刺孔处用4号丝线将软管固定一针,之后用4号丝线缝合腹直肌前鞘及下腹部切口,用无菌纱布保护上腹部切口翻转大鼠至俯卧位在颈部正中用剪刀剪开长约0.7 cm的小口,用眼科剪分离皮下,然后翻转大鼠至仰卧位,在上腹部切口处于皮下用弯钳分离隧道至颈部切口,将软管从剑突下出口经皮下隧道在颈部背侧穿出,并于颈部切口用4号丝线固定一针。然后翻转大鼠至仰卧位用4号丝线缝合上腹部切口,大鼠膀胱造瘘完成。
1.4.2深麻及浅麻程度下大鼠膀胱测压 将造瘘后的大鼠俯卧位固定四肢,将T型管一个侧管连接灌注泵,另一侧管连接膀胱测压管,T型管的汇总管连接BL-420/820生物机能实验系统的测压通道。微量泵应用20 mL注射器作为灌注容器。将大鼠耻骨联合位置放置于测压传感器插头位置等高,打开电脑BL-420/820生物机能实验系统界面,应用的通道设置为压力感受通道,启动压力检测,开启灌注泵将T型管软管中的空气排净,将膀胱测压管在大鼠操作台平面(相当于大鼠耻骨联合位置)调零后与大鼠背侧造瘘管连接,开启灌注泵,以0.1 mL/min的速度向膀胱灌注18 ℃的生理盐水,在BL-420/820生物机能实验系统记录膀胱压力曲线。观察至压力曲线稳定后出现3个排尿周期,同时观察大鼠尿道口的排尿情况。在大鼠深麻及浅麻醉状态时记录大鼠的膀胱压力曲线,并观察大鼠尿道口的排尿情况。
1.4.3清醒状态下大鼠膀胱测压 术后第2天大鼠已彻底清醒并能自如活动,将大鼠放置于限制性鼠笼中,同法准备好大鼠膀胱测压设备后将大鼠的背侧膀胱造瘘管塞子取下,将膀胱测压管端口对准鼠笼底部(相当于大鼠耻骨联合位置)调零后与大鼠背侧造瘘管连接,膀胱灌注生理盐水速度0.1 mL/min,开启灌注泵开始膀胱测压,同时观察膀胱排尿情况。
1.5观察指标大鼠不同状态下的充盈期膀胱基础压、排尿期最大膀胱压、排尿间隔、功能膀胱容量和膀胱顺应性。充盈期基础膀胱压:大鼠每次排完尿液后的膀胱压力;功能膀胱容量:两次排尿间隔期间的膀胱容量改变值;膀胱顺应性:膀胱充盈期的值。测压方法符合国际尿控协会规定的膀胱压力容积测定的基本原则。

2 结 果
2.1深麻醉状态下膀胱测压结果13只大鼠均手术顺利,无大鼠死亡。大鼠在深麻醉状态下,膀胱没有收缩力,膀胱充盈到一定程度出现充盈性尿失禁,膀胱漏点压(bladder leak point pressure,BLPP)为(33.101±7.189)cmH2O(图1),该状态下的膀胱顺应性为(0.017 4±0.012 6) mL/cmH2O。
2.2浅麻醉状态下的膀胱测压结果大鼠在浅麻醉状态下有意识存在,大鼠膀胱可瞬时收缩,大鼠均可自行排尿。该状态下大鼠的基础膀胱压、排尿间隔、功能膀胱容量、膀胱顺应性、排尿期最大膀胱压分别为:(11.490±7.312)cmH2O、(156.306±81.327)s、(0.261±0.136)mL、(0.089 4±0.092 2)mL/cmH2O、(32.027±6.309)cmH2O(表2)。
2.3清醒状态下的膀胱测压结果清醒状态下大鼠的基础膀胱压、排尿间隔、功能膀胱容量、膀胱顺应性、排尿期最大膀胱压分别为:(10.777±4.386)cmH2O、(237.057±124.388)s、(0.389±0.202)mL、(0.104±0.136)mL/cmH2O、(38.144±7.974)cmH2O。
2.4大鼠三个不同状态下膀胱测压结果配对t检验结果显示:浅麻醉状态下大鼠的排尿期最大膀胱压显著小于清醒状态[(32.027±6.309)cmH2Ovs.(38.144±7.974)cmH2O,P<0.05],同时浅麻醉时的排尿间隔和膀胱功能容量也显著小于清醒状态[(156.306±81.327)svs. (237.057±124.388)s,(0.261±0.136)mLvs.(0.389±0.202)mL),P<0.05],在浅麻醉和清醒状态大鼠的膀胱顺应性和基础膀胱充盈压没有显著性差异[(0.089 4±0.092 2)mL/cmH2Ovs.(0.104±0.136)mL/cmH2O,(11.490±7.312)cmH2Ovs. (10.777±4.386)cmH2O,P>0.05],深麻醉状态下的膀胱顺应性[(0.017 4±0.012 6)mL/cmH2O]较浅麻醉[(0.089 4±0.092 2) mL/cmH2O]及清醒状态[(0.104±0.136) mL/cmH2O]低(P<0.05)。比较结果详见表3、图1。
表1麻醉评分标准

分值身体表现1被钳夹刺激肢体没有反应,呼吸深而慢。2被钳夹刺激肢体仅有轻度肌颤但不能活动。3被钳夹刺激肢体有轻度的蜷缩活动,但身体无法移动。4 被钳夹刺激肢体有明显的蜷缩活动,偶尔大鼠会移动身体到别处,呼气频率加快。5 开始有轻度的胡须活动,角膜刺激时有眨眼动作,被钳夹肢体快速蜷缩并有其他肢体的快速活动及身体移动。
1分:深麻醉状态;2~3分:适度麻醉状态;4分:浅麻醉状态;5分:轻微麻醉状态。


麻醉状态基础膀胱压(cmH2O)排尿间隔(s)功能膀胱容量(mL)膀胱顺应性(mL/cmH2O)排尿期最大膀胱压(cmH2O)浅麻醉11.490±7.312156.306±81.3270.261±0.1360.089 4±0.092 232.027±6.309深麻醉---0.017 4±0.012 6-清醒10.777±4.386237.057±124.3880.389±0.2020.104±0.13638.144±7.974

表3 配对t检验结果(n=13)
*有显著性差异。
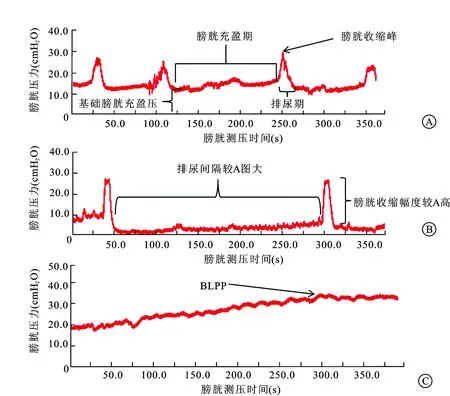
图1 同一只大鼠不同状态下的膀胱测压结果
3 讨 论
大鼠膀胱测压是一项重要的动物实验技术,在膀胱功能的检测中有不可替代的作用,它可以准确地评估膀胱功能,是评估膀胱功能的金标准[12]。目前大鼠的膀胱测压常用的有两种,清醒状态下测压和麻醉状态下测压[13-15],其各自的特点尚未完全明了。我们本次研究发现应用水合氯醛进行麻醉,大鼠在浅麻下膀胱可以自主收缩,但收缩力较清醒状态弱,这和STRENG等[16]的研究结果相似,这可能是因为麻醉药对大脑或膀胱神经的麻醉作用引起,也可能该麻药对膀胱平滑肌本身也有作用。相对于浅麻醉,清醒状态下膀胱有更好的排空能力,排尿间隔也更长,这可能是因为麻醉药可以减弱膀胱排尿时的逼尿肌收缩力,导致大鼠的膀胱排空能力下降,结果大鼠每次排尿后膀胱的残余尿量增加,而膀胱的最大容量没有增加,导致膀胱的功能容量减小,排尿间隔就减小了。
本研究发现在浅麻醉和清醒状态雄性大鼠的基础膀胱压和膀胱顺应性差别没有统计学意义,可能浅麻醉状态下麻醉药对膀胱的基础压及顺应性没有影响。但是我们发现在深麻状态下大鼠的膀胱顺应性较浅麻及清醒状态是下降的,这可能和我们测量深麻醉状态时没有在充盈膀胱前排空膀胱有关,但也有可能在深麻醉状态下大鼠的膀胱顺应性会降低,具体原因有待将来进一步研究。
本研究显示清醒测压是可行的,大鼠性格较温顺,清醒状态下造瘘后的大鼠可以配合实验者完成膀胱测压。虽然大鼠清醒时的活动及紧张会影响膀胱测压结果,但当大鼠在限制性鼠笼待30 min以后,大鼠就会平静下来,这是可以排除这些干扰的。结果也表明耻骨上造瘘测压法是一种很好的大鼠膀胱测压法,应用这种方法无论雌鼠或者雄鼠均可用进行膀胱测压,如果应用尿道插管测膀胱压,因雄性大鼠尿道长而曲折是很难进行的。本研究还显示在浅麻状态下大鼠有意识,可以自行排尿,虽然大鼠膀胱收缩力及排尿功能会部分减弱,但依然可以反映大鼠的膀胱功能。虽然浅麻醉状态对大鼠膀胱功能有一定的影响,但大鼠在浅麻下容易管理,可以经尿道插管,也可以经肛门插管测腹压[17],浅麻醉行膀胱测压有它的优势和可行性。对于一些特殊要求的膀胱测压实验,首选麻醉状态下膀胱测压,如研究活体大鼠的膀胱失神经支配的膀胱功能检测[18]。
清醒状态膀胱测压和麻醉状态膀胱测压各有利弊,清醒测压可以排除麻醉药物的干扰,使测压结果更贴近大鼠膀胱功能的生理状态,但大鼠清醒状态较难操控。麻醉状态测压大鼠容易操控,但测压结果可能受到麻醉药物的一定影响。清醒状态下大鼠膀胱测压一般在判断制作的下尿路功能障碍大鼠模型膀胱功能评估时应用,这样可以更贴近大鼠膀胱病理生理状态,更容易确认膀胱功能障碍的存在与否。例如我们制作膀胱出口梗阻(bladder outlet obstruction,BOO)大鼠模型中,检测大鼠膀胱是否已经被梗阻,在制作膀胱活动过度症(overactive bladder,OAB)OAB模型中检测大鼠膀胱是否存在逼尿肌过度活动及排尿间隔缩短。这些实验需要在大鼠身上同时做的操作较少,不需要对大鼠进行严格的控制。但对于需要严格控制的复杂大鼠实验,同时又要进行大鼠的膀胱测压,浅麻醉下大鼠膀胱测压就比较方便,例如实验需要同时测腹压,需要同时进行药物静脉注入,需要同时进行手术操作或进行上尿路的压力检测等等。
清醒测压时大鼠在自由活动中可能会出现测压连接管的脱落及扭转,我们的经验是应用较小的限制性鼠笼,不少文献里说应用代谢笼,但其体积太大,我们应用的是直径27 cm×16 cm ×13 cm的微型鼠笼加上一个7 cm高的金属网格盖子,效果挺好,连接管很少脱落,另外我们采用分段连接,即在鼠笼上方设置衔接口,可以随时拆卸,这样就可以随时在笼外卸下抽取残余尿,也避免了直接接触动物,另外就是鼠笼中的衔接管尽量软一些,这样可以避免扭转产生的管道堵塞,如果扭转过度可以通过笼外的衔接口调整扭转。调零:我们以大鼠所在笼底为零点,因为大鼠平静后喜欢趴在笼底,大鼠的耻骨联合贴近笼底,一旦调零后接上大鼠膀胱测压管,机器的零点不会随大鼠的移动改变,除非管内有空气,如果那样我们要排净空气后重新调零。
实验中我们虽然仅检测了术后第1天大鼠的尿动结果,但我们观察了雄性大鼠长期带膀胱造瘘管的情况,因该管直径较粗,长期带管容易引起大鼠的前列腺炎及精囊炎,所以如要长期观察大鼠的膀胱功能情况,我们建议应用直径更细的管子PE50管[19-21],这种造瘘管更细,即使长期放置也不容易造成泌尿生殖系统感染,可以避免膀胱及生殖系统炎症对膀胱测压的影响。
总之,我们研究发现浅麻醉和清醒状态的尿动力学部分参数指标是有差异的,浅麻醉状态对膀胱的收缩能力有一定负面影响。我们应该根据实验要求合理选择大鼠的尿流动力学检测方法。

